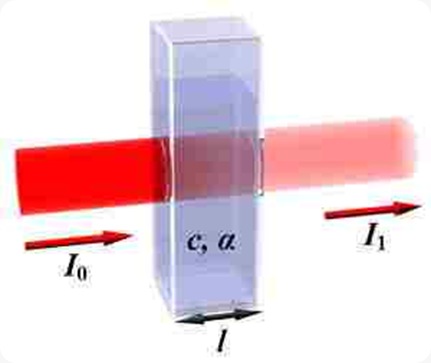
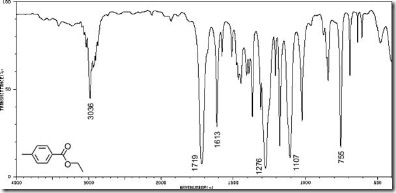
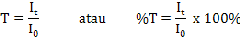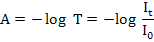Di Industri ter dapat berbagai produk yang komponennya tidak dapat saling melarutkan, namun tetap dapat bercampur secara homogen. Sebagai contoh, mayones dan cat. Mayones adalah campuran homogen dari air dan minyak. Sedangkan cat adalah campuran homogen zat padat dan zat cair. Produk-produk demikian merupakan sistem koloid.
dapat berbagai produk yang komponennya tidak dapat saling melarutkan, namun tetap dapat bercampur secara homogen. Sebagai contoh, mayones dan cat. Mayones adalah campuran homogen dari air dan minyak. Sedangkan cat adalah campuran homogen zat padat dan zat cair. Produk-produk demikian merupakan sistem koloid. Fenomena sistem koloid juga dapat dijumpai di alam dan dalam kehidupan kita sehari-hari. Udara di atmosfer bumi mengandung debu, partikel-partikel zat padat dan zat cair lainnya yang tersebar secara homogen membentuk suatu sistem koloid. Hal inilah yang menyebabkan langit terkadang tampak berwarna biru dan merah-orange. Di dalam tubuh manusia, ginjal berfungsi mengatur komposisi zat-zat kimia dalam darah. Dengan mengambil zat-zat yang diperlukan dan membuang zat-zat yang berbahaya dalam darah. Fungsi ginjal tersebut memanfaatkan sistem koloid. Pemahaman sistem koloid pada ginjal ini telah membawa pada penemuan alat dialisator pengganti fungsi ginjal untuk pasien gagal ginja.
A. Komponen dan Pengelompokan Sistem Koloid
1. Pengertian Sistem Koloid
Fenomena sistem koloid juga dapat dijumpai di alam dan dalam kehidupan kita sehari-hari. Udara di atmosfer bumi mengandung debu, partikel-partikel zat padat dan zat cair lainnya yang tersebar secara homogen membentuk suatu sistem koloid. Hal inilah yang menyebabkan langit terkadang tampak berwarna biru dan merah-orange. Di dalam tubuh manusia, ginjal berfungsi mengatur komposisi zat-zat kimia dalam darah. Dengan mengambil zat-zat yang diperlukan dan membuang zat-zat yang berbahaya dalam darah. Fungsi ginjal tersebut memanfaatkan sistem koloid. Pemahaman sistem koloid pada ginjal ini telah membawa pada penemuan alat dialisator pengganti fungsi ginjal untuk pasien gagal ginja.
A. Komponen dan Pengelompokan Sistem Koloid
1. Pengertian Sistem Koloid
Koloid
adalah suatu campuran zat heterogen antara dua zat atau lebih dimana
partikel-partikel zat yang berukuran koloid (fase terdispersi) tersebar
merata dalam zat lain (medium pendispersi). Ukuran partikel koloid
berkisar antara 1-100 nm (10-7 – 10-5 cm). Bentuk partikel koloid dapat
bermacam-macam seperti ditunjukkan pada gambar berikut. Oleh karena itu,
yang dimaksud dengan ukuran koloid dapat berupa diameter, panjang,
lebar ataupun tebal.
Perbedaan larutan sejati, koloid dan Suspensi dapat dirangkum sebagai berikut.
|
Aspek
|
Larutan Sejati
|
Sistem Koloid
|
Suspensi Kasar
|
| Jumlah fase |
1 |
2 |
2 |
| Distribusi partikel |
Homogen |
Heterogen |
Heterogen |
| Ukuran partikel |
< 10-7 cm |
10-7 – 10-5 cm |
> 10-5 cm |
| Penyaringan |
Tidak dapat disaring |
Dapat disaring jika dengan penyaring ultra |
Dapat disaring |
| Kestabilan |
Stabil |
Stabil |
Tidak stabil |
| Contoh |
Larutan gula |
Mayones |
Campuran pasir dan air |
2. Jenis-Jenis Koloid
Sistem
koloid terdiri dari dua fase, yaitu fasa dispersi dan medium
pendispersi. Kedua fasa tersebut, dapat berwujud zat cair, zat padat
atau berwujud gas. Berdasarkan hubungan antar fase dispersi dan medium dispersi, maka koloid dapat kita kelompokan
- Koloid yang dibentuk oleh fasa terdispersinya gas dalam medium pendispersinya cair adalah buih atau busa. Contoh untuk koloid ini adalah putih telur yang dikocok dengan kecepatan tinggi.
- Buih atau busa padat
adalah jenis koloid yang fasa terdispersinya gas dan medium
pendispersinya padat, jenis koloid ini dapat berupa batu apung dan karet
busa.
- Koloid dengan fasa terdispersi cair dan medium pendispersinya gas dikenal dengan aerosol cair. Contoh koloid ini adalah kabut, awan, pengeras rambut (hair spray) dan parfum semprot.
- Emulsi merupakan jenis
koloid yang dibentuk oleh fasa terdispersi cair di dalam medium
pendispersi cair. Emulsi dapat kita temukan seperti susu, santan,
mayonaise dan minyak ikan.
- Koloid yang disusun oleh fasa terdispersi cair dalam medium pendispersi padat disebut dengan emulsi padat atau gel. Koloid ini sering kita jumpai dalam keju, mentega, jeli, semir padat ataupun lem padat.
- Aerosol padat merupakan yang disusun oleh fasa terdispersi padat dengan medium dispersinya berupa gas. Contohnya asap dan debu di udara.
- Sol merupakan koloid
yang fasa terdispersinya berwujud padat dengan medium pendispersinya
berwujud cair. Sol paling banyak kita jumpai seperti, agar-agar panas,
cat, kanji, putih telur, sol emas, sol belerang, lem dan lumpur.
- Jenis koloid yang terakhir adalah
koloid yang memiliki fasa terdispersi dan medium pendispersinya zat
padat, jenis koloid ini disebut dengan sol padat. Contoh sol padat adalah; batuan berwarna, gelas berwarna, tanah, perunggu, kuningan dan lain-lain.
Sebagai catatan, jika fase terdispersi dan medium pendispersi sama-sama berupa gas, maka campurannya tergolong larutan.
Paduan logam baja tahan karat (stainless steel) termasuk sol pad at dengan fase terdispersi padat (logam Ni dan Cr) dan medium pendispersi padat (logam Fe)
at dengan fase terdispersi padat (logam Ni dan Cr) dan medium pendispersi padat (logam Fe)
Bahan styrofoam termasuk buih padat dengan fase terdispersi gas (CO2, udara) dan medium pendispersi padat (polistirena)

Obat nyamuk dalam kemasan kaleng semprot termasuk aerosol cair dengan fase terdispersi cair dan medium pendispersi gas (udara)
B. Koloid Sol
Sol adalah suatu jenis koloid dengan
fase terdispersi padat dan medium pendispersi berupa zat padat, cair
atau gas. Ada 3 jenis sol, yaitu:
- Sol padat
- Sol cair (sol)
- Sol gas (aerosol padat)
1. Sifat-sifat Koloid Sol
 Sifat
penghamburan cahaya oleh sistem koloid ditemukan oleh John Tyndall
(1820-1893), seorang ahli fisika Inggris. Efek Tyndall digunakan untuk
membedakan sistem koloid dari larutan sejati. Dalam kehidupan
sehari-hari efek Tyndall dapat diamati pada langit yang berwarna biru di
siang hari karena adanya pantulan cahaya dari partikel koloid di udara.
Demikian pula pada saat matahari terbenam pantulan partikel di udara
memberikan warna jingga. Apabila sinar diarahkan pada sistem koloid dan
larutan sejati, contohnya koloid kanji dan larutan Na2Cr2O7, maka sinar tersebut akan dihamburkan oleh sistem koloid tetapi tidak dihamburkan oleh larutan sejati.
Sifat
penghamburan cahaya oleh sistem koloid ditemukan oleh John Tyndall
(1820-1893), seorang ahli fisika Inggris. Efek Tyndall digunakan untuk
membedakan sistem koloid dari larutan sejati. Dalam kehidupan
sehari-hari efek Tyndall dapat diamati pada langit yang berwarna biru di
siang hari karena adanya pantulan cahaya dari partikel koloid di udara.
Demikian pula pada saat matahari terbenam pantulan partikel di udara
memberikan warna jingga. Apabila sinar diarahkan pada sistem koloid dan
larutan sejati, contohnya koloid kanji dan larutan Na2Cr2O7, maka sinar tersebut akan dihamburkan oleh sistem koloid tetapi tidak dihamburkan oleh larutan sejati.
Di bawah
mikroskop ultra, partikel koloid akan tampak sebagai titik cahaya kecil
sesuai dengan sifatnya yang menghamburkan cahaya. Jika pergerakan titik
cahaya atau partikel tersebut diikuti, ternyata partikel tersebut
bergerak terus menerus dengan gerakan zig zag. Gerakan acak ini disebut
gerak Brown, yang ditemukan oleh seorang ahli botani Inggris, Robert
Brown pada tahun 1827. Adanya gerak Brown membuat partikel-partikel ini
tidak memisahkan diri dari medium pendispersinya.
 Adsorpsi
terjadi apabila partikel-partikel sol padat ditempatkan dalam zat cair
atau gas, maka partikel-partikel zat cair atau gas akan terkonsentrasi
pada permukaan zat padat tersebut.
Adsorpsi
terjadi apabila partikel-partikel sol padat ditempatkan dalam zat cair
atau gas, maka partikel-partikel zat cair atau gas akan terkonsentrasi
pada permukaan zat padat tersebut.
Partikel
koloid sol memiliki kemampuan untuk mengadsorpsi partikel-partikel
pendispersi pada permukaannya, baik itu partikel netral atau partikel
bermuatan (kation dan anion). Daya adsorpsi partikel koloid tergolong
besar karena partikel-partikelnya memberikan suatu permukaan yang sangat
luas. Pada proses penyerapan air oleh kapur tulis, sol Fe(OH)3 dalam
air mengandung ion Fe3+ yang diadsorpsi. Sedangkan untuk yang bermuatan
negatif adalah molekul As2S3, ion S2- yang diadsorpsi. Pemanfaatan sifat
adsorpsi dari koloid anatara lain dalam penjernihan air, misalnya
penggunaan tawas untuk mengikat kotoran atau zat warna dari tanah.
 Semua
partikel koloid memiliki muatan sejenis (positif atau negatif). Oleh
karena muatannya sejenis, maka terdapat gaya tolak-menolak antar
partikel koloid. Hal ini mengakibatkan partikel-partikel koloid tidak
dapat bergabung sehingga memberikan kestabilan pada sistem koloid.
Partikel-partikel koloid mendapatkan muatan listrik dengan proses
adsorpsi dan proses ionisasi gugus permukaan partikelnya.
Semua
partikel koloid memiliki muatan sejenis (positif atau negatif). Oleh
karena muatannya sejenis, maka terdapat gaya tolak-menolak antar
partikel koloid. Hal ini mengakibatkan partikel-partikel koloid tidak
dapat bergabung sehingga memberikan kestabilan pada sistem koloid.
Partikel-partikel koloid mendapatkan muatan listrik dengan proses
adsorpsi dan proses ionisasi gugus permukaan partikelnya.
Muatan Beberapa Partikel Koloid dalam Medium Pendispersi Air
|
Partikel koloid bermuatan positif
|
Partikel koloid bermuatan negatif
|
|
Fe(OH)3
Al(OH)3
Hemoglobin
|
As2S3
Logam seperti Au, Ag, Pt
Tanah liat
|
Partikel-partikel
koloid bersifat stabil karena memiliki muatan listrik yang sejenis.
Apabila muatan listrik tersrbut hilang maka partikel-partikel koloid
tersebut akan bergabung membentuk gumpalan. Proses penggumpalan ini
disebut flokulasi dan gumpalannya disebut flok. Gumpalan ini akan
mengendap akibat pengaruh gravitasi. Proses penggumpalan
partikel-partikel koloid dan pengendapannya ini disebut koagulasi.
Peristiwa koagulasi terjadi pada kehidupan sehari-hari seperti pada
pembentukan delta. tanah liat atau lumpur terkoagulasi karena adanya
elektrolit air laut. Proses koagulasi dari karet juga terjadi karena
adanya penambahan asam formiat kadalam lateks. Demikian pula halnya
dengan lumpur koloid dapat dikoagulasikan dengan tawas yang bermuatan.
Penghilangan muatan listrik pada partikel koloid ini dapat dilakukan dengan 4 cara, yaitu:
a. Menggunakan prinsip elektroforesis
Proses
elektroforesis adalah pergerakan partikel-partikel koloid yang bermuatan
ke elektrode dengan muatan berlawanan. Ketika partikel-partikel ini
mencapai elektrode, maka partikel-partikel tersebut akan kehilangan
muatannya sehingga menggumpal dan mengendap di elektrode.
b. Penambahan koloid lain dengan muatan berlawanan
Apabila
suatu sistem koloid bermuatan dicampur dengan sistem koloid lain yang
bermuatan negatif maka kedua sistem koloid tersebut akan saling
mengadsorpsi dan menjadi netral. Akibatnya, terbentuk koagulasi.
c. Penambahan elektrolit
Jika suatu
elektrolit ditambahkan ke dalam sistem koloid maka partikel-partikel
koloid yang bermuatan negatif akan menarik ion positif (kation) dari
elektrolit. Sementara itu. Partikel-patikel koloid yang bermuatan
positif akan menarik ion negatif (anion) dari elektrolit. Hal ini
menyebabkan partikel-partikel koloid tersebut dikelilingi oleh lapisan
kedua yang memiliki muatan berlawanan dengan muatan lapisan pertama.
Apabila jarak antara lapisan pertama dan kedua cukup dekat maka muatan
keduanya akan hilang sehingga terjadi koagulasi.
d. Pendidihan
Sol, seperti
belerang dan perak halida yang terdispersi dalam air dapat mengalami
koagulasi dengan mendidihkannya. Kenaikan suhu sistem koloid menyebabkan
jumlah tumbukan antara partikel-partikel sol dengan molekul-molekul air
bertambah banyak. Hal ini menyebabkan lepasnya elektrolit yang
teradsorpsi pada permukaan partikel koloid. Akibatnya, partikel-partikel
koloid menjadi tidak bermuatan sehingga terjadi koagulasi.
Berdasarkan
perbedaan daya adsorpsi dari fase terdispersi terhadap medium
pendispersinya yang berupa zat cair, koloid dapat dibedakan menjadi dua
jenis. Sistem koloid dimana partikel terdispersinya mempunyai daya
adsorpsi yang relatif besar disebut koloid liofil sedangkan sistem
koloid dimana partikel terdispersinya mempunyai daya adsorpsi yang
relatif kecil disebut kolid liofob. Koloid liofil bersifat lebih stabil
sedangkan koloid liofob bersifat kurang stabil. Koloid liofil yang
berfungsi sebagsi koloid pelindung. Contoh menarik adalah penambahan
koloid liofil ke dalam liofob, dimana koloid liofob terbungkus tidak
mengumpul, seperti pembuatan es krim agar tidak menggumpat ditambahkan
gelatin. Demikian pula halnya dengan cat dan tinta memiliki koloid
pelindung agar tidak mengendap atau menggumpal.
Berdasarkan affinitas partikel-partikel fase dispersi terhadap medium dispersi, maka terdapat dua macam sistem koloid:
- Koloid
Liofil (suka cairan) : adalah koloid yang memiliki gaya tarik menarik
antara partikel-partikel terdispersi dengan medium pendispersi. Medium
pendispersi dalam liofil sering disebut juga dengan hidrofil. Partikel
koloid juga dapat mengadsorpsi molekul cairan sehingga terbentuk
selubung disekeliling partikel koloid. Keberaadan selubung inilah yang
menyebabkan koloid liofil lebih stabil.
- Koloid
Liofob (takut cairan): adalah koloid yang memiliki gaya tarik menarik
yang lemah antara partikel-partikel terdispersi dengan medium
pendispersi. Medium pendispersinya sering disebut dengan hidrofob.
Pertikel-partikel koloid tidak dapat mengadsorpsi pelarutnya sehingga
koloid ini kurang stabil dan dapat dengan mudah terkoagulasikan dengan
penambahan elektrolit.
Perbedaan Sifat-Sifat Sol Liofil/ Hidrofil dan Sol Liofob/ Hidrofob
|
Sifat-sifat
|
Sol liofil/ hidrofil
|
Sol liofob/ hidrofob
|
| 1. Pembuatan |
Sol liofil dapat dibuat langsung dengan mencampurkan fase terdispersi dengan medium pendispersinya. |
Sol liofob tidak dapat dibuat hanya dengan
mencampurkan fase terdispersi dan medium pendispersinya perkecualiannya
adalah pada konsentrasi yang kecil |
| 2. Muatan partikel |
Partikel-partikel sol hidrofil mempunyai muatan yang kecil atau tidak bermuatan |
Partikel-partikel sol hidrofob memiliki muatan positif atau negatif. |
| 3. Adsorpsi medium pendispersi (proses solvasi/ hidrasi) |
Partikel-partikel sol hidrofil mengadsorpsi
medium pendispersinya. Akibatnya terbentuk lapisan medium pendispersi
yang teradsorpsi di sekeliling partikel. Proses ini disebut solvasi/
hidrasi |
Partikel-partikel sol hidrofob tidak
mengadsorpsi medium pendispersinya. Muatan partikel-partikel sol
diperoleh dari adsorpsi partikel-partikel ion yang bermuatan listrik |
| 4. Viskositas |
Viskositas sol liofil lebih besar dibandingkan viskositas medium pendispersinya |
Viskositas sol hidrofob hampir sama dengan viskositas medium pendispersinya |
| 5. Penggumpalan |
Tidak mudah menggumpal dengan penambahan elektrolit |
Mudah menggumpal dengan penambahan elektrolit |
| 6. Efek Tyndall |
Sol liofil memberikan efek Tyndall yang lemah |
Sol liofob dapat memberikan efek Tyndall yang jelas |
| 7. Migrasi dalam medan listrik |
Partikel-partikel sol liofil dapat bermigrasi ke anode, katode atau tidak bermigrasi sama sekali dalam medan listrik |
Partikel-partikel sol liofob akan bergerak ke anode atau ke katode. Hal ini tergantung jenis muatan partikel |
2. Pembuatan Koloid Sol
Ada dua metode dasar pembuatan sistem koloid sol, yaitu:
a. Metode
kondensasi, adalah metode dimana partikel-partikel kecil larutan sejati
(atom, ion atau molekul) bergabung membentuk partikel-partikel berukuran
koloid. Hal ini dilakukan dengan reaksi kimia (dekomposisi rangkap,
hidrolisis dan redoks) atau penggantian pelarut. Contoh:
Sol AgCl dibuat dengan mencampurkan larutan AgNO3 encer dan larutan HCl encer
AgNO3(aq) + HCl(aq) –> AgCl (koloid) + HNO3(aq) (reaksi dekomposisi rangkap)
Sol Al(OH)3 dapat diperoleh dari reaksi hidrolisis garam Al dalam air mendidih
AlCl3(aq) + 3H2O(l) –> Al(OH)3 (koloid) + 3HCl(aq)

Cara Busur Bredig
Cara
mekanik adalah penghalusan partikel-partikel kasar zat padat dengan
penggilingan untuk membentuk partikel-partikel berukuran koloid.
Peptisasi adalah proses dispersi endapan menjadi sistem koloid dengan penambahan zat pemecah yang dapat berupa elektrolit.
Cara busur
Bredig digunakan untuk membuat sol logam seperti Ag, Au dan Pt. Logam
yang akan diubah menjadi partikel-partikel koloid digunakan sebagai
elektrode.
3. Pemurnian Koloid Sol
Partikel-partikel
zat terlarut yang tidak diinginkan dapat mengganggu kestabilan koloid
sehingga harus dihilangkan/ dimurnikan. Beberapa metode pemurnian yang
dapat dilakukan antara lain:

Proses dialisis
Pergerakan
ion-ion dan molekul-molekul kecil melalui selaput semipermeabel disebut
dialisis. Proses dialisis untuk pemisahan partikel-partikel koloid dan
zat terlarut dijadikan dasar bagi pengembangan dialisator sebagi mesin
pencuci darah bagi penderita gagal ginjal.
Pada
dasarnya proses elektrodialisis merupakan proses dialisis di bawah
pengaruh medan listrik dan hanya dapat digunakan untuk memisahkan
partikel-partikel zat terlarut elektrolit. Pada proses elektrodialisis,
listrik tegangan tinggi dialirkan melalui dua layar logam yang menyokong
selaput semipermeabel. Akibatnya, partikel-partikel zat terlarut dalam
sistem koloid berupa ion-ion akan bergerak menuju elektrode dengan
muatan berlawanan.
Partikel-partikel
koloid tidak dapat disaring dengan penyaring biasa seperti kertas
saring karena pori-pori kertas saring terlalu besar dibandingkan ukuran
partikel-partikel koloid. Namun, apabila kertas saring tersebut diresapi
dengan selulosa seperti selofan, maka ukuran pori-pori kertas saring
akan berkurang. Kertas saring yang telah dimodifikasi ini disebut
penyaring ultra.
C. Koloid Emulsi
Emulsi
adalah suatu jenis koloid dengan fase terdispersi berupa zat cair dan
medium pendispersi berupa zat padat, zat cair atau gas. Ada 3 jenis
emulsi, yaitu:
1. Emulsi gas (aerosol cair)
Emulsi gas atau aerosol cair merupakan emulsi dalam medium pendispersi gas. Aerosol cair seperti hairspray
dan obat nyamuk dalam kemasan kaleng, dapat membentuk sistem koloid
dengan bantuan bahan pendorong atau propelan aerosol seperti CFC.
Aerosol cair juga mempunyai sifat-sifat seperti sol liofob, yaitu efek
Tyndall, gerak Brown dan kestabilan dengan muatan partikel.
2. Emulsi cair (emulsi)
Emulsi cair melibatkan campuran dua zat
cair yang tidak dapat saling melarutkan, yaitu zat cair polar dan zat
cair non polar. Emulsi cair yang terdiri dari air dan minyak dapat
digolongkan menjadi dua jenis, yaitu emulsi minyak dalam air dan emulsi
air dalam minyak.
Beberapa sifat emulsi yang penting:
Kestabilan
emulsi cair dapat rusak akibat pemanasan, pendinginan, proses
sentrifugasi, penambahan elektrolit dan perusakan zat pengemulsi.
Pada proses
demulsifikasi dapat terbentuk krim atau sedimentasi. Pembentukan krim
dijumpai pada emulsi minyak dalam air. Apabila kestabilan emulsi ini
rusak, maka partikel-partikel minyak akan naik ke atas membentuk krim.
Sedangkan sedimentasi terjadi pada emulsi air dalam minyak. Apabila
kestabilan emulsi ini rusak, maka partikel-partikel air akan turun ke
bawah.
Emulsi dapat diencerkan dengan
penambahan sejumlah medium pendispersinya. Sebaliknya, fase terdispersi
yang dicampurkan akan spontan membentuk lapisan terpisah. Sifat ini
dapat digunakan untuk menentukan jenis emulsi.
3. Emulsi padat (gel)
Gel
merupakan emulsi dalam medium pendispersi zat padat. Gel dapat dianggap
terbentuk akibat penggumpalan sebagian sol cair. Pada penggumpalan ini,
partikel-partikel sol akan bergabung membentuk suatu rantai panjang.
Rantai ini kemudian akan saling bertaut sehingga terbentuk suatu
struktur padatan dimana medium pendispersi cair terperangkap dalam
lubang-lubang struktur tersebut. Dengan demikian, terbentuk suatu massa
berpori yang semi-padat dengan struktut gel.
Beberapa sifat gel yang penting adalah
- Hidrasi.
Gel elastis yang terhidrasi dapat diubah kembali menjadi gel elastis
dengan menabahkan zat cair. Sebaliknya, gel non elastis yang
terdehidrasi tidak dapat diubah kembali ke bentuk awal.
- Menggembung
(swelling). Gel elastis yang terhidrasi sebagian akan menyerap air
apabila dicelupkan ke dalam zat cair. Akibatnya volum gel bertambah atau
menggembung.
- Sineresis. Gel anorganik akan mengerut jika dibiarkan dan diikuti penetesan pelarut. Proses ini disebut sineresis.
- Tiksotropi.
Beberapa gel dapat diubah kembali menjadi sol cair apabila diberi
agitasi (diaduk). Sifat ini disebut tiksotropi. Contohnya: gel besi
oksida, perak oksida dan cat tiksotropi modern.
D. Koloid Buih
Buih adalah
suatu jenis koloid dengan fase terdispersi berupa gas dan medium
pendispersi berupa zat cair atau zat padat. Berdasarkan medium
pendispersinya tersebut, buih dikelompokkan menjadi 2 yaitu:
1. Buih cair (buih)
Buih cair
adalah sistem koloid dengan fase terdispersi gas dan medium pendispersi
zat cair. Fase terdispersi gas biasanya berupa udara atau CO2
yang terbentuk dari fermentasi. Kestabilan buih diperoleh dari adanya
zat pembuih (surfaktan). Zat pembuih ini teradsorpsi ke daerah antar
fase dan mengikat gelembung-gelembung gas sehingga diperoleh suatu
kestabilan.
Beberapa sifat-sifat buih cair yang penting adalah
- Struktur buih cair berubah dengan waktu. Hal ini dapat disebabkan oleh:
– Drainase atau pemisahan medium pendispersi (zat cair) akibat kerapatan gas dan zat cair yang jauh berbeda
– Rusaknya film antara dua gelembung gas
– Ukuran gelembung gas menjadi lebih besar akibat difusi gelembung gas yang kecil ke gelembung gas yang besar
- Struktur buih cair dapat berubah jika
diberi gaya dari luar. Apabila gaya tersebut kecil, maka struktur buih
akan kembali ke bentuk awal setelah gaya tersebut ditiadakan. Namun jika
gaya yang diberikan cukup besar, maka akan terjadi deformasi.
2. Buih padat
Buih padat
adalah sistem koloid dengan fase terdispersi gas dan medium pendispersi
zat padat. Kestabilan buih padat juga diperoleh dari zat pembuih
(surfaktan). Beberapa buih padat yang kita kenal:
- Batu apung, merupakan buih padat yang terbentuk akibat proses solidifikasi gelas vulkanik
- Roti. Pembuatan roti melibatkan proses peragian yang akan melepas gas CO2. Zat pembuih protein gluten dari tepung kemudian akan membentuk lapisan tipis mengelilingi gelembung-gelembung CO2 untuk membentuk buih padat
E. Koloid dalam Kehidupan Sehari-hari
Sistem
koloid banyak dijumpai dalam kehidupan sehari-hari seperti di alam
(tanah, air dan udara), industri, kedokteran, sistem hidup dan
pertanian. Aplikasi koloid dalam bidang industri khususnya produksi
cukup luas karena sifat karakteristik koloid yang penting, yaitu dapat
digunakan untuk mencampur zat-zat yang tidak dapat saling melarutkan
secara homogen dan bersifat stabil untuk produksi skala besar.
Contoh aplikasi kimia koloid dalam industri
|
Jenis Industri
|
Contoh Aplikasi
|
Industri makananIndustri kosmetika dan perawatan tubuhIndustri cat
Industri kebutuhan rumah tangga
Industri pertanian
Industri farmasi |
Keju, mentega, susu, saus saladKrim, pasta gigi, sabunCat
Sabun, deterjen
Pestisida, insektisida
Minyak ikan, penisilin |
Beberapa aplikasi sistem koloid lainnya:
Gula tebu
yang masih berwarna dapat diputihkan dengan melarutkan gula ke dalam
air, kemudian larutan dialirkan melalui sistem koloid tanak diatomae
atau karbon. Partikel-partikel koloid kemudian akan mengadsorpsi zat
warna tersebut.
- Pengambilan partikel koloid asap dan debu dari gas buangan pabrik
Pengendap
cottrell dapat digunakan untuk memisahkan partikel-partikel koloid
seperti asap dan debu yang terkandung dalam gas buangan pabrik. Hal ini
bertujuan untuk mengurangi zat-zat polusi udara dan untuk memperoleh
kembali debu berharga seperti debu arsenik oksida.
- Pembentukan delta di muara sungai
Air sungai
mengandung partikel-partikel koloid pasir dan tanah liat yang bermuatan
negatif. Sedangkan air laut mengandung ion-ion Na+, Mg2+ dan Ca2+
yang bermuatan positif. Karena air sungai bertemu air laut, maka
ion-ion positif dari air laut akan menetralkan muatan pasir dan tanah
liat. Akibatnya, terjadi koagulasi yang membentuk suatu delta.
Darah
mengandung sejumlah koloid protein yang bermuatan negatif. Jika terdapat
luka kecil, maka luka tersebut dapat diobati dengan pensil stiptik atau
tawas yang mengandung ion-ion Al3+ dan Fe3+. Ion-ion ini akan menetralkan muatan-muatan partikel koloid protein dan membantu penggumpalan darah.
Proses penjernihan air dapat dilakukan dengan penambahan tawas Al2(SO4)3. Tawas mengandung ion Al3+ yang cukup kecil tetapi bermuatan. Ion Al3+ akan terhidrolisis membentuk partikel koloid Al(OH)3 yang bermuatan positif.
Al3+ + 3H2O –> Al(OH)3 + 3H+
Al(OH)3 akan menghilangkan muatan negatif dari partikel-partikel koloid lumpur sehingga terjadi koagulasi. Al(OH)3
akan mnegendap bersama-sama lumpur. Hal ini digunakan dalam proses
pengolahan air bersih, yang diberikan pada penjelasan berikut.
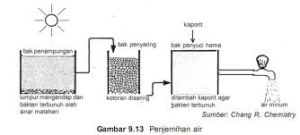 Proses
pengolahan air tergantung pada mutu baku air (air belum diolah). Namun
pada dasarnya melalui 4 tahap pengolahan. Tahap pertama adalah
pengendapan, yaitu air baku dialirkan perlahan-lahan sampai benda-benda
yang tak larut mengendap. Pengendapan ini memerlukan tempat yang luas
dan waktu yang lama. Benda-benda yang berupa koloid tidak dapat
diendapkan dengan cara itu.
Proses
pengolahan air tergantung pada mutu baku air (air belum diolah). Namun
pada dasarnya melalui 4 tahap pengolahan. Tahap pertama adalah
pengendapan, yaitu air baku dialirkan perlahan-lahan sampai benda-benda
yang tak larut mengendap. Pengendapan ini memerlukan tempat yang luas
dan waktu yang lama. Benda-benda yang berupa koloid tidak dapat
diendapkan dengan cara itu.
Pada tahap
kedua, setelah suspensi kasar terendapkan, air yang mengandung koloid
diberi zat yang dinamakan koagulan. Koagulan yang banyak digunakan
adalah aluminium sulfat, besi (II) sulfat, besi (III) klorida, dan
klorinasi koperos (FeCl2Fe2(SO4)3).
Pemberian koagulan selain untuk mengendapkan partikel-partikel koloid,
juga untuk menjadikan pH air sekitar 7 (netral). Jika pH air berkisar
antara 5,5–6,8, maka yang digunakan adalah aluminium sulfat, sedangkan
untuk senyawa besi sulfat dapat digunakan pada pH air 3,5–5,5.
Pada tahap
ketiga, air yang telah diberi koagulan mengalami proses pengendapan,
benda-benda koloid yang telah menggumpal dibiarkan mengendap. Setelah
mengalami pengendapan, air tersebut disaring melalui penyaring pasir
sehingga sisa endapan yang masih terbawa di dalam air akan tertahan pada
saringan pasir tersebut.
Pada tahap
terakhir, air jernih yang dihasilkan diberi sedikit air kapur untuk
menaikkan pHnya, dan untuk membunuh bakteri diberikan kalsium hipoklorit
(kaporit) atau klorin (Cl2).