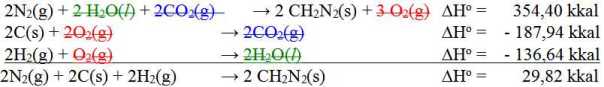PEMBAHASAN SOAL KIMIA
SELEKSI KOMPETISI SAINS MADRASAH (KSM) TINGKAT KAB/KOTA 2013
Oleh Urip Kalteng (http://urip.wordpress.com)
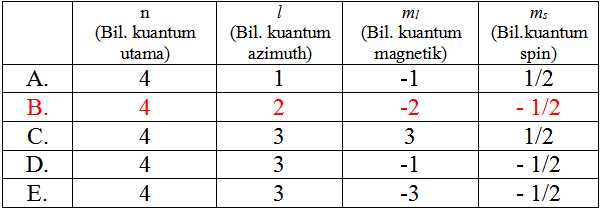
1. Gas mulia xenon ditemukan pertama kali tahun 1962, gas tersebut dapat bersenyawa dengan platina dan fluor. Jika suatu senyawa tersebut terdiri dari 30% Xe, 44% Pt, dan 26% F, maka rumus empiris senyawa tersebut:
A. XePtF
B. XePtF4
C. XePtF5
D. XePtF6
E. XePtF8
Penyelesaian:
Anggap senyawa tersebut 100 gram, sehingga massa:
Xe = 30 g; Pt = 44 g; F = 26 g
Perbandingan mol (massa/massa molar) setiap unsur dalam senyawa:
Xe
Pt
F
Massa : Massa molar
30 : 131,2
44 : 195
26 : 19
Mol Unsur
0,2287
0,2256
1,2684
Bagi dgn angka mol terkecil
0,2287 : 0,2256
0,2256 : 0,2256
1,2684 : 0,2256
Perbandingan
1,0137
1,0000
5,6223
Pembulatan perbandingan
1
1
6
Massa molar setiap unsur tersedia pada tabel periodik yang disediakan.
Jadi rumus kimia senyawa tersebut adalah XePtF6 alternatif D.
2. Sebanyak 156,0 g sampel unsur X dicampur dengan silikon, membentuk 268,3 g senyawa X3Si4 murni. Massa atom X adalah
A. 48
B. 52
C. 55
D. 57
E. 59
Penyelesaian:
Reaksi yang mungkin: 3X + 4Si X3Si4
156,0 g
(268,3 – 156,0) g
268,3 g
156,0 g
112,3 g
268,3 g
Mol
Mol X
112,3 : 28,09 = 4,00 mol
Mol X3Si4
Berdasar perbandingan koefisien reaksi
3 mol
4 mol
1 mol
Karena yang tersedia unsur X sebesar 156,0 g dan ini setara dengan 3 mol maka massa molar unsur X adalah 156,0 g : 3 mol = 52 g/mol (Alternatif B)
2
3. Senyawa LXO3 sebanyak 4,9020 gram dalam keadaan kering dan murni dipanaskan membentuk 1,9200 gram gas oksigen dan padatan LX sebanyak 2,980 gram. Jika padatan LX ditambahkan AgNO3 terjadi reaksi sempurna membentuk AgX sebanyak 5,7380 gram. Massa atom relatif L dan X adalah....
A. L = 39,10 dan X = 70,90
B. L = 39,10 dan X = 35,45
C. L = 22,99 dan X = 70,90
D. L = 22,99 dan X = 35,45
E. L = 39,10 dan X = 79,90
Penyelesaian:
Reaksi yang mungkin: 2LXO3 2LX + 3O2
Massa
4,9020 g
2,9800 g
1,9200 g
Mol
Mol LXO3
Mol LX
1,92 : 32
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
0,06 mol
Jika 2,98 g LX = 0,04 mol, maka massa molar LX = 2,98 g : 0,04 mol = 74,5 g/mol
Reaksi sempurna AgNO3 + LX AgX + LNO3 AgNO3 + LX AgX + LNO3
Massa
2,9800 g
5,7380 g
Mol
0,04 mol
Mol AgX
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
Massa molar AgX = 5,7380 g : 0,04 mol = 143,45 g/mol
Jadi massa molar X = massa molar AgX – massa molar Ag
= 143,45 g/mol – 108 g/mol
= 35,45 g/mol
Massa molar L = massa molar LX – massa molar X
= 74,5 g/mol – 35,45 g/mol
= 39,05 g/mol
Massa molar di sini dianggap sama dengan massa atom relatif jadi jawaban yang mendekati adalah B. L = 39,10 dan X = 35,45
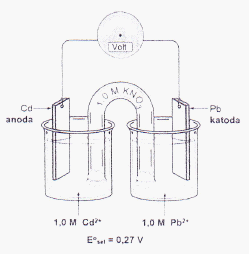
4. Suatu sel elektrokimia disusun dengan menggunakan elektroda Cu dalam larutan Cu(II) dan elektroda Ni dalam larutan Ni(II) sedemikian rupa sehingga reaksi redoks terjadi secara spontan. Diketahui: E0 Cu2+ | Cu = +0,34 V dan E0 Ni2+|Ni = –0,25 V. Jika konsentrasi ion Cu(II) ditingkatan pada suhu tetap, maka pengaruhnya terhadap Esel sel elektrokimia tersebut adalah...
A. Tidak ada perubahan pada nilai Esel
B. Tidak cukup informasi untuk menentukan perubahan nilai Esel
C. Nilai Esel meningkat
D. Nilai Esel berkurang
E. Nilai Esel = 0 V
Penyelesaian:
Karena reaksi berlangsung secara spontan maka E0 harus bernilai + :
Anoda (oksidasi) : Ni Ni2++ 2e- E0 = +0,25 V
Katoda (reduksi) : Cu2+ + 2e- Cu E0 = +0,34 V
Reaksi Redoks : Ni + Cu2+ Ni2++ Cu E0 = + 0,59 V
Terkait dengan peingkatan konsentrasi Cu2+ maka dapat digunakan Persamaan Nernst
3
x Oksidasi + n e- y Reduksi [ ] [ ]
Jika yang ditingkatkan adalah konsentrasi zat yang ter-reduksi maka nilai log dari persamaan itu akan semakin kecil, dengan semakin kecilnya nilai log maka faktor pengurangnya juga semakin kecil artinya E akan semakin besar (meningkat). Bahkan ketika hasil log-nya negatif maka hasilnya E-nya akan lebih meningkat lagi.
5. Suatu sel elektrokimia dirangkai sebagaimana gambar di bawah ini.
Di antara pernyataan berikut yang tepat mengenai perubahan yang terjadi pada anoda dan katoda ketika sel tersebut dioperasikan adalah... Setengah sel oksidasi Setengah sel reduksi
A.
Massa elektroda bertambah
Massa elektroda berkurang
B.
[HO3+] bertambah
Massa elektroda bertambah
C.
[HO3+] bertambah
Massa elektroda berkurang
D.
[HO3+] berkurang
Massa elektroda bertambah
E.
[HO3+] berkurang
Massa elektroda berkurang
Penyelesaian:
Pada anoda (Pt~inert) terjadi reaksi oksidasi : H2 +2H2O 2H3O+ + 2e-
Pada katoda (Cu) terjadi reduksi : Cu2+ + 2e- Cu(s)
Jadi pada setengah sel oksidasi jumlah [HO3+] bertambah dan massa elektroda (Cu) bertambah
6. Elektolisis umum digunakan untuk mendapatkan logarn murni dari ion-ionnya. Suatu percobaan dilakukan dengan memberikan arus sebesar 3 A selama 2 jam terhadap larutan ion logam X yang bermuatan +2. Di akhir percobaan, didapatkan logam X sebanyak 7,1l g. Logam X tersebut adalah
A. Ba
B. Ni
C. Sr
D. Cu
E. Mn
Penyelesaian:
Dari soal diketahui massa endapan (w) = 7,11 g; i = 3 A; t = (2 x 60 x 60 )detik
W = (e . i . t):96500
7,11 g = (e x 3 x 2x60x60):96500
e = 31,76 g
Karena logam tersebut bermuatan +2 maka massa molar-nya = 2 x 31,76 = 63,52 g/mol
Berdasarkan data pada tabel periodik unsur yang memiliki massa molar sekitar 63,52 adalah logam Cu. Alternatif D yang benar.
4
7. Persamaan reaksi kimia yang tepat untuk menunjukkan kesetimbangan es dan air pada suhu 0 oC adalah
A. H2O(s) H2O(l) H2O(g)
B. H2O(s) H2(g) + O2(g)
C. H2O(s) H2O(l)
D. H2O(s) + energi H2O(l)
E. H2O(s) H2O(l) H2(g) + O2(g)
Penyelesaian:
Persamaan reaksi kimia yang tepat adalah H2O(s) + energi H2O(l)
Ketika pada suhu 0oC air membeku (es) dan siap berubah mencair, ketika dikenai energi maka ia berubah wujud menjadi air cair.
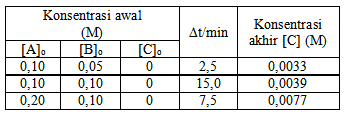
8. Pada suhu tertentu, dalam wadah bervolume 1 L dimasukkan gas H2 dan gas I2 masing-masing sebanyak 2,0 mol. Pada saat kesetimbangan terdapat 3,5 mol gas HI. Nilai Kc reaksi tersebut sebesar
A. 5,3 × 10–3
B. 8,75 × 10–1
C. 3,06 × 100
D. 5,60 × 101
E. 1,96 × 102
Penyelesaian:
Persamaan reaksi setimbang: H2(g) + I2(g) 2HI (g)
Berdasarkan persamaan tersebut maka:
H2(g) + I2(g) 2HI (g)
Mula-mula :
2 mol
2 mol
-
Reaksi :
– 1,75 mol
– 1,75 mol
+3,5 mol
Setimbang :
0,25 mol
0,25 mol
3,5 mol
Karena volume tetap (1) maka pernyataan konsentrasi bisa digunakan jumlah mol zat saja
Kc = [ ] [ ][ ]
9. Kelarutan molar magnesium hidroksida (Ksp = 8 × 10–12 ) dalam suatu larutan penyangga dengan pH = 11 sebesar....
A. 1,7 × 10–4 M
B. 1,0 × 10–11 M
C. 8,0 ×10–12 M
D. 8,0 ×10–9 M
E. 8,0 × 10–6 M
Penyelesaian:
pH = 11 pOH = 3 [OH–] = 10–3 M
Magnesium hidroksida Mg(OH)2
Ksp = [Mg2+][OH-]2
8 × 10–12= [Mg2+](10–3)2
[Mg2+] = (8 × 10–12) : (10–6) = 8 × 10–6 M
Mg(OH)2 Mg2+ + 2OH-
Karena koefisien Mg(OH)2 = koefisien Mg2+ maka kelarutan Mg(OH)2 = [Mg2+] = 8 × 10–6 M
5
10. I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
Perubahan entalpi standar pembentukan yod triklorida ICl3 adalah
A. 176 kJ/mol
B. 138 kJ/mol
C. –88 kJ/mol
D. –138 kJ/mol
E. –214 kJ/mol
Penyelesaian:
Perubahan entalpi standar pembentukan adalah perubahan entalpi untuk pembentukan setiap 1 mol senyawa dari unsur-unsur-nya.
I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
I2(s) + 3 Cl2(g) 2 ICl3(s) ΔHo = -176 kJ (ini pembentukan ICl3(s) sebanyak 2 mol ~ lihat koefisien ICl3(s) ) Jadi perubahan entalpi standar pembentukan ICl3(s) = –176 kJ : 2 mol = –88 kJ/mol
11. Bila 2,3 g dimetil eter (Mr = 46) dibakar pada tekanan tetap, kalor yang dilepaskan adalah 82,5 kJ. Berdasarkan data ini, kalor pembakaran dimetil eter adalah...
A. –2413 kJ/mol
B. +825 kJ/mol
C. –825 kJ/mol
D. +1650 kJ/mol
E. –1650 kJ/mol
Penyelesaian:
Kalor pembakaran dimetil eter untuk setiap mol-nya dapat dihitung dengan suatu cara sebagai berikut:
2,3 g dimetil eter = 2,3 g : 46 g/mol = 0,05 mol ~ 82,5 kJ,
maka kalor pembakaran per mol-nya = 82,5 kJ : 0,05 mol = 1650 kJ/mol
12. Diketahui persamaan termokimia berikut:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = -1400 kJ
2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H2O(l) ΔHo = -3100 kJ
2 H2(g) + O2(g) 2 H2O(l) ΔHo = -570 kJ
Perubahan entalpi untuk reaksi C2H4(g) + H2(g) C2H6(g) adalah
A. –420 kJ
B. –270 kJ
C. –135 kJ
D. +285 kJ
E. +420 kJ
Penyelesaian:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = –1400 kJ
2 CO2(g) + 3 H2O(l) C2H6(g) +3 ½ O2(g) ΔHo = +1550 kJ
H2(g) + ½ O2(g) H2O(l) ΔHo = –285 kJ
C2H4(g) + H2(g) C2H6(g) ΔH = –135 kJ
13. Diketahui energi ikatan:
C=C = 614 kJ/mol; C–Cl = 328 kJ/mol; C–H = 413 kJ/mol
C–C = 348 kJ/mol; Cl–Cl = 244 kJ/mol
Perubahan entalpi bagi reaksi H2C=CH2(g) + Cl2(g) ClH2C–CH2Cl adalah....
A. –31 kJ
B. –62 kJ
C. –93 kJ
D. –124 kJ
E. –146 kJ
6
Penyelesaian: Energi Ikatan pada Ruas Kiri Energi Ikatan pada Ruas Kanan
4 x C–H = 4 x 413 kJ = 1652 kJ
4 x C–H = 4 x 413 kJ = 1652 kJ
1 x C=C = 1 x 614 kJ = 614 kJ
2 x C–Cl = 2 x 328 kJ = 656 kJ
1 x Cl–Cl = 1 x 244 kJ = 244 kJ
1 x C–C = 348 kJ = 348 kJ Total Energi Ikatan = 2.510 kJ Total energi ikatan = 2.656 kJ
Perubahan entalpi = energi ikatan ruas kiri – energi ikatan ruas kanan
Perubahan entalpi = 2.510 kJ – 2.656 kJ = –146 kJ
14. Nitrogen oksida bereaksi dengan hidrogen pada suhu tinggi menurut persamaan:
2NO(g) + 2H2(g) N2(g) + 2H2O(g)
Jika pada waktu tertentu laju reaksi nitrogen oksida 0,36 mol L–1 s–1, maka laju reaksi gas nitrogen adalah....
A. 0,09 mol L–1 s–1
B. 0,18 mol L–1 s–1
C. 0,36 mol L–1 s–1
D. 0,54mol L–1 s–1
E. 0,72 mol L–1 s–1
Penyelesaian:
Hubungan koefisien reaksi di atas secara stoikiometri dengan laju reaksi dapat dituliskan:
Laju rekasi = – ½ [NO]/t = – ½ [H2]/t = + [N2] /t
Laju reaksi = – ½ [NO] /t = + [N2] /t (ingat tanda plus-minus bukan merupakan nilai)
½ x 0,36 mol L–1 s–1 = + [N2] / t
[N2] / t = 0,18 mol L–1 s–1
15. Pada reaksi: H2O2 + 2I– + H+ 2H2O + I2
Jika konsentrasi H2O2 berubah dari 1,00 M menjadi 0,95 M dalam waktu 100 detik, maka perubahan laju rekasi I– dalam M.detik–1 adalah...
A. 0,500
B. 0,200
C. 0,050
D. 0,010
E. 0,001
Penyelesaian:
Penyelesaian soal ini seperti pada pembahasan soal no 14
Laju rekasi = – [ H2O2]/t = – ½ [ I– ]/t
½ [ I– ]/t = [ H2O2]/t
[ I– ]/t = 2 x (1,00 – 0,95)M : 100 detik
= 2 x 0,0005 M/detik
= 0,001 M/detik
16. Pada reaksi: Cl2(g) + 2NO(g) 2NOCl(g)
Jika konsentrasi kedua pereaksi diperbesar 2 kali, laju reaksi menjadi 8 kali semula. Jika hanya konsentrasi Cl2 yang diperbesar 2 kali, laju reaksi menjadi 2 kali semula. Maka orde reaksi NO adalah
A. 0
B. ½
C. 1
D. 2
E. 3
7
Penyelesaian:
Sebaiknya dibuat permisalan seperti contoh berikut:
Percobaan
[Cl2]
[NO]
Laju
1
x
y
v
2
2x
2y
8v
3
2x
y
2v
Orde reaksi (m) terhadap NO kita gunakan data 2 dan 3
(2y/y)m = (8v/2v) 2 m = 4 m = 2
17. Oksidasi NO menjadi NO2 menurut rekasi 2NO(g) + O2(g) 2NO2(g)
Memberikan data sebagai berikut:
Percobaan
[O2], M
[NO], M
Laju NO2 (M/det)
1
0,001
0,001
7,10
2
0,004
0,001
28,40
3
0,004
0,003
255,6
4
0,002
0,002
X
Nilai X dalam tabel tersebut adalah ...
A. 3,65
B. 14,20
C. 28,40
D. 56,80
E. 85,20
Penyelesaian:
Penentuan orde reaksi:
Orde reaksi terhadap O2 (0,004/0,001)x = (28,40/7,10) 4 x = 4 x = 1
Orde reaksi terhadap NO (0,003/0,001)y = (255,6/28,40) 3 y = 9 y = 2
Penentuan konstanta laju reaksi:
Ambil salah satu data percobaan, misal data 1:
v = k[O2] [NO]2
k = V: ([O2] [NO]2) k = 7,10 : (0,001 x (0,001)2) k = 7,10 x 109
Penentuan laju pada data ke 4:
v = 7,10 x 109 x (0,002)(0,002)2 v = 7,10 x 8 v = 56,80
18. Berdasarkan data titik didih berikut, urutan kekuatan interaksi molekular unsur senyawa-senyawa di bawah ini adalah
Senyawa
Titik didih (oC)
Etanol (C2H5OH)
78,4
Etilen glikol (C2H4(OH)2
197,2
Air, H2O
100,0
Dietil eter, C4H10O
34,5
A. dietil eter < etanol
C. dietil eter < etanol < air < etilen glikol
D. etilen glikol < dietil eter < etanol < air
E. etanol < air < dietil eter < etilen glikol
Penyelesaian:
Interaksi molekular dapat ditandai dengan tingginya titik didik suatu senyawa, semakin tinggi titik didih menunjukkan interaksinya semakin kuat. Ketika mendidih maka ia harus mendapatkan energi yang cukup untuk melepaskan kekuatan interaksi yang ia miliki hingga berubah menjadi uap (gas).
Urutan yang benar adalah seperti pada alternatif C. dietil eter < etanol < air < etilen glikol
8
19. Diketahui struktur molekul XCl3 adalah segitiga piramida. Pada sistem periodik, unsur X berada pada golongan
A. 3
B. 5
C. 13
D. 15
E. 17
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh
Struktur molekul yang berbentuk setiga piramida harus memiliki rumus umum AX3E, A atom pusat, 3 pasang elektron berikatan dan sebuah pasangan elektron bebas pada atom pusat. elektron valensi atom pusat berjumlah 5, yaitu 2 (dari pasangan elektron bebas) dan 3 (berasal dari elektron yang digunakan berikatan dengan Cl). Jadi unsur X tersebut terletak pada golongan V-A (elektron valensi 5) atau berada pada golongan 15 pada sistem periodik dengan penggolongan terbaru.
20. Senyawa di bawah ini yang bersifat polar adalah ....
A. NH4+
B. SbCl5
C. I3–
D. ClO2–
E. SnCl4
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh perbedaan keelektronegatifan, semakin besar perbedaan-nya maka senyawa semakin polar. Atau dengan mengamati struktur Lewis-nya atau melihat bentuk molekul-nya. Jika simetris maka bersifat non polar, sebaliknta jika asimetris maka bersifat polar.
NH4+ bentuk molekulnya tetrahedral – non polar
SbCl5 bentuk molekulnya bipiramida trigonal – non polar
I3– bentuk molekulnya linier – non polar
ClO2– bentuk molekulnya bengkok - polar
SnCl4 bentuk molekulnya tetrahedral – non polar
21. Pernyataan berikut berkaitan dengan molekul NH3 dan NF3
(1) NH3 lebih mudah larut dalam air dibandingkan NF3
(2) Hibridisasi atom N pada kedua molekul tersebut adalah sp3
(3) Sudut ikatan pada molekul NH3 ( H–N–H) lebih kecil dibandingkan dengan molekul NF3 ( F–N–F)
(4) Titik didih molekul NH3 lebih kecil dibandingkna dengan NF3
Pernyataan yang benar adalah
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 3 saja
E. 4 saja
Penyelesaian:
Perbandingan beberapa sifat NH3 dengan NF3 :
NH3 lebih mudah larut dalam air dibandingkan NF3, senyawa yang polar akan mudah larut dalam air yang juga bersifat polar, NH3 polar dan akan mudah larut dalam air.
Hibridisasi atom N pada kedua molekul tersebut adalah sp3 (1 pasang elektron bebas, dan 3 pasang elektron berikatan)
Sudut ikatan pada molekul NH3 ( H–N–H) justru lebih besar dibandingkan dengan molekul NF3 ( F–N–F). Pada NH3 elektronegatifitas N lebih besar dibanding H, sementara pada NF3 elektronegatifitas N lebih kecil dibandingkan F. NH3 lebih polar karena terpusatnya pasangan elektron bebas dan ini akan menyebabkan pembesaran sudut ikatan antara N-H, sedang pada NF3 cenderung lebih merata sebaran elektronnya. ( H–N–H = 107o, F–N–F = 102o)
9
Titik didih molekul NH3 lebih besar dibandingkan dengan NF3, ini dapat dikaitkan dengan polaritas antara kedua senyawa bahwa NH3 lebih polar dibanding NF3 senyawa polar akan memiliki titik didih yang lebih tinggi yang juga terkait adanya ikatan hidrogen pada senyawa NH3.
22. Kelarutan PbCl2 dalam larutan HCl lebih besar karena
A. Efek ion senama
B. PbCl2 lebih mudah terionisasi dalam suasana asam
C. Pembentukan senyawa kompleks [PbCl4]2–
D. PbCl2 bersifat basa
E. HCl lebih polar dibandingkan air
Penyelesaian:
Ketika PbCl2 dilarutkan dalam HCl (artinya HCl ini berlebih) maka kelarutan PbCl2 akan meningkat kelebihan ion klorida (Cl–) ini akan bereaksi dengan ion Pb2+ membentuk ion kompleks [PbCl4] 2–yang stabil seperti reaksi berikut: PbCl2 Pb2+ + 2Cl– Pb2+ + 4Cl– [PbCl4] 2–
23. Diketahui Ksp AgI = 8,3 × 10–17 dan Ksp PbI2 = 7,9 × 10–9 . Konsentrasi I- minimum yang diperlukan untuk mengendapkan ion Ag+ dalam suatu larutan yang mengandung campuran ion Ag+ (0,1 M) dan Pb2+ (0,1 M) adalah
A. 8,30 × 10–16
B. 9,11 × 10–9
C. 7,90 × 10–8
D. 2,80 × 10–4
E. 1,99 × 10–3
Penyelesaian:
AgI Ag+ + I-
0,1 M [I-]
Ksp AgI = [Ag+][I-]
8,3 × 10–17 = [0,1][I-],
[I-] = 8,3 × 10–17 : 0,1
[I-] = 8,3 × 10–16 M
PbI2 Pb2+ + 2I-
0,1 M [I-]
Ksp PbI2 = [Pb+2] [I-]2
7,9 × 10–9 = [0,1] [ I-]2
[ I-]2 = 7,9 × 10–8
[ I-] = √(7,9) × 10–4 M
Karena yang ditanyakan adalah konsentrasi ion I- minimum maka jawaban yang tepat adalah [I-] = 8,3 × 10–16 M
24. Diketahui Kb NH3 = 1,8 × 10–5 dan Ka HC2H3O2 = 1,8 × 10–5. Nilai pH dari larutan amonium asetat, NH4C2H3O2 0,065 M adalah
A. 1,19
B. 2,96
C. 7,00
D. 11,06
E. 12,81
Penyelesaian:
Ketika garam yang terbentuk dari asam lemah dan basa lemah yang memiliki Ka = Kb maka berapapun konsentrasi garam itu pH-nya dianggap netral = 7
25. Suatu larutan buffer sebanyak 1 L mengandung campuran 0,14 M HC2H3O2 dan 0,27 M C2H3O2–. Diketahui Ka HC2H3O2 = 1,8 × 10–5 . Nilai pH larutan buffer tersebut setelah ditambah 0,025 mol HCl adalah
A. 0,85
B. 1,15
C. 4,92
D. 5,03
E. 6,47
10
Penyelesaian:
Larutan buffer ditambah sedikit asam kuat maka akan terjadi peningkatan jumlah mol asam dan pengurangan jumlah konjugat (karena konjugatnya bereaksi dengan H+ membentuk asam tadi).
HC2H3O2 = CH3COOH, C2H3O2– = CH3COO-
1 L CH3COOH 0,14 M = 0,14 mol
1 L CH3COO- 0,27 M = 0,27 mol
HCl = 0,025 mol =
Ka CH3COOH = 1,8 × 10–5 pKa = 5 – log 1,8
CH3COOH H+ + CH3COO-
Mula-mula :
0,14 mol
0,27 mol
Perubahan :
+ 0,025 mol
– 0,025 mol
Akhir :
0,165 mol
?
0,255 mol
pH = pKa + log (0,255/0,165)
pH = 5 – log 1,8 + log 1,545
pH = 5 – 0,26 + 0,19 = 4,93
26. Dalam perkembangan teori atom tercatat beberapa hal berikut:
(1) Percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom
(3) Data-data eksperimen selain atom hidrogen diperoleh dari hasil percobaan Bohr
Pernyataan yang benar adalah....
A. 1, 2, dan 3
B. 1 dan 2
C. 2 dan 3
D. 1 saja
E. 3 saja
Penyelesaian:
(1) Benar bahwa percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom dengan melakukan penembakan menggunakan sinar alfa pada lempeng tipis emas, ternyata sebagian ada yang dibelokkan (yang mengenai inti atom).
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom hidrogen beserta spektrumnya.
(3) Data-data eksperimen hanya atom hidrogen diperoleh dari hasil percobaan Bohr
27. Berdasarkan letaknya dalam sistem periodik, muatan, dan jumlah elektronnya, maka urutan ukuran atom/ion isoelektronik di bawah ini adalah
A. Ca2+ > K+ > Ar > Cl– > S2–
B. S2– > Cl– > Ar > K+ > Ca2+
C. S2– > Ca2+ > Cl– > K+ > Ar
D. Cl– > S2– > Ca2+ > K+ > Ar
E. Ca2+ > S2– > K+ > Ar > Cl–
Penyelesaian:
Sesuai data pada tabel periodik unsur diketahui bahwa:
S nomor atom 16
Cl nomor atom 17
Ar nomor atom 18
K nomor atom 19
Ca nomor atom 20
Ukuran atom/ion isoeletronik (memiliki jumlah elektron sama dalam hal ini semua punya 18 elektron) semakin kecil jika jumlah proton (= nomor atom) semakin besar.
Dengan demikian urutan yang benar adalah S2– > Cl– > Ar > K+ > Ca2+ sesuai dengan alternatif B
11
28. Pasangan unsur yang mempunyai ukuran/volume atom yang hampir sama adalah
A. K, Ca
B. Ti, Zr
C. K, Rb
D. Ne, Kr
E. HF , Zr
Penyelesaian:
Dapat disimak dalam tabel periodik unsur, bahwa unsur yang terletak dalam satu periode akan memiliki ukuran volume yang hampir sama, terutama yang memang golongannya berdekatan. Dalam hal ini pasangan yang punya volume atom yang hampir sama adalah K dan Ca terletak pada periode ke 3 (K golongan IA (golongan 1), Ca golongan IIA(golongan 2)).
29. Suatu senyawa murni terdiri dari C, H, N, O, S, dan Fe. Jumlah atom Fe dalam senyawa tersebut adalah satu. Kadar Fe dalam senyawa tersebut 8,09% (w/w). Massa molekul relatif senyawa tersebut adalah ....
A. 56
B. 346
C. 453
D. 692
E. 785
Penyelesaian:
Ar Fe = 56 massa molar Fe = 56 g/mol
% Fe = massa molar Fe : massa molar senyawa (Mr)
8,09% = 56 : Mr Senyawa
0,0809 = 56 : Mr Senyawa
Mr Senyawa = 56 : 0,0808 = 692,21 ~ 692
30. Perhatikan pernyataan berikut:
(1) Titik didih/leleh unsur golongan non logam dari bawah ke atas makin besar sebab kekuatan ikatan van des Waals yang terjadi makin kuat
(2) Semua senyawa logam memiliki kecenderungan untuk membentuk ion kompleks
(3) Keelektronegatifan unsur golongan logam dari atas ke bawah makin kecil
Pernyataan di atas benar, kecuali:
A. 1, 2, 3
B. 1, 2
C. 2, 3
D. 1 saja
E. 3 saja
Penyelesaian:
Cukup jelas, titik didih unsur golongan non logam dari bawah ke atas semakin kecil dan tidak semua senyawaan logam dapat membentuk ion kompleks.
31. Sifat-sifat berikut yang bukan sifat koloid adalah
A. Dapat mengalami koagulasi
B. Menunjukkan efek Tyndall
C. Jika mengadsorbsi ion, dapat dipisahkan dengan elektroforesis
D. Terdiri dari satu fasa
E. Menunjukkan gerak Brown
Penyelesaian:
Sifat koloid salah satunya adalah memiliki dua fasa (bukan satu fasa), yaitu fasa terdispersi dan medium pendispersi.
12
32. Senyawa yang dapat digunakan sebagai penstabil emulsi adalah
A. ZnS2
B. Natrium oleat
C. HCl
D. Na2S2O3
E. Natrium asetat
Penyelesaian:
Senyawa yang dapat digunakan sebagai penstabil emulsi antara lain natrium oleat,
33. Di antara unsur-unsur di bawah ini yang mempunyai afinitas elektron terbesar adalah
A. Be
B. B
C. C
D. N
E. Ne
Penyelesaian:
Unsur-unsur yang di sajikan pada alternatif jawaban adalah unsur yang terletak dalam satu periode. Dalam satu periode dari kiri ke kana afinitasnya semakin besar. Ne terletak paling kanan dalam tabel periodik unsur. Jadi Ne-lah yang mempunyai afinitas elektron terbesar.
34. Dalam suasana basa, logam kobalt (Co) dapat mengalami reaksi oksidasi menjadi Co(OH)3 sementara natrium hipoklorit, NaOCl, dapat dioksidasi menjadi NaCl. Apabila reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCl yaitu:
A. 2 dan 3
B. 1 dan 3
C. 3 dan 2
D. 1 dan 2
E. 3 dan 1
Penyelesaian:
Reaksi Oksidasi : Co Co3+ + 3e- |x2
Reaksi Reduksi : H2O + OCl- + 2e- Cl- + 2OH- |x3
Reaksi redoks : 2Co + 3H2O + 3OCl- 2Co3+ + 3Cl- + 6OH-
Reaksi lengkapnya: 2Co + 3H2O + 3NaOCl 2 Co(OH)3 + 3NaCl
Jadi koefisien reaksi kobalt = 2, dan koefisien reaksi NaOCl = 3
35. Hidrogensulfat atau ion bisulfat, HSO4- dapat bertindak sebagai asam atau basa di dalam air. Di antara persamaan reaksi berikut, ion HSO4- yang bertindak sebagai asam adalah dalam reaksi:
A. HSO4– + H2O H2SO4 + OH-
B. HSO4– + H3O+ SO3 + 2H2O
C. HSO4– + OH- H2SO4 + O2-
D. HSO4– + H2O SO42– + H3O+
E. HSO4– + H3O+ H2SO4 + H2O
Penyelesaian:
Jika suatu spesi mampu melepaskan proton (ion H+) maka ia dikatakan bertindak sebagai basa, sementar itu H2O akan bertindak sebagai basa yang ditandai dengan diterima-nya ion H+ dari ion HSO4- membentuk H3O+. Jadi reaksi pada alternatif D yang menunjukkan HSO4- bertindak sebagai asam.
13
36. Larutan 0,2 M natrium klorobenzoat (NaC7H4ClO2) memiliki pH 8,65. Nilai pH larutan 0,2 M asam klorobenzoat (HC7H4ClO2) adalah
A. 5,35
B. 8,65
C. 2,35......? pH = 2,65
D. 3,45
E. 3,25
Penyelesaian:
Natrium klorobenzoat adalah garam yang berasal dari basa kuat dengan asam lemah, sehingga ia bersifat basa (pH > 7)
Untuk dapat menghitung pH asam klorobenzoat harus diketahui Ka asam tersebut, Ka ini dapat dihitung dari hitungan garam-nya.
pH = 8,65 pOH = 14 – 8,65 = 5,35 [OH-] = 10–5,35 M [ ][ ]
[H+] = √ = 10–2,65 pH = 2,65
Dari alternatif jawaban tidak tersedia.
37. Warfarin digunakan sebagai racun tikus. Jumlah pusat kiral yang terdapat dalam molekul warfarin di bawah ini adalah
A. 0
B. 1
C. 2
D. 3
E. 4
Penyelesaian:
Atom C kiral (pusat kiral) adalah atom C yang mengikat 4 gugus berbeda-beda, pada molekul warfarin terdapat 1atom C kiral yang ditunjukkan pada lingkar merah gambar berikut ini:
Setiap ujung ikatan dan setiap sudut menunjukkan
adanya atom C, atom H tidak ditampilkan, setiap
atom C memiliki 4 ikatan, kalau tidak tampak
sebanyak 4 ikatan artinya ada satu ikatan C dengan
atom H.
38. Di antara pasangan senyawa di bawah ini, yang memiliki titik didih yang identik adalah
A. CH3CH2CH2CH2OH dan (CH3)2CHCH2OH
B. CH3(CH2)4CH3 dan (CH3)2CHCH(CH3)2
C.
D.
E.
14
Penyelesaian:
Senyawa dengan rumus struktur sama dan rumus molekul yang sama akan memiliki titik didih yang identik. Pada alternatif D rumus molekul dan rumus strukturnya sama, hanya letak gugus Cl ada yang ke arah belakang bidang datar dan ke arah depan bidang datar.
39. Berikut ini adalah struktur vitamin C (asam askorbat):
Pernyataan yang tepat mengenai jumlah atom karbon kiral dan konfigurasi absolut atom C kiral yang terdapat pada cincin adalah
A. 1 dan R
B. 2 dan R
C. 1 dan S
D. 2 dan S
E. 3 dan R
Penyelesaian:
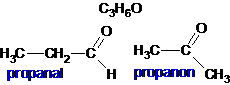
40. Jumlah isomer, termasuk isomer geometrinya yang dimiliki senyawa C3H4Cl2 adalah
A. 3
B. 4
C. 5
D. 6
E. 7
Penyelesaian:
Tidak tersedia jawaban......!