Berikut ini, yang manakah urutan dari bilangan kuantum suatu elektron dalam orbital 4d?
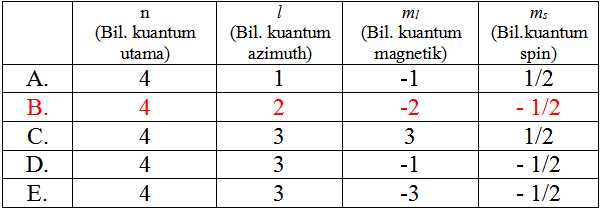
Pembahasan:
Bilangan kuantum suatu elektron dalam orbital 4d yang n = 4; l = 2 (d)
Jawabannya B
Soal Nomor 7:
Berikut ini diberikan data entalpi reaksi:
2 CH2N2(s) + 3 O2(g) → 2N2(g) + 2 H2O(l) + 2CO2(g) ΔHo = – 354,40 kkal
C(s) + O2(g) → CO2(g) ΔHo = – 93,97 kkal
2H2(g) + O2(g) → 2H2O(l) ΔHo = – 136,64 kkal
Nilai entalpi pembentukan bagi CH2N2 (s) adalah :
- 123,79 kkal/mol
- 14,91 kkalmol
- -14,91 kkal/mol
- - 29,82 kkal/mol
- 29,82 kkal/mol
Pada soal ini aslinya ada yang keliru, pada persamaan reaksi pertama seharusnya 2H2O(l) tetapi hanya tertulis 2 H2(l).
Entalpi pembentukan adalah energi yang digunakan untuk membentuk 1 mol senyawa dari unsur-unsurnya.
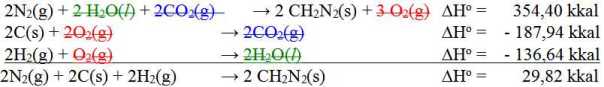
N2(g) + C(s) + H2(g) → CH2N2(s) ΔHo = 14,91 kkal
Jawabannya B
Soal Nomor 8:
Dalam senyawa atau ion yang mengandung sulfur berikut ini, muatan formal atom S dalam SO2, SO3, SO32-, dan SO42- berturut-turut adalah
- 0, 0, 0, 0
- -2, 0, 0, +1
- 0, +1, -2, 4
- 0, 0, +1, -2
- +1, 0, 0, -2
Muatan formal = jumlah elektron valensi unsur – jumlah elektron bebas – 1/2 elektron berikatan
S dan O memiliki 6 elektron valensi
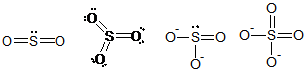 Muatan formal S pada SO2 = 6 – 2 – 4 = 0
Muatan formal S pada SO2 = 6 – 2 – 4 = 0Muatan formal S pada SO3 = 6 – 0 – 6 = 0
Muatan formal S pada SO32- = 6 – 2 – 4 = 0
Muatan formal S pada SO42- = 6 – 0 – 6 = 0
Atom S itu berada diperiode tiga (3), sangat dimungkinkan untuk menggunakan orbital 3d sehingga tidak lagi mengikuti kaidah oktet. Beda dengan unsur yang berada di periode 2 yang tidak memiliki orbital 2d. Jadi tidak bisa dipaksa harus mengikuti kaidah oktet, ini terkait juga dengan tingkat energi masing-masing molekul yang lebih disukai pada energi yang relatif lebih rendah.
Jawabannya A
Soal Nomor 9:
Diberikan molekul berikut ini:
I. H2C=CHCl
II. cis-ClHC=CHCl
III. trans-ClHC=CHCl
Manakah molekul tersebut yang mempunyai momen dipol tidak sama dengan NOL?
- hanya I
- hanya III
- hanya I dan II
- Hanya II dan III
- I, II, dan III
Molekul III (trans-ClHC=CHCl) memiliki momen dipol sama dengan nol, sedangkan pada molekul I dan II momen dipolenya tidak sama dengan nol, hayooo apa alasan….?
Jawabannya C
Soal Nomor 10:
Berikut ini adalah reaksi kesetimbangan:
4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ
Bila reaksi sudah mencapai kesetimbangan, berikut ini manakah keadaan yang akan menggeser kesetimbangan ke arah kiri (membentuk reaktan lebih banyak):
- Menurunkan temperatur
- Menaikkan tekanan parsial C
- Menaikkan tekanan sistem
- Menambah konsentrasi A
- Menaikkan temperatur
Reaksi 4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ adalah reaksi eksoterm, maka agar bergeser ke reaktan maka dapat dilakukan dengan menaikkan temperaturnya. Koefisien zat berwujud gas sama sehingga tekanan tidak mempengaruhi, sementara menambah konsentrasi A akan menggeser kesetimbangan ke kanan.
Jawabannya E








No comments:
Post a Comment