TURUNAN ASAM KARBOKSILAT : ESTER
Ester merupakan kelompok senyawa organik yang memiliki rumus umum RCOOR1. Ester termasuk turunan asam karboksilat yang gugus –OH dalam rumus RCOOH diganti oleh gugus –OR1. Dengan demikian rumus umum ester adalah
TATANAMA ESTER
Pemberian nama
pada ester diawali dengan menyebut nama gugus alkil atau aril yang
menggantikan atom H dalam gugus –COOH pada asam asam karboksilat
induknya kemudian di ikuti nama asam tersebut tanpa menyebut kata asam.
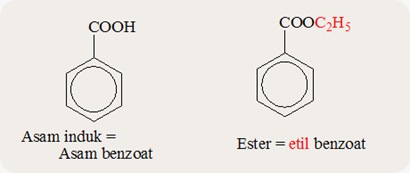
Contoh
Asam induk = CH3CH2CH2COOH
IUPAC = asam pentanoat
Trivial = asam valerat
Ester = CH3CH2CH2COOC2H5
IUPAC = etil pentanoat
Trivial = etil valerat
3-metilbutil asetat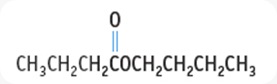
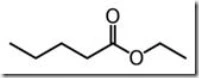
Butil butanoat
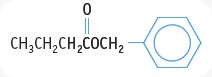
Benzil butanoat
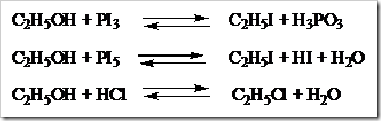
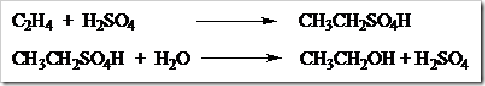
PEMBUATAN ESTER
Ester dibuat
dengan mereaksikan alkohol atau fenol dengan asam karboksilat kemudian
direfluks. Fenol yaitu senyawa organik dimana gugus -OH langsung terikat
pada cincin benzena. Reaksi pembuatan ester disebut esterifikasi dan reaksi yang terjadi disebut reaksi esterifikasi Fischer.
Reaksi esterifikasi merupakan reaksi reversibel yang sangat lambat,
tetapi bila menggunakan katalis asam mineral seperti asam sulfat (H2SO4)
dan asam klorida (HCl) kesetimbangan akan tercapai dalam waktu yang
cepat. Pola umum dalam pembuatan ini dinyatakan dengan persamaan berikut
RCOOH + R1OH ↔ RCOOR1 + H2O
Dalam reaksi esterifikasi, ion H+ dari H2SO4
berperan dalam pembentukan ester dan juga berperan dalam reaksi
sebaliknya yakni hidrolisis ester. Sesuai dengan hukum aksi massa, untuk
memperoleh rendemen ester yang tinggi maka kesetimbangan harus bergeser
ke arah pembentukkan ester. Untuk mencapai keadaan ini dapat ditempuh
dengan cara:
a. Salah satu pereaksi digunakan secara berlebih. Biasanya alkohol dibuat berlebih karena murah dan mudah diperoleh.
b. Membuang salah satu produk dari dalam campuran reaksi
Laju reaksi
esterifikasi suatu asam karboksilat bergantung pada halangan sterik
dalam alkohol dan asam karboksilatnya. Dengan bertambahnya halangan
sterik di dalam zat antara, laju pembentukkan ester akan menurun. Dengan
demikian rendemen ester akan berkurang.
Esterifikasi
dipengaruhi oleh beberapa faktor, diantaranya adalah struktur molekul
dari alkohol, suhu dan konsentrasi reaktan maupun katalis. Kereaktifan
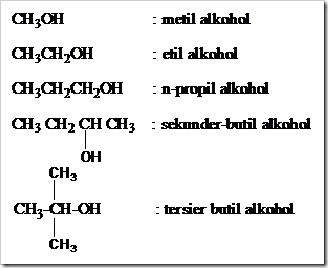
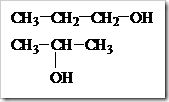
alkohol terhadap esterifikasi: CH3OH > alkohol primer > alkohol sekunder > alkohol tersier
Kereaktifan asam karboksilat terhadap esterifikasi : HCOOH > CH3COOH > RCH2COOH > R2CHCOOH > R3CCOOH
Selain dibuart
dari asam karboksilat, ester juga dapat diperoleh dengan cara
mereaksikan suatu klorida asam atau suatu anhidrida asam dengan alkohol
atau fenol. Reaksi pembuatan ester dari klorida asam dan anhidrida asam
mengikuti pola umum reaksi berikut.
Klorida asam
RCOCl + R1OH → RCOOR1 + HCl
RCOCl + ArOH → RCOOAr + HCl
Anhidrida asam
(RCO)2O + R1OH → RCOOR1 + RCOOH
(RCO)2O + ArOH → RCOOAr + RCOOH
REAKSI-REAKSI ESTER
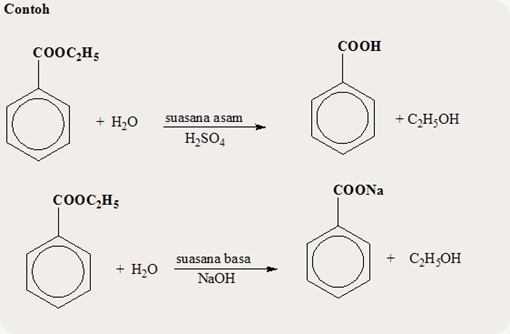
a. Reaksi hidrolisis
Reaksi
hidrolisis ester dalam suasana asam menghasilkan asam karboksilat dan
alkohol, namun bila reaksi hidrolisis dilangsungkan dalam suasana basa
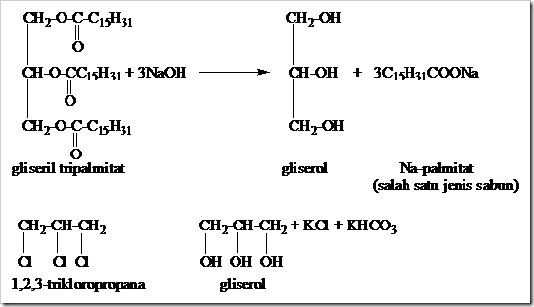
diperoleh garam karboksilat dan alkohol. Hidrolisis ester dengan basa
dise4but reaksi Penyabunan (Saponifikasi).
b. Reaksi dengan Amonia
Produk reaksi antara ester dengan amonia adalah suatu amida dan suatu alkohol. Contoh : reaksi antara etil asetat dengan amonia menghasilkan asetamida dan etanol.
CH3COOC2H5 + NH3 → CH3CONH2 + C2H5OH
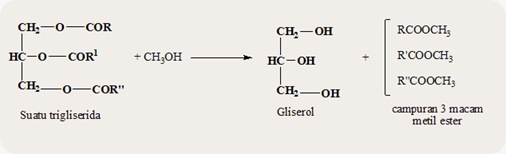
c. Transesterifikasi
Jika suatu
ester direaksikan dengan suatu alkohol maka akan diperoleh ester baru
dan alkohol baru. Reaksi ini disebut reaksi transesterifikasi yang dapat
berlangsung dalam suasana asam dan basa mengikuti pola umum berikut
ini.
RCOOR1 + R”OH ↔ RCOOR” + R1OH
Reaksi diatas disebut transesterifikasi karena terjadi pertukaran antara gugus alkil dalam –OR1 pada ester dengan gugus alkil dalam ikatan R”O.
Contoh reaksi antara suatu trigliserida dengan metanol.
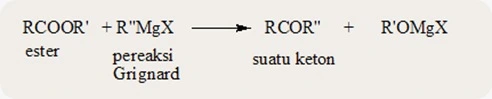
d. Reaksi dengan pereaksi Grignard
Reaksi antara
suatu ester dengan pereaksi Grignard merupakan cara istimewa dalam
pembuatan alkohol tersier. Pola umum dari reaksi ini adalah sebagai
berikut.
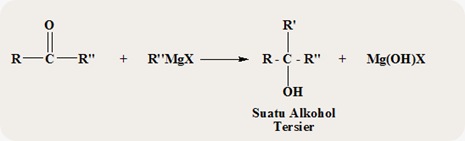
Bila keton yang
diperoleh di atas direaksikan lebih lanjut dengan R’’MgX maka pada
akhirnya diperoleh suatu alkohol terseir menurut persamaan reaksi
berikut ini.
SIFAT FISIKA DAN KEGUNAAN ESTER
Ester yang
memiliki 3 sampai 5 atom karbon dapat larut dalam air dan selebihnya
tidak larut dalam air. Ester merupakan kelompok senyawa organik yang
memiliki aroma yang wangi seperti bunga dan buah sehingga banyak
digunakan sebagai pengharum (essence), sarirasa dalam industri makanan
dan minuman. Ester yang digunakan biasanya yang berwujud cair pada suhu
dan kamar.
Titik leleh dan
titik didih ester lebih rendah dibanding asam karboksilat dan alkohol
asamnya. Hal ini disebabkan dalam ester tidak terbentuk ikatan hidrogen
antarmolekulnya sedangkan pada alkohol dan asam karboksilat terjadi
ikatan hidrogen antarmolekulnya. Adanya ikatan hidrogen inilah yang
menyebabkan titik leleh dan titik didih alkohol asalnya lebih tinggi.
Kelompok ester yang memiliki aroma buah disajikan pada tabel berikut ini, (dikutib dari wikipedia.org).
Fakta-Fakta Karbon
Posted by pada 4 November 2011
Karbon
memainkan peran yang besar dalam kehidupan manusia. Dari karbon dioksida
di udara, untuk grafit pada pensil. Pelajari lebih lanjut tentang
penggunaan karbon, atom karbon, sifat karbon, hidrokarbon, struktur
karbon, serat karbon, karbon monoksida,untuk menemukan fakta menakjubkan
lainnya.
-
Karbon adalah suatu unsur kimia dengan simbol C dan nomor atom 6, dengan 4 elektron valensi yang akan digunakan untuk membentuk ikatan kovalen.
-
Kata karbon berasal dari kata Latin carbo, yang berarti batubara.
-
Karbon membentuk sejumlah besar senyawa, lebih dari unsur lainnya. Karena kesediaannya untuk obligasi untuk unsur-unsur non logam lainnya sering disebut sebagai blok bangunan kehidupan.
-
Sementara karbon membentuk senyawa yang berbeda itu adalah elemen yang relatif tidak reaktif.
-
Ada beberapa alotrop (bentuk berbeda) karbon. yang paling terkenal yaitu karbon amorf (batubara, jelaga dll), berlian dan grafit.
-
Sifat dari berlian dan grafit sangat berbeda dengan berlian yang transparan dan sangat keras saat grafit hitam dan lembut (soft cukup untuk menulis di atas kertas).
-
Grafit digunakan untuk isolasi termal (tarif yang lebih rendah perpindahan panas) properti. Ini juga merupakan konduktor yang sangat baik atau listrik.
-
Atom karbon dalam grafit terikat di kisi heksagonal datar dan berlapis membentuk lembaran.
-
Karbon adalah unsur paling banyak ke-4 di alam semesta (setelah hidrogen, helium dan oksigen). Dan merupakan elemen yang paling banyak ke-15 di kerak bumi sementara itu merupakan elemen kedua yang paling banyak dalam tubuh manusia.
-
Karbon memiliki titik leleh tertinggi dari semua elemen, sekitar 3500°C (3773 K, 6332°F).
-
Hidrokarbon adalah senyawa organik yang seluruhnya terbuat dari molekul hidrogen dan karbon. Kimia organik melibatkan studi tentang hidrokarbon.
-
Senyawa hidrokarbon yang paling sederhana adalah metana (CH4).
-
Karbon ini ditemukan oleh peradaban awal manusia dalam bentuk arang dan jelaga.
-
Jejak karbon merujuk pada jumlah emisi gas rumah kaca yang disebabkan oleh sebuah organisasi, negara atau individu.
-
Siklus karbon adalah proses di mana karbon dipertukarkan antara semua bagian Bumi dan organisme hidupnya. Hal ini sangat penting untuk kehidupan di Bumi, yang memungkinkan karbon untuk terus digunakan kembali dan didaur ulang.
-
Karbon ditemukan di atmosfer bumi dalam bentuk karbon dioksida (CO2). Meskipun hanya membuat sebuah persentase kecil dari atmosfer memainkan peran penting, termasuk yang digunakan oleh tanaman selama fotosintesis.
-
Karbon monoksida (CO) sangat beracun bagi manusia dan hewan. Terbentuk dalam kondisi ketika tidak ada cukup oksigen untuk membentuk karbon dioksida (CO2). Di banyak negara di seluruh dunia, keracunan karbon monoksida adalah jenis yang paling umum dari keracunan yang fatal.
-
Serat karbon adalah bahan yang kuat yang terdiri dari serat tipis yang terbuat sebagian besar terdiri dari atom karbon yang terikat bersama-sama dalam kristal mikroskopis. Hal ini sangat berguna untuk aplikasi yang membutuhkan kekuatan tinggi dan rendah delapan.
-
Bahan bakar fosil seperti gas metana dan minyak mentah (bensin) memainkan peran besar dalam ekonomi modern.
-
Plastik terbuat dari polimer karbon. Karbon digunakan untuk membentuk paduan dengan besi seperti baja karbon.
-
kombinasi grafit dan tanah liat digunakan sebagai isi pensil.
-
Arang umumnya digunakan untuk memanggang makanan di barbeque.
sifat fisika, kimia dan cara pembuatan alkana
Posted by pada 24 Juni 2011
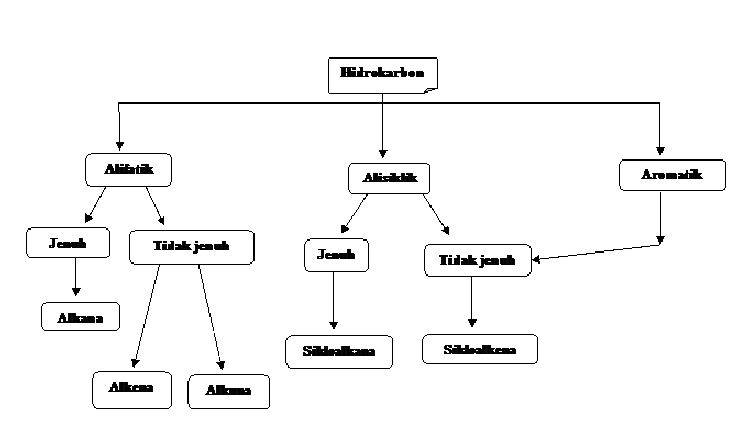
Penggolongan hidrokarbon
Sifat Fisika
Alkana yang
memiliki massa molekul rendah yaitu metana, etana, propana dan butana
pada suhu kamar dan tekanan atmosfer berwujud gas, alkana yang memiliki
5-17 atom karbon berupa cairan tidak berwarna dan selebihnya berwujud
padat.
Alkana
merupakan senyawa nonpolar sehingga sukar larut dalam air tetapi
cenderung larut pada pelarut-pelarut yang nonpolar seperti eter, CCl4.
Jika alkana ditambahkan ke dalam air alkana akan berada pada lapisan
atas, hal ini disebabkan adanya perbedaan massa jenis antara air dan
alkana. Sebagian besar alkana memiliki massa jenis lebih kecil dari
massa jenis air.
Karena alkana
merupakan senyawa nonpolar, alkana yang berwujud cair pada suhu kamar
merupakan pelarut yang baik untuk senyawa-senyawa kovalen. Beberapa
sifat fisika alkana dapat dilihat pada Tabel.
| Nama | Titik leleh (ºC) | Titik didih (ºC) | Massa jenis (g/cm3) |
| Metana Etana Propana Butana Pentana Heksana Heptana Oktana Nonana Dekana |
-182 -183 -188 -138 -130 -95 -91 -57 -51 -30 |
-162 -89 -42 0 36 69 98 126 151 174 |
0,423 0,545 0,501 0,573 0,526 0,655 0,684 0.703 0.718 0.730 |
Sifat Kimia Alkana
Reaksi-Reaksi Alkana
Seperti yang
diektahui bahwa ikatan pada alkana berciri tunggal, kovalen dan
nonpolar. Oleh karenanya alkana relatif stabil (tidak reaktif) terhadap
kebanyakan asam, basa, pengoksidasi atau pereduksi yang dapat dengan
mudah bereaksi dengan kelompok hidrokarbon lainnya. Karena sifatnya yang
tidak reaktif tersebut, maka alkana dapat digunakan sebagai pelarut.
Walaupun alkana
tergolong sebagai senyawaan yang stabil, namun pada kondisi dan
pereaksi tertentu alkana dapat bereaksi dengan asam sulfat dan asam
nitrat, sekalipun dalam temperatur kamar. Hal tersebut dimungkinkan
karena senyawa kerosin dan gasoline mengandung banyak rantai cabang dan
memiliki atom karbon tersier yang menjadi activator berlangsungnya
reaksi tersebut. Berikut ini ditunjukkan beberapa reaksi alkana :
1. Oksidasi
Alkana sukar dioksidasi oleh oksidator lemah atau agak kuat seperti KMNO4,
tetapi mudah dioksidasi oleh oksigen dari udara bila dibakar. Oksidasi
yang cepat dengan oksingen yang akan mengeluarkan panas dan cahaya
disebut pembakaran atau combustion
Hasil oksidasi
sempurna dari alkana adalah gas karbon dioksida dan sejumlah air.
Sebelum terbentuknya produk akhir oksidasi berupa CO2 dan H2 O, terlebih dahulu terbentuk alkohol, aldehid dan karboksilat.
Alkana terbakar dalam keadaan oksigen berlebihan dan reaksi ini menghasilkan sejumlah kalor (eksoterm)
CH4 + 2O2 → CO2 + 2H2 + 212,8 kkal/mol
C4H10 + 2O2 → CO2 + H2O + 688,0 kkal/mol
Reaksi
pembakaran ini merupakan dasar penggunaan hidrokarbon sebagai penghasil
kalor (gas alam dan minyak pemanas) dan tenaga (bensin), jika oksigen
tidak mencukupi untuk berlangsungnya reaksi yang sempurna, maka
pembakaran tidak sempurna terjadi. Dalam hal ini, karbon pada
hidrokarbon teroksidasi hanya sampai pada tingkat karbon monoksida atau
bahkan hanya sampai karbon saja.
2CH4 + 3O2 → 2CO + 4H2O
CH4 + O2 → C + 2H2O
Penumpukan
karbon monoksida pada knalpot dan karbon pada piston mesin kendaraan
bermotor adalah contoh dampak dari pembakaran yang tidak sempurna.
Reaksi pembakaran tak sempurna kadang-kadang dilakukan, misalnya dalam
pembuatan carbon black, misalnya jelaga untuk pewarna pada tinta.
2. Halogenasi
Reaksi dari alkana dengan unsur-unsur halogen disebut reaksi halogenasi.
Reaksi ini akan menghasilkan senyawa alkil halida, dimana atom hidrogen
dari alkana akan disubstitusi oleh halogen sehingga reaksi ini bisa
disebut reaksi substitusi.
Halogenasi biasanya menggunakan klor dan brom sehingga disebut juga klorinasi dan brominasi.
Halongen lain, fluor bereaksi secara eksplosif dengan senyawa organik
sedangkan iodium tak cukup reaktif untuk dapat bereaksi dengan alkana.
Laju pergantian atom H sebagai berikut H3 > H2 > H1. Kereaktifan halogen dalam mensubtitusi H yakni fluorin > klorin > brom > iodin.
Reaksi antara alkana dengan fluorin menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap.
Jika campuran
alkana dan gas klor disimpan pada suhu rendah dalam keadaan gelap,
reaksi tidak berlangsung. Jika campuran tersebut dalam kondisi suhu
tinggi atau di bawah sinar UV, maka akan terjadi reaksi yang eksoterm.
Reaksi kimia dengan bantuan cahaya disebut reaksi fitokimia.
Dalam reaksi
klorinasi, satu atau lebih bahkan semua atom hidrogen diganti oleh atom
halogen. Contoh reaksi halogen dan klorinasi secara umum digambarkan
sebagai berikut:
Untuk
menjelaskan keadaan ini, kita harus membicarakan mekanisme reaksinya.
Gambaran yang rinci bagaimana ikatan dipecah dan dibuat menjadi reaktan
dan berubah menjadi hasil reaksi.
Langkah pertama dalam halogenasi adalah terbelahnya molekul halogen menjadi dua partikel netral yang dinamakan radikal bebas atau radikal. Suatu
radikal adalah sebuah atom atau kumpulan atom yang mengandung satu atau
lebih elektron yang tidak mempunyai pasangan. Radikal klor adalah atom
yang klor yang netral, berarti atom klor yang tidak mempunyai muatan
positif atau negatif.
Pembelahan dari molekul Cl2 atau Br2 menjadi radikal memerlukan energi sebesar 58 Kcal/mol untuk Cl2 dan 46 kcal/mol untuk Br2.
Energi yang didapat dari cahaya atau panas ini, diserap oleh halongen
dan akan merupakan reaksi permulaan yang disebut langkah permulaan.
Tahap kedua
langkah penggadaan dimana radikal klor bertumbukan dengan molekul
metan, radikal ini akan memindahkan atom atom hidrongen (H ) kemudian
menghasilkan H-Cl dan sebuah radikal baru, radikal metil ( CH3).
Langkah I dari siklus penggadaan
Radikal bebas metil sebaliknya dapat bertumbukan dengan molekul (Cl2) untuk membedakan atom khlor dalam langkah penggandaan lainnya.
Langkah 2 dari siklus penggadaan
Langka ketiga Reaksi
Penggabungan Akhir. Reaksi rantai radikal bebas berjalan terus sampai
semua reaktan terpakai atau sampai radikalnya dimusnahkan. Reaksi dimana
radikal dimusnahkan disebut langkah akhir. Langkah akhir akan
memutuskan rantai dengan jalan mengambil sebuah radikal setelah rantai
putus. Siklus penggandaan akan berhenti dan tak berbentuk lagi reaksi.
Suatu cara
untuk memusnahkan radikal adalah dengan menggabungkan dua buah radikal
untuk membentuk non radikal yang stabil dengan reaksi yang disebut reaksi penggabungan (coupling reaction). Reaksi penggabungan dapat terjadi bila dua buah radikal bertumbukan
Radikal lainnya juga dapat bergabung untuk mengakhiri rangkaian reaksi tersebut. Misalnya CH3 dapat bergabung dengan Cl menghasilkan CH3Cl
Suatu masalah
dengan radikal bebas adalah terbentuknya hasil campuran. Contohnya
ketika reaksi khlorinasi metana berlangsung, konsentrasi dari metana
akan berkurang sedangkan klorometan bertambah. Sehingga ada kemungkinan
besar bahwa radikal klor akan bertumbukkan dengan molekul klormetan,
bukannya dengan molekul metan.
Jika halogen
berlebihan, reaksi berlanjut dan memberikan hasil-hasil yang mengandung
banyak halogen berupa diklorometana, trikloroetana dan tetraklorometana
Keadaan reaksi dan perbandingan antara klor dan metana dapat diatur untuk mendapatkan hasil yang diinginkan.
Pada alkana
rantai panjang, hasil reaksinya menjadi semakin rumit karena campuran
dari hasil reaksi berupa isomer-isomer semakin banyak. Misalnya pada
klorinasi propana
Bila alkana
lebih tinggi dihalogenasi, campuran hasil reaksi menjadi rumit,
pemurnian atau pemisahan dari isomer-isomer sulit dilakukan. Dengan
demikian halogenasi tidak bermanfaat lagi dalam sintesis alkil halida.
Akan tetapi pada sikloalkana tak bersubtitusi dimana semua atom
hidrogennya setara, hasil murni dapat diperoleh. Karena sifatnya yang
berulang terus reaksi semacam ini disebut reaksi rantai radikal bebas.
3. Sulfonasi Alkana
Sulfonasi
merupakan reaksi antara suatu senyawa dengan asam sulfat. Reaksi antara
alkana dengan asam sulfat berasap (oleum) menghasilkan asam alkana
sulfonat. dalam reaksi terjadi pergantian satu atom H oleh gugus –SO3H. Laju reaksi sulfonasi H3 > H2 > H1.
Contoh
4. Nitrasi
Reaksi nitrasi
analog dengan sulfonasi, berjalan dengan mudah jika terdapat karbon
tertier, jika alkananya rantai lurus reaksinya sangat lambat.
5. Pirolisis (Cracking)
Proses pirolisis atau cracking adalah proses pemecahan alkana dengan jalan pemanasan pada temperatur tinggi, sekitar 10000 C tanpa oksigen, akan dihasilkan alkana dengan rantai karbon lebih pendek
Proses
pirolisis dari metana secara industri dipergunakan dalam pembuatan
karbon-black. Proses pirolisa juga dipergunakan untuk memperbaiki
struktur bahan bakar minyak, yaitu, berfungsi untuk menaikkan bilangan
oktannya dan mendapatkan senyawa alkena yang dipergunakan sebagai
pembuatan plastik. Cracking biasanya dilakukan pada tekanan tinggi
dengan penambahan suatu katalis (tanah liat aluminium silikat).
Cara Pembuatan Alkana
Cara Khusus pembuatan metana
a. Metana dapat diperoleh dari pemanasan unsur-unsurnya pada temperatur 1200°C.
b. Metana dapat diperoleh secara tidak langsung, yaitu dari senyawa CS2, H2 S dan logam Cu, ini dikenal sebagai metoda Berthelot.
c. Metana dapat diperoleh dari monoksida dan hidrogen akan menghasilkan metana
d. Reduksi katalis dihasilkan dari pemanasan sodium asetat dengan basa kuat (KOH/NaOH) tanpa adanya air.
e. Metana dapat
dihasilkan dari pemanasan sodium asetat dengan basa kuat (KOH/NaOH)
tanpa adanya air. Pada reaksi ini biasanya ditambahkan soda lime
(campuran NaOH) dan CaO) untuk mencegah tejadinya keausan tabung
gelasnya.
Cara Umum
a) Alkana dapat diperoleh dari reduksi alkil halida dan logam, misalnya logam Zn (campuran Zn + Cu) atau logam Na dan alcohol.
b) Alkana dapat diperoleh dari alkil halida melalui terbentuknya senyawa grignard kemudian dihidrolisis.
c) Alkana dapat diperoleh dari alkil halida oleh logan Na (reaksi Wurtz), dimana alkana yang dihasilkan mempunyai atom karbon dua kali banyak dari atom karbon alkil halida yang digunakan.
File Artikel ini silakan download di sini…!!!!!Lihat Juga :
1. tatanama alkana, alkena dan alkuna
2. mengapa alkana bercabang memiliki titik didih lebih rendah
3. PEREAKSI PEMBATAS DAN CARA MENENTUKANNYA
4. Penyetaraan Reaksi Redoks
alotrop karbon: intan, grafit dan fullerene
Posted by pada 28 Februari 2011
Senyawa yang terbentuk hanya dari satu jenis unsur namun dengan struktur (bentuk) yang berbeda alotrop. Perbedaan struktur yang terjadi menyebabkan sifat yang dimiliki setia alotrop berbeda walaupun tersusun dari unsur yang sejenis.
Senyawaan yang terbentuk dari atom unsur karbon dengan struktur yang berbeda disebut alotrop karbon. Grafit, intan, fullerene dan karbon amorf merupakan contoh dari alotrop karbon yang sejauh ini diketahui.
Dalam tabel peridoik unsur karbon memiliki simbol C dengan nomor atom 6 dan terletak pada golongan 4A atau 14, periode 2 dan termasuk blok p. Konfigurasi elektron atom karbon adalah 1s2 2s2 2p2 atau [He] 2s2 2p2 dengan susunan elektron dalam kulit atomnya adalah 2, 4. Berdasarkan konfigurasi elektronnya diketahui bahwa karbon memiliki 4 elektron valensi. Empat elektron valensi karbon ini dapat digunakan untuk membentuk ikatan kovalen dengan atom lain maupun dengan atom karbon yang lain.
Intan
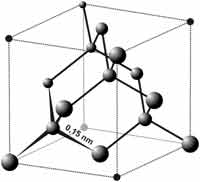
Intan atau berlian atau diamond merupakan alotrop karbon yang memiliki nilai ekonomi yang tinggi dan hingga saat ini intan dikenal sebagai mineral alami yang paling keras dimana belum ada mineral lain yang berhasil menggores atau memotong intan.
Sifat dan pemakaian Intan
Berikut beberapa sifat dan pemakaian intan:
- Intan merupakan mineral alami yang paling keras, sehingga intan banyak digunakan sebagai alat untuk memotong, mengasah dan sebagai mata bor.
- Memiliki titik leleh yang sangat tinggi yakni 4827 °C). Hal ini disebabkan Ikatan kovalen karbon-karbon yang terbentuk pada struktur intan sangat kuat bahkan lebih kuat dari ikatan ionik.
- Berupa isolator namun dapat menyerap panas dengan sangat baik. Daya hantar listrik intan berkaitan dengan elektron yang digunakan untuk membentuk ikatan, dimana pada intan elektron-elektron berikatan sangat kuat sehingga tidak ada elektron yang bebas bergerak ketika diberi beda potensial. Sifat penyerap panas yang baik dari intan diaplikasikan pada peralatan elektonik untuk menyerap panas yang dihasilkan ketika peralatan elektronik digunakan. Dengan melapisi intan pada konduktor dalam peralatan elektronik maka suhu peralatan tersebut dapat dijaga relatif konstan sehingga peralatan tersebut dapat berfungsi secara normal.
- Tidak larut dalam air dan pelarut organik. Dalam hal ini tidak memungkinkan terjadinya daya tarik antara molekul pelarut dan atom karbon yang dapat membongkar dayatarik antara atom-atom karbon yang berikatan secara kovalen. Akibat pelarut tidak mampu mensolvasi molekul intan.
Dalam struktur intan setiap atom karbon berikatan secara kovalen dengan atom 4 karbon lain dalam bentuk tetrahedral dan panjang setiap ikatan karbon-karbon adalah 0,154 nm.
Intan kini dapat produksi secara komersial dalam skala laboratorium maupun skala industri. Bahan dasar pembuatan intan yaitu grafit dengan katalis logam. Proses pembuatan intan dari grafit dilakukan pada suhu tinggi yakni sekitar 3500 °C bahkan dapat lebih tinggi dan tekanan tinggi pula yakni sekitar 140.000 atm atau lebih. Selain menggunakan cara tersebut, intan dapat dihasilkan dengan pirolisis hidrokarbon pada suhu relatif rendah (± 900 °C) dan tekanan realtif lebih rendah pula yakni sekitar 102 Pa.
Namun dalam kehidupan sehari-hari intan yang sering dijumpai terdiri dari berbagai macam warna. Berbagai warna yang dihasilkan intan dipengaruhi oleh 3 hal yaitu
- Adanya pengotor dalam struktur intan sehingga pengotor tersebut dapat mengubah spektrum absorbsi intan. Spektrum intan yang berubah akibat adanya pengotor tergantung pada jenis dan konsentrasi pengotor yang ada Misalnya intan kuning dan oranye mengandung nitrogen, intan biru mengandung boron, intan abu-abu, ungu dan hijau mengandung hidrogen.
- Intan hijau disebabkan oleh radiasi alam, yang terjadi selama berjuta-juta tahun sehingga dapat mengubah struktur atom dalam intan. Akibat berubahnya struktur intan menyebabkan sektrum absorpsi intanpun berubah.
- Intan merah muda, merah dan coklat disebabkan oleh adanya deformasi plastik. Struktur atom karbon yang memutar selama pembentukan intan dalam tanah sehingga mengubah sektrum absorpsi intan. Hal ini tampak pada intan sebagai garis urat yang menyerupai urat kayu. Garis inilah yang memberikan spektrum warna yang berbeda.
Grafit
Grafit merupakan alotrop karbon yang dapat menghantarkan arus listrik dan panas dengan baik. Karena sifat inilah grafit biasanya digunakan sebagai elektroda pada sel elektrolisis.
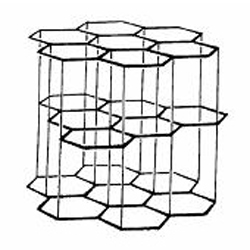
Dalam struktur grafit setiap atom karbon membentuk ikatan kovalen dengan tiga atom karbon lainnya membentuk susunan heksagonal dengan struktur berlapis seperti tumpukan kartu. Karena atom karbon memiliki 4 elektron valensi maka pada setiap atom karbon masih terdapat satu elektron yang belum berikatan (elektron bebas).
Sifat daya hantar listrik yang dimiliki oleh grafit dipengaruhi oleh elektron-elektron yang tidak digunakan untuk membentuk ikatan kovalen. Elektron-elektron ini tersebar secara merata pada setiap atom C karena terjadi tumpang tindih orbital seperti pada ikatan logam yang membentuk awan atau lautan elektron. Oleh sebab itu ketika diberi beda potensial, elektron-elektron yang terdelokaslisasi sebagian besar akan mengalir menuju anoda (kutub positif), aliran elektron inilah yang menyebabkan arus listrik dapat mengalir. Sedangkan ketika salah satu ujung dipanaskan maka elektron-elektron ini akan segera berpindah menuju bagian yang memiliki suhu lebih rendah. Akibatnya panas tersebut akan menyebar ke bagian grafit yang memiliki suhu lebih rendah. Struktur grafit seperti yang tertera pada Gambar.
Ikatan kovalen antar lapisan pada grafit relatif lebih lemah bila dibanding ikatan kovalen antar antar atom dalam satu lapisan. Dengan adanya hal ini menyebabkan grafit bersifat licin, karena lapisan yang berada dibagian atas mudah tergelincir atau mudah tergeser.
Sifat dan Kegunaan Grafit
- Memiliki titik leleh tinggi, sama seperti intan. Hal ini disebabkan iktan kovalen yang terbentuk sangat kuat sehingga diperlukan energi yang tinggi untuk memutuskannya.
- Memiliki sifat lunak, terasa licin dan digunakan pada pensil setelah dicampu tanah liat.
- Tidak larut dalam air dan pelarut organik, karena tidak mampu mensolvasi molekul grafit yang sangat besar.
- Dibanding intan, grafit memiliki massa jenis yang lebih kecil, karena pada strukturnya terdapat ruang-ruang kosong antar lipatannya.
- Berupa konduktor listrik dan panas yang baik. Karena sifat ini grafit digunakan sebagai anoda pada baterai (sel Leclanche) dan sebagai elektroda pada sel elektrolisis.
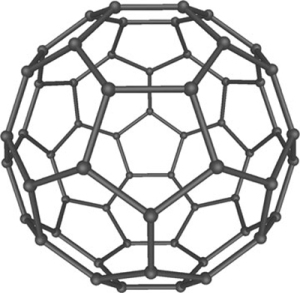
Fulleren
Fuleren adalah alotrop karbon dimana 1 molekul karbon terdiri dari 60 atom karbon sehingga sering disebut sebagai C60. Pada struktur fulleren setiap atom karbon berikatan dengan tiga atom karbon lain dengan pola membentuk susunan pentagonal membentuk struktur berongga seperti bola sepak. Struktur fulleren seperti yang tertera pada Gambar.
Gambar Struktur fuleren
Sifat dan pemakaian
- Tidak larut dalam air, tetapi dapat larut dalam pelarut organik.
- Sebagai superkonduktor dan penyerap panas yang baik. Sifat superkonduktor dan menyerap panas ini berkaitan 1 elektron yang tidak digunakan untuk membentuk ikatan kovalen, seperti pada grafit. Salah satu senyawaan C60 yang merupakan semikonduktor adalah K3C60.
tatanama alkana, alkena dan alkuna
Posted by pada 23 Oktober 2010
Tata Nama Alkana
Tatanama semua senyawa organik terbagi menjadi tata nama sistematik dan tata nama umum. Tata nama sistematik diatur oleh badan internasional IUPAC (International Union of Pure and Applied Chemistry). Sedangkan nama umum pemakaiannya sangat terbatas, karena hanya digunakan untuk senyawa-senyawa dengan rumus molekul sederhana atau senyawa-senyawa tertentu saja.
Nama yang diberikan pada suatu senyawa organik harus memberikan gambaran yang jelas mengenai rumus strukturnya demikian pula sebaliknya dari struktur yang ada nama suatu senyawa organik dapat ditentukan. Nama-nama beberapa alkana tidak bercabang yang sering disebut sebagai deret homolog dapat dilihat pada gambar.

Aturan-aturan pemberian nama sistematik alkana bercabang menurut IUPAC
1) Alkana tak bercabang pemberian nama sistematik sesuai gambar di atas sedangkan untuk nama umum ditambah n (normal) untuk alkana yang tidak bercabang.
3) Rantai terpanjang nomori dari ujung yang paling dekat dengan substituen sehingga rantai cabang memberikan nomor yang sekecil mungkin. Pada pemberian nama, hanya nomor atom karbon rantai utama yang mengikat substituen dituliskan kemudian diikuti nama susbstituen. (gambar 2)

4) Jika terdapat lebih dari satu subtituen yang sama, maka nomor masing-masing atom karbon rantai utama yang mengikat substituen semuanya harus dituliskan. Jumlah substituen ditunjukan dengan awalan di, tri, tetra, penta, heksa dan seterusnya, yang berturut-turut menyatakan jumlah substituen sebanyak dua, tiga, empat, lima dan seterusnya. Penomoran tetap dimulai dari ujung yang paling dekat dengan substituen. (gambar 3)

5) Jika terdapat dua atau lebih sustituen yang berbeda, maka dalam penulisan nama disusun berdasarkan urutan abjad huruf pertama dari nama substituen. Penomoran rantai utama dimulai dari ujung rantai yang nama substituen berdasarkan urutan abjad lebih awal. awalan di, tri, tetra, penta, heksa dan seterusnya tidak perlu diperhatikan dalam penentuan urutan abjad.
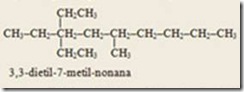
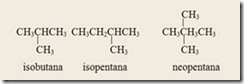
6) Awalan-awalan sek-, ters- yang diikuti tanda hubung tidak perlu diperhatikan dalam penentuan urutan abjad. Sedangkan awalan iso dan neo tidak perlu dipisahkan dengan tanda hubung dan diperhatikan dalam penentuan urutan abjad. Awalam iso menunjukan adanya gugus –CH(CH3)2 dan awalan neo- menunjukan adanya gugus –C(CH3)3.
Tata Nama Alkena
Pemberian nama untuk senyawa-senyawa alkena berdasarkan sistem IUPAC mirip pemberian nama pada alkana. Rantai utama alkena merupakan rantai dengan jumlah atom C terpanjang yang melewati gugus ikatan rangkap dan atom C yang mengandung ikatan rangkap ditunjukan dengan nomor.
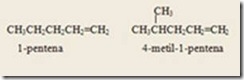
Ikatan rangkap yang dinomori diusahakan memperoleh nomor serendah mungkin. Pemberian nama pada alkena yaitu mengganti akhiran –ana pada alkana dengan akhiran –ena dengan jumlah atom C sama dengan alkana. Pemberian nama untuk alkena bercabang seperti pemberian nama pada alkana.
Alkena-alkena suku rendah nama umum lebih sering digunakan dibanding nama sistematik. Misalnya

Tatanama Alkuna
Sistem IUPAC
1) Pemberian nama pada alkuna menyerupai tata nama elkana yakni mengganti akhiran –ana pada alkana terkait dengan akhiran –una.
2) Rantai atom karbon terpanjang adalah rantai atom karbon yang mengandung ikatan ganda tiga
3) Penomoran dimulai dari salah satu ujung rantai yang memungkinkan ikatan ganda tiga mempunyai nomor serendah mungkin.
4) Pada penulisan nama, atom C yang mengandung atom ikatan ganda tiga ditunjukan dengan nomor.
Contoh

Nama Umum
Nama umum digunakan untuk alkuna-alkuna sederhana. Dalam pemberian nama umum alkuna dianggap sebagai turunan asetilena (C2H2) yang satu atom hidrogennya diganti oleh gugus akil.
Contoh:

Tatanama semua senyawa organik terbagi menjadi tata nama sistematik dan tata nama umum. Tata nama sistematik diatur oleh badan internasional IUPAC (International Union of Pure and Applied Chemistry). Sedangkan nama umum pemakaiannya sangat terbatas, karena hanya digunakan untuk senyawa-senyawa dengan rumus molekul sederhana atau senyawa-senyawa tertentu saja.
Nama yang diberikan pada suatu senyawa organik harus memberikan gambaran yang jelas mengenai rumus strukturnya demikian pula sebaliknya dari struktur yang ada nama suatu senyawa organik dapat ditentukan. Nama-nama beberapa alkana tidak bercabang yang sering disebut sebagai deret homolog dapat dilihat pada gambar.

Aturan-aturan pemberian nama sistematik alkana bercabang menurut IUPAC
1) Alkana tak bercabang pemberian nama sistematik sesuai gambar di atas sedangkan untuk nama umum ditambah n (normal) untuk alkana yang tidak bercabang.
CH3–CH2–CH2–CH3
n-butana
2) Untuk alkana yang rantainya bercabang, rantai utamanya adalah
rantai dengan jumlah atom C terpanjang. Gugus yang terikat pada rantai
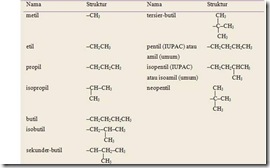
utama disebut substituen. Susstituen yang diturunkan dari suatu alkana dengan mengurangi satu atom H disebut gugus alkil. Gugus alkil memiliki rumus umum -CnH2n+1 dan dilambangkan dengan –R. Pemberian nama gugus alkil sesuai dengan nama alkana, tetapi mengganti akhiran -ana pada alkana asalnya dengan akhiran –il. Nama dan rumus beberapa gugus alkil dapat dilihat pada ( gambar 1) 
3) Rantai terpanjang nomori dari ujung yang paling dekat dengan substituen sehingga rantai cabang memberikan nomor yang sekecil mungkin. Pada pemberian nama, hanya nomor atom karbon rantai utama yang mengikat substituen dituliskan kemudian diikuti nama susbstituen. (gambar 2)

4) Jika terdapat lebih dari satu subtituen yang sama, maka nomor masing-masing atom karbon rantai utama yang mengikat substituen semuanya harus dituliskan. Jumlah substituen ditunjukan dengan awalan di, tri, tetra, penta, heksa dan seterusnya, yang berturut-turut menyatakan jumlah substituen sebanyak dua, tiga, empat, lima dan seterusnya. Penomoran tetap dimulai dari ujung yang paling dekat dengan substituen. (gambar 3)

5) Jika terdapat dua atau lebih sustituen yang berbeda, maka dalam penulisan nama disusun berdasarkan urutan abjad huruf pertama dari nama substituen. Penomoran rantai utama dimulai dari ujung rantai yang nama substituen berdasarkan urutan abjad lebih awal. awalan di, tri, tetra, penta, heksa dan seterusnya tidak perlu diperhatikan dalam penentuan urutan abjad.

6) Awalan-awalan sek-, ters- yang diikuti tanda hubung tidak perlu diperhatikan dalam penentuan urutan abjad. Sedangkan awalan iso dan neo tidak perlu dipisahkan dengan tanda hubung dan diperhatikan dalam penentuan urutan abjad. Awalam iso menunjukan adanya gugus –CH(CH3)2 dan awalan neo- menunjukan adanya gugus –C(CH3)3.

Tata Nama Alkena
Pemberian nama untuk senyawa-senyawa alkena berdasarkan sistem IUPAC mirip pemberian nama pada alkana. Rantai utama alkena merupakan rantai dengan jumlah atom C terpanjang yang melewati gugus ikatan rangkap dan atom C yang mengandung ikatan rangkap ditunjukan dengan nomor.
Ikatan rangkap yang dinomori diusahakan memperoleh nomor serendah mungkin. Pemberian nama pada alkena yaitu mengganti akhiran –ana pada alkana dengan akhiran –ena dengan jumlah atom C sama dengan alkana. Pemberian nama untuk alkena bercabang seperti pemberian nama pada alkana.

Alkena-alkena suku rendah nama umum lebih sering digunakan dibanding nama sistematik. Misalnya

Tatanama Alkuna
Sistem IUPAC
1) Pemberian nama pada alkuna menyerupai tata nama elkana yakni mengganti akhiran –ana pada alkana terkait dengan akhiran –una.
2) Rantai atom karbon terpanjang adalah rantai atom karbon yang mengandung ikatan ganda tiga
3) Penomoran dimulai dari salah satu ujung rantai yang memungkinkan ikatan ganda tiga mempunyai nomor serendah mungkin.
4) Pada penulisan nama, atom C yang mengandung atom ikatan ganda tiga ditunjukan dengan nomor.
Contoh

Nama Umum
Nama umum digunakan untuk alkuna-alkuna sederhana. Dalam pemberian nama umum alkuna dianggap sebagai turunan asetilena (C2H2) yang satu atom hidrogennya diganti oleh gugus akil.
Contoh:

Minyak Kacang Tanah dan Tepung Kacang Tanah
Posted by pada 1 Oktober 2010
Minyak kacang tanah merupakan minyak nabati yang dipergunakan untuk minyak goreng, bahan dasar pembuatan margarin mayonnaise, salad dressing dan mentega putih (shortening), dan mempunyai keunggulan bila dibandingkan dengan minyak jenis lainnya, karena dapat dipakai berulang-ulang untuk menggoreng bahan pangan. Selain itu minyak kacang tanah banyak digunakan dalam industri sabun, face cream, shaving cream, pencuci rambut dan bahan kosmetik lainnya. Dalam bidang farmasi minyak kacang tanah dapat digunakan untuk campuran pembuatan adrenalin dan obat asma.
Dari jumlah 9,1 persen kadar nitrogen kacang tanah, sebesar 8,74 % diantaranya terdiri dari fraksi albumen, gluten dan globulin. Kandungan asam amino esensial pada kacanga tanah seperti yang tertera pada Tabel

Komposisi Daging Biji Kacang Tanah

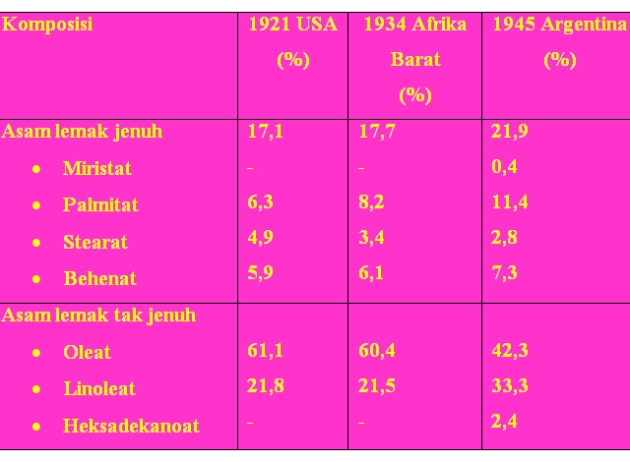
Minyak kacang tanah mengandung 76-82 % asam lemak tidak jenuh, yang terdiri dari 40 45 % asam oleat dan 30-35 % asam linoleat. Asam lemak jenuh sebagian besar terdiri dari asam palmitat, sedangkan kadar asam miristat sekitar 5 %. Kandungan asam linoleat yang tinggi akan menurunkan kestabilan minyak.
Kestabilan minyak akan bertambah dengan cara hidrogenasi atau dengan penambahan anti-oksidan. Dalam minyak kacang tanah terdapat persenyawaan tokoferol yang merupakan anti oksidan alami dan efektif dalam menghambat proses oksidasi minyak kacang tanah.
Komposisi Asam Lemak Minyak Kacang Tanah
Di dalam kacang tanah terdapat karbohidrat sebanyak 18% dengan kadar pati 0,5-5,0% dan kadar sukrosa 4–7%. Vitamin-vitamin yang terdapat adalah riboflavin, thiamin, asam nikotinat, vitamin E dan K. Sebagian besar kandungan mineral terdiri dari kalsium, magnesium, fosfor dan sulfur.
Racun di dalam kacang tanah yang disebut aflatoksin, dihasilkan oleh cendawan Aspergillus flavus. Aflatoksin ini terdiri dari B1, B2, G1, G2. Kode B dan G menunjukkan intensitas fluorecence biru (blue) dan hijau (green) jika disinari dengan sinar ultra violet. Kacang tanah berumur tua, yang digunakan sebagai bibit kadang-kadang mengandung aflatoksin.
Sifat Fisik dan Kimia
Minyak kacang tanah merupakan minyak yang lebih baik daripada minyak jagung, minyak biji kapas, minyak olive, minyak bunga matahari, untuk dijadikan salad dressing, dan disimpan di bawah suhu -11 °C. Hal ini disebabkan karena minyak kacang tanah jika berwujud padat berbentuk amorf, dimana lapisan padat tersebut tidak pecah sewaktu proses pembekuan. Minyak kacang tanah yang didinginkan pada suhu -6,6 °C, akan menghasilkan sejumlah besar trigliserida padat.
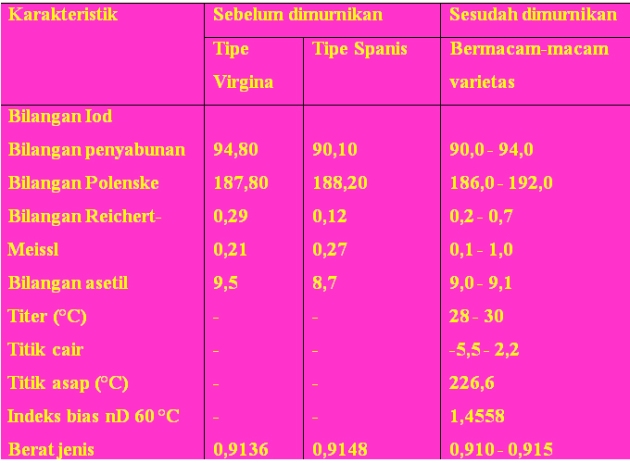
Berdasarkan flow test, maka fase padat terbentuk dengan sempurna pada suhu -6,6 °C. Sifat fisika-kimia minyak kacang tanah sebelum dan sesudah dimurnikan dapat dilihat pada Tabel.
Sifat Fisika-Kimia Minyak Kacang Tanah Sebelum dan Sesudah Dimurnikan
Pembuatan tepung kacang tanah dan minyak kacang tanah
Alat dan Bahan
- Biji kacang tanah
- Panci
- Alat pengering
- Alat pres
- Pengukus
- Pengiling
CARA PEMBUATAN
- Proses Pendahuluan
- Blanching. Kacang tanah dicelupkan ke dalam air mendidih selama 1-3 menit sambil diaduk-aduk. Setelah itu kacang ditiriskan.
- Pengeringan. Kacang yang telah di blanching dikeringkan pada suhu 130-150°C selama 3-4 jam sehingga kadar air kurang dari 6%. Setelah itu kacang didinginkan.
- Pembuangan kulit ari. Kacang yang telah dikeringkan digosok-gosok dengan tangan sehingga kulit arinya terlepas. Setelah itu, kacang ditampi sehingga kulit ari yang telah terlepas dapat dibuang dan diperoleh biji kacang tanpa kulit ari.
- Pengepresan: Kacang yang telah dibuang kulit arinya dibungkus dengan kain katun tebal yang kuat, kemudian dipres sehingga sebagian besar minyaknya keluar. Hasil pengepresan adalah bungkil dan minyak kacang tanah.
- Penggilingan Bungkil: Bungkil kacang tanah digiling dengan mesin penggiling sampai halus (60 mesh). Penghalusan bungkil dapat juga dilakukan dengan menggunakan blender atau ditumpuk dengan lesung. Hasil yang diperoleh disebut dengan tepung kacang tanah. Tepung kacang ini berkadar minyak rendah.
- Pemurnian Minyak Kacang Tanah
- Minyak kacang tanah didiamkan selama semalam, kemudian disaring dengan kain saring rapat (3 lapis). Setelah itu minyak dipanaskan pada suhu 1500C selama 15 menit. Selama pemanasan dilakukan pengadukan.
- Setelah pemanasan, minyak didiamkan lagi selama semalam. Endapan yang terbentuk dibuang, kemudian disaring lagi dengan kain saring rapat (3 lapis). Hasil yang diperoleh adalah minyak kacang tanah yang dapat disimpan lama.
- Pengemasan
- Tepung kacang tanah dikemas di dalam kantong plastik, atau kotak kaleng.
- Sedangkan minyak kacang disimpan di dalam botol kaca yang berwarna gelap dan ditutup rapat.
DAFTAR PUSTAKA
Pembuatan tepung kacang tanah dan minyak kacang tanah: Teknologi Tepat Guna Agroindustri Kecil Sumatera Barat, Hasbullah, Dewan Ilmu Pengetahuan, Teknologi dan Industri Sumatera Barat.
Editor : Tarwiyah, Kemal






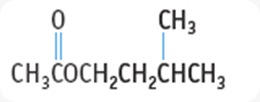
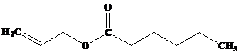
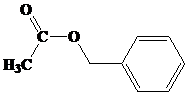
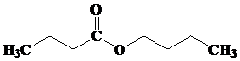
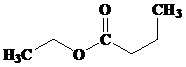
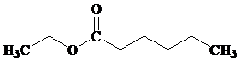
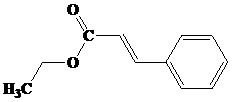

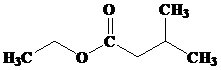


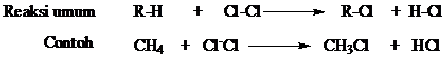
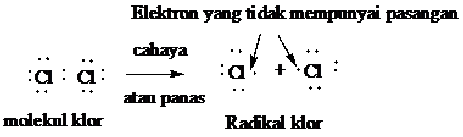
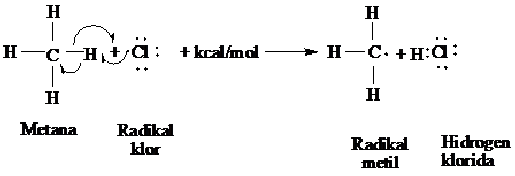
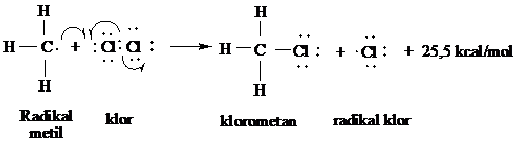
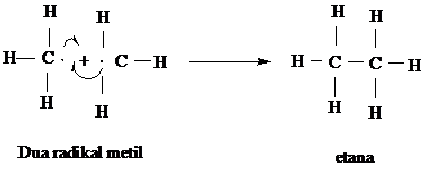
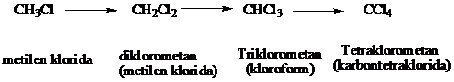
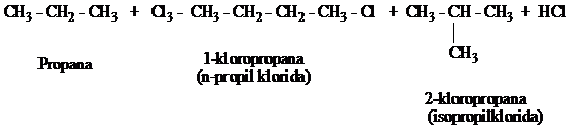
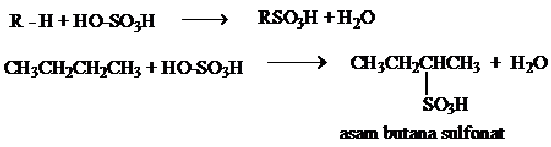
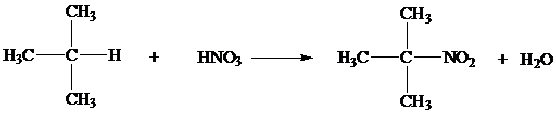
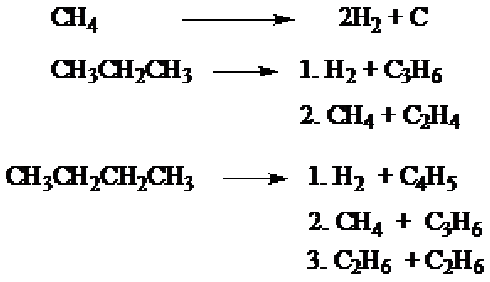
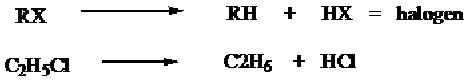

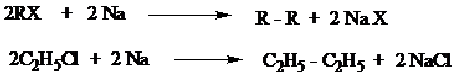















No comments:
Post a Comment