KELARUTAN DAN HASIL KALI KELARUTAN (Ksp)
Kelarutan ( solubility ) adalah suatu zat
dalam suatu pelarut dimana menyatakan jumlah maksimum suatu zat yang
dapat larut dalam suatu pelarut. Contoh bentuk kelarutan antara lain,
apabila kalian ingin membuat teh manis pertama – tama kalian menuangkan
gula kedalam gelas dan menuangkan air panas kedalam gelas yang telah
berisi gula tersebut ketika kalian aduk sebelum mencelupkan teh celupnya
maka kalian akan melihat adanya gula yang terlarut ( seperti adanya
awan di dalam air ), apa yang akan terjadi apabila kalian menambahkan
lagi gula kedalam air tersebut secara terus menerus apakah gula tersebut
akan larut ? sebelum menjawab pertanyaan tadi mari kita pelajari
kelarutan dibawah ini.
Besarnya kelarutan suatu zat dipengaruhi oleh beberapa faktor antara lain sebagai berikut :
1. Jenis Pelarut
Senyawa polar larut dalam pelarut yang polar dan begitu sebaliknya senyawa nonpolar akan larut dalam pelarut yang nonpolar.
2. Suhu
Kelarutan zat padat dalam air semakin tingi apabila suhunya dinaikkan.
Suatu kelarutan (khususnya untuk suatu
zat yang sukar larut) dinyatakan dalam mol/L. Jadi kelarutan sama dengan
kemolaran dari larutan jenuhnya.
Dalam hal ini terbagi atas 2 macam tipe larutan dalam suatu pelarut. Antara lain sebagai berikut:
A. Larutan Jenuh
Larutan jenuh adalah larutan yang telah mengandung zat terlarut dalam konsentrasi maksimum ( tidak dapat ditambah lagi )
Pada larutan jenuh akan terbentuk 2 hal antara lain
Konsentrasi maksimum zat terlarut = kelarutan (s)
Harga kesetimbangan = hasil kali kelarutan (Ksp)
Contoh : misalkan AgCl dilarutkan di dalam air akan terjadi reaksi ionisasi sebagai berikut
AgCl (s) <———— > Ag+(aq) + Cl-(aq)
Dari contoh tersebut maka akan didapatkan kesetimbangannya yaitu :
K = [Ag+] [Cl-] dimana pada larutan jenuh AgCl, konsentrasi ion Ag+ dan Cl-
akan setara dengan harga kelarutan AgCl didalam air, sehingga harga K
pada kesetimbangan kelarutan (garam atau basa yang sedikit larut)
disebut hasil kali kelarutan dan dilambangkan dengan Ksp.
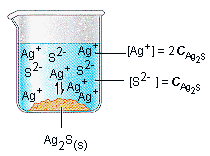
Pada elektrolit yang sukar larut di dalam air akan mengalami reaksi kesetimbangan
Contoh :
Ag2CO3 <———> 2 Ag+ (aq) + CO32- (aq)
Konsentrasi s ~ 2s ~ s
Ksp = [Ag+]2 [CO32-]
Ksp = [2s]2 [s]
Ksp = 4s3
Konsentrasi dalam larutan jenuh dinyatakan dalam symbol s
Contoh Soal :
1). Dalam 500 ml larutan dapat terlarut 0,65 gram Cu(IO3)2. Berapakah Ksp garam tersebut ? ( Ar O = 16 ; Cu = 63,5 ; I =127 )
2) Diketahui Ksp Ca(OH)2 = 5 X 10-6 tentukan pH larutan jenuh Ca(OH)2
Pengaruh ion senama / sejenis terhadap kelarutan
Sejauh ini kita telah membahas kelarutan elektrolit, akan tetapi seringkali terdapat sumber yang lain dari ion yang senama (sejenis) dalam larutan. Hal ini akan dibahas pengaruh ion sejenis.Contoh : Jika AgCl dilarutkan dalam larutan NaCl atau larutan AgNO3 ternyata kelarutan AgCl dalam larutan tersebut lebih kecil jika dibandingkan dengan kelarutan AgCl di dalam air murni. Hal ini disebabkan karena pengaruh adanya ion senama (sejenis) yang ada didalam larutan tersebut. Ion Cl- dari NaCL atau ion Ag+ dari AgNO3 akan mempengaruhi laju kesetimbangan, sehingga kesetimbangan akan bergeser ke arah kiri.
Sesuai dengan asas Le Chatlier penambahan ion Ag+ atau Cl- akan menggeser kesetimbangan ke kiri sehingga AgCl yang larut semakin sedikit
AgCl(s) <————— > Ag+(aq) + Cl-(aq)
Jadi dengan adanya ion sejenis akan memperkecil kelarutan suatu elektrolit. Makin banyak ion sejenis yang ada dalam larutan maka akan semakin kecil kelarutan elektrolit tersebut.
Cara menghitung kelarutan elektrolit jika ada ion sejenis sebagai berikut :
- Melalui persamaan Ksp, hitunglah konsentrasi ion yang tidak memiliki ion sejenis
- Berdasarkan koefisien reaksi ionisasi, hitunglah kelarutan elektrolit
|
Larutan
|
Kesetimbangan Larutan
|
Ksp
|
| Aluminium hidroksida | Al(OH) (s) < ———- > Al3+(aq) + 3OH–(aq) | 1,3 × 10–33 |
| Barium karbonat | BaCO3(s) < ———– > Ba2+(aq) + CO32–(aq) | 5,1 × 10–9 |
| Barium sulfat | BaSO4(s) < ———- > Ba2+(aq ) + SO42–(aq) | 1,1 × 10–10 |
| Kalsium karbonat | CaCO3(s) < ———– > Ca2+(aq) + CO32–(aq) | 2,8 × 10–9 |
| Kalsium flourid | CaF2(s) < ———— > Ca2+(aq) + 2F–(aq) | 5,3 × 10–9 |
| Kalsium sulfat | CaSO4(s) < ———– > Ca2+(aq) + SO42–(aq) | 9,1 × 10–6 |
| Kromium (III) hidroksida | Cr(OH)3(s) < ———- > Cr3+(aq) + 3OH–(aq) | 6,3 × 10–31 |
| Besi (III) hidroksida | Fe(OH)3(s) < ——— > Fe3+(aq) + 3OH–(aq) | 4 × 10–38 |
| Timbal (II) klorida | PbCl2(s) < ———– > Pb2+(aq) + 2Cl–(aq) | 1,6 × 10–5 |
| Magnesium karbonat | MgCO3(s) < ———- > Mg2+(aq) + CO3(aq) | 3,5 × 10–8 |
| Magnesium hidroksida | Mg(OH)2(s) < ——– > Mg2+(aq ) + 2 OH–(aq) | 1,8 × 10–11 |
Contoh soal 1 :
Diketahui harga Ksp AgCl sebesar 1,6 × 10–10. Tentukan kelarutan AgCl dalam larutan NaCl 0,04 M.
Solusi
Asumsikan bahwa NaCl terionisasi sempurna.
Ionisasi NaCl :
NaCl(aq) ————- > Na+(aq) + Cl–(aq)
0,04 M ~ 0,04 M ~ 0,04 M
Kesetimbangan AgCl :
AgCl(s) < —— > Ag+(aq) + Cl–(aq)
s ~ s ~ s
Dari reaksi di atas diperoleh [Ag+] = s
[Cl–] = (0,04 M + s), karena s << 0,04, maka [Cl–] = 0,04 M.
Kelarutan AgCl dalam NaCl 0,04 M dapat dihitung dengan cara berikut.
Ksp = [Ag+] [Cl–]
1,6 × 10–10 = (s) (0,04)
s = 4 × 10–11
Jadi, kelarutan AgCl dalam NaCl 0,04 M sebesar 4 × 10–11 M.
Contoh Soal 2:
Diketahui suatu larutan 100 ml CaF2 mempunyai Ksp 4 x 10-11 tentukan kelarutan CaF2 didalam larutan 0,01 M CaCl2 100 ml ?
Solusi
Dari sini kita bisa mengasumsikan bahwasanya terdapat ion senama sehingga CaCl2 terionisasi sempurna.
Ionisasi CaCl2 :
CaCl2 (aq) ———- >Ca2+ (aq) + 2 Cl- (aq)
0,01 M ~ 0,01 M ~ 0,02 M
Kesetimbangan CaF2 :
CaF2 (s) < ——- > Ca2+(aq) + 2 F- (aq)
s ~ s ~ 2s
Maka Berlaku :
[Ca2+] [ 2 Cl-] = Ksp CaCl2
[0,01] [2s]2 = 4 x 10-11
4s2 = 4 x 10-11 / 0,01
= 4 x 10-9
s2 = 10-9
s = √(10 x 10-9 )
s = 10-5
Jadi kelarutan CaF2 pada 0,01 M CaCl2 adalah 10-5 M










No comments:
Post a Comment