Hukum Dasar dan Perhitungan Kimia, Mol, Rumus, Contoh Soal, Pembahasan, Praktikum, Massa, Volume Molar Gas, Tetapan Avogadro
Hukum Dasar dan Perhitungan Kimia, Mol, Rumus, Contoh Soal, Pembahasan, Praktikum, Massa, Volume Molar Gas, Tetapan Avogadro
- Berdasarkan hasil penelitian secara ilmiah, telah ditemukan
Hukum-Hukum Dasar Kimia, seperti Hukum Kekekalan Massa,
Hukum Perbandingan Tetap, Hukum Perbandingan Volume, dan Hukum Avogadro.
Hukum-hukum tersebut menjadi pijakan bagi perkembangan ilmu
Kimia. Berdasarkan hukum-hukum tersebut, massa, volume, dan
jumlah partikel zat yang terlibat dalam reaksi kimia dapat diukur dan
ditentukan. Dengan demikian, kita dapat memprediksi banyaknya zat yang
akan dihasilkan atau diperlukan dalam suatu reaksi.
Bagaimanakah membuktikan hukum-hukum dasar kimia? Bagaimanakah
hubungannya dengan konsep mol dalam perhitungan kimia? Anda akan
mengetahui jawabannya jika Anda pelajari bab ini secara saksama.
A. Hukum-Hukum Dasar Kimia
Sejak metode ilmiah diterapkan dalam ilmu Kimia, muncullah berbagai
hukum yang menjadi dasar perkembangan ilmu Kimia. Beberapa hukum dasar
tersebut di antaranya Hukum Kekekalan Massa, Hukum Perbandingan Tetap,
Hukum Perbandingan Berganda, dan Hukum Perbandingan Volume, dan Hukum
Avogadro.
1.1. Hukum Kekekalan Massa
Apakah Hukum Kekekalan Massa itu? Jika disimak dari namanya, tentu
berkaitan dengan massa zat. Dalam ilmu Kimia, boleh jadi berhubungan
dengan massa zat-zat yang bereaksi dalam reaksi kimia. Beberapa abad
yang lalu, Lavoisier mengajukan satu masalah. Apakah massa zat-zat yang
bereaksi akan berkurang, bertambah, atau tetap setelah terjadi reaksi?
Untuk memperoleh jawaban dari masalah tersebut, Anda dapat melakukan
percobaan sederhana, misalnya melakukan reaksi antara cuka (CH3COOH) dan soda api (NaOH). Sebelum dan sesudah bereaksi zat ditimbang secara saksama (sampai dua angka di belakang koma).
Contoh :
a. 2g NaOH(s) + 10g CH3COOH(aq) →12g produk
b. 4g NaOH(s) + 10g CH3COOH(aq) →14g produk
c.
8g NaOH(s) + 10g CH3COOH(aq) →18g produk
Menurut pandangan Anda, bagaimanakah massa zat-zat sebelum dan sesudah
reaksi? Jika disimak dari nama hukumnya, dapat diduga bahwa massa
zat-zat sebelum dan sesudah bereaksi tidak berubah atau tetap. Kemukakan
dengan kalimat Anda sendiri, bunyi Hukum Kekekalan Massa yang diajukan
Lavoisier.
Data hasil pengamatan ditulis sebagai berikut.
Berat
Sebelum Reaksi (g)
|
Berat
Sesudah Reaksi (g)
|
NaOH(s)
= .....
|
Hasil
reaksi = ........
|
Cuka(aq)
= ....
|
Contoh Soal Hukum Kekekalan Massa dalam Reaksi Kimia :
Kawat tembaga dibakar dalam pembakar bunsen sehingga terbentuk tembaga oksida (CuO).
2Cu(s) + O2(g) → 2CuO(s)
Jika berat Cu semula 32 g dan CuO yang terbentuk 40 g, berapa berat O2 yang bereaksi?
Penyelesaian :
Menurut Hukum Kekekalan Massa, dalam reaksi kimia tidak terjadi perubahan massa. Oleh karena itu, berat O2 yang bereaksi adalah 40 g – 32 g = 8 g
32 g Cu(s) + 8 g O2(g) → 40 g CuO(s)
1.2. Hukum Perbandingan Tetap
Berdasarkan contoh Hukum Kekekalan Massa, 32 g Cu bereaksi dengan 8 g O2 dan terbentuk 40 g CuO. Jika 50 g Cu direaksikan dengan 8 g O2, apakah CuO yang dihasilkan menjadi 58 g?
Berdasarkan hasil penelitian, terbukti jawabannya tidak karena menurut
hasil penelitian, massa CuO yang dihasilkan tetap 40 g.
Setelah dianalisis, tambahan logam Cu sebanyak 18 g tidak bereaksi
(tetap sebagai logam Cu). Mengapa demikian?
Anda perlu bukti? Anda dapat membuktikannya dengan melakukan percobaan, misalnya reaksi antara HCl encer dan serbuk CaCO3. HCl encer sebagai variabel tetap, sedangkan CaCO3 sebagai variabel bebas. Berdasarkan hasil pengamatan, apakah semua CaCO3 dapat bereaksi dengan HCl untuk setiap gram yang dicampurkan?
Data hasil pengamatan ditulis sebagai berikut.
Berat
CaCO3
|
Volume
HCl
|
Berat
CaCO3 Sisa
|
1 g
|
50 mL
|
...............
|
2 g
|
50 mL
|
...............
|
5 g
|
50 mL
|
...............
|
10 g
|
50 mL
|
...............
|
Menurut Joseph Louis Proust (1754–1826): pembentukan senyawa memiliki
komposisi tidak sembarang. Dengan kata lain, perbandingan
massa unsur-unsur dalam senyawa selalu tetap.
Pernyataan tersebut didasarkan pada pengukuran senyawa dari
hasil reaksi-reaksi kimia dan senyawa dari berbagai sumber. Hukum ini
disebut Hukum Perbandingan Tetap atau Hukum Komposisi Tetap. Proust
melakukan sejumlah percobaan tentang perbandingan massa unsur-unsur
dalam suatu senyawa, hasilnya sebagai berikut.
a. Pada senyawa NaCl, perbandingan massa Na dan Cl selalu tetap, yaitu 39% Na dan 61% Cl atau massa Na : massa Cl = 2 : 3.
b. Pada molekul air, perbandingan massa H dan O selalu tetap, yaitu 11% H dan 89% O atau H : O = 1 : 8.
c. Pada molekul CO2, perbandingan massa C dan O selalu tetap, yaitu 27,3% C dan 72,7% O atau 3 : 8.
Contoh Soal Menentukan Komposisi Unsur dalam Senyawa :
Kawat tembaga dibakar sehingga terbentuk tembaga oksida (CuO). Perhatikan reaksi berikut.
32g Cu(s) + 8g O2(g) → 40g CuO(s)
Berapa persen massa atau perbandingan massa unsur Cu : O dalam senyawa CuO?
Kunci Jawaban :
Untuk menentukan persen massa unsur-unsur dalam senyawa adalah dengan cara membandingkan massa unsur terhadap massa senyawanya.
Persen massa Cu dalam CuO = (32 g / 40 g) x 100% = 80%
Persen massa O dalam CuO = (8 g / 40 g) x 100% = 20%
Perbandingan massa unsur Cu : O ditentukan dari perbandingan persen massa unsur-unsurnya.
Massa Cu : Massa O = 80% : 20%.
Jadi, perbandingan massa unsur Cu : O = 4 : 1.
Terdapat bukti bahwa komposisi unsur-unsur dalam suatu senyawa selalu
tetap dari mana pun sumbernya, baik dari bahan alam maupun dari hasil
sintesis di laboratorium. Bukti tersebut dapat Anda simak pada contoh
soal berikut.
Contoh Soal Berlakunya Hukum Perbandingan Tetap :
Senyawa NaCl diperoleh dari tiga sumber berbeda. Hasilnya disusun dalam tabel berikut.
Sumber
|
Laut
|
Mineral
|
Sintetis
|
Massa
NaCl
|
2,00 g
|
1,50 g
|
1,0 g
|
Massa Na
|
0,78 g
|
0,59 g
|
0,39 g
|
Massa Cl
|
1,22 g
|
0,91 g
|
0,61 g
|
Apakah senyawa NaCl pada tabel tersebut mengikuti Hukum Proust?
Kunci Jawaban :
Untuk membuktikan kebenaran Hukum Proust, dapat dilakukan perbandingan
massa setiap unsur dari ketiga sumber tersebut. Jika perbandingan massa
unsur-unsur dalam ketiga sumber itu selalu tetap, berarti Hukum Proust
terbukti.
Sumber laut:
Sumber mineral:
NaCl dari laut memiliki komposisi yang sama, demikian pula dari hasil
sintesis dengan cara yang sama akan menghasilkan perbandingan massa
tetap. Jadi, Hukum Perbandingan Tetap terbukti kebenarannya.
Pengetahuan komposisi unsur-unsur dalam senyawa dapat digunakan untuk
menentukan berat zat yang terlibat dalam reaksi secara tepat, seperti
ditunjukkan pada contoh soal berikut.
Contoh Soal 4 Kebenaran Hukum Perbandingan Tetap :
Berapa gram NH3 yang terbentuk dari 14 g N2 dan 14 g H2 ? Diketahui NH3 tersusun atas 82% N dan 18% H.
Penyelesaian :
N2(g)
|
+
|
H2(g)
|
→
|
NH3(g)
|
82%
|
18%
|
100%
|
Persen massa dapat diartikan sebagai perbandingan massa unsur-unsur yang bersenyawa sesuai Hukum Kekekalan Massa, yaitu 82 g N2 tepat bereaksi dengan 18 g H2 membentuk 100 g NH3. Jika 14 g N2 yang bereaksi maka gas H2 yang diperlukan sebanyak:
Berdasarkan persamaan reaksinya:
14g N2(g) + 3g H2(g)
→ 17g NH3(g)
(sesuai Hukum Kekekalan Massa)
Jadi, berat NH3 yang dihasilkan dari reaksi 14 g N2 dan 14 g H2 sama dengan 17 g. Menurut Hukum Proust, senyawa memiliki komposisi yang tetap. Jadi, berapa pun H2 ditambahkan, yang bereaksi hanya 3 g berat dari H2. Sisanya, tetap sebagai gas H2 sebanyak 11 g tidak bereaksi.
Praktikum Kimia Hukum Perbandingan Tetap (1) :
Tujuan
Membuktikan kebenaran hukum perbandingan tetap
Langkah Kerja
1. Amati reaksi berikut ini.
Mg(s) + O2(g) →MgO(s)
2. Amati hasil analisis percobaan I, II, dan III dalam tabel berikut.
3. Dari hasil perhitungan persentase massa pada soal nomor 2, lengkapi tabel berikut ini.
Pertanyaan :
Praktikum Kimia Hukum Perbandingan Tetap (1) :
Tujuan
Membuktikan kebenaran hukum perbandingan tetap
Langkah Kerja
1. Amati reaksi berikut ini.
Mg(s) + O2(g) →MgO(s)
2. Amati hasil analisis percobaan I, II, dan III dalam tabel berikut.
Percobaan I
|
Percobaan II
|
Percobaan III
|
|
Massa MgO
|
2,00 g
|
4,00 g
|
5,00 g
|
Massa Mg
|
1,20 g
|
2,40 g
|
3,00 g
|
Massa O
|
0,80 g
|
1,60 g
|
2,00 g
|
3. Dari hasil perhitungan persentase massa pada soal nomor 2, lengkapi tabel berikut ini.
Berat Mg
|
Berat O2
|
Berat MgO
|
Berat Sisa Mg
|
24 g
|
16 g
|
...
|
...
|
28 g
|
16 g
|
...
|
...
|
36 g
|
16 g
|
...
|
...
|
50 g
|
16 g
|
...
|
...
|
Pertanyaan :
- Tunjukkan bahwa data hasil percobaan sesuai dengan Hukum Perbandingan Tetap Proust.
- Berapakah persen massa atau perbandingan massa unsur Mg dan O?
- Berapa gram massa MgO yang dihasilkan dari reaksi tersebut?
- Berapa gram sisa Mg yang tidak bereaksi?
- Apa yang dapat Anda simpulkan dari perhitungan itu?
1.3. Hukum Perbandingan Berganda
Apa yang dimaksud dengan Hukum Perbandingan Berganda? Jika dari namanya,
Anda tentu baru mengenal. Padahal, materinya sudah banyak disebutkan
sebelumnya, misalnya CO dan CO2 atau NO dan NO2. Jika pembakaran karbon dilakukan pada suhu tinggi dan pasokan O2 kurang maka
akan terbentuk gas CO. Jika pembakaran dilakukan pada suhu lebih rendah
dan pasokan oksigen berlebih maka akan terbentuk gas CO2.
Jika disimak dari contoh tersebut, Anda tentu dapat menduga bahwa hukum
ini berhubungan dengan senyawa yang tersusun atas unsur yang sama,
tetapi komposisi berbeda.
Menurut Dalton: jika dua macam unsur membentuk lebih dari satu senyawa
maka massa salah satu unsur berbanding sebagai kelipatan bilangan bulat
dan sederhana. Pernyataan ini dikenal dengan Hukum Perbandingan Berganda
dari Dalton.
Contoh :
Fosfor dan klorin dapat membentuk dua macam senyawa. Dalam senyawa X : 2
g fosfor tepat bereaksi dengan 6,9 g klorin. Dalam senyawa Y : 2 g
fosfor tepat bereaksi dengan 11,5 g oksigen. Bagaimana rumus kedua
senyawa ini?
Perbandingan massa unsur klorin dalam kedua senyawa (untuk berat fosfor
yang sama) adalah 6,9 : 11,5 = 3 : 5. Dengan demikian, rumus senyawa X
dan Y adalah PCl3 dan PCl5 dengan bentuk struktur seperti Gambar 1.
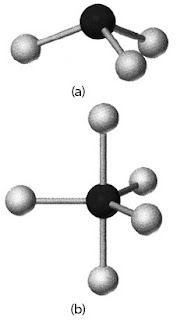 |
| Gambar 1. (a) Struktur molekul PCl3 (b) Struktur molekul PCl5 |
Contoh Soal Hukum Perbandingan Berganda Berdasarkan Massa :
Unsur nitrogen dan oksigen dapat membentuk lebih dari satu senyawa, misalnya NO, NO2, N2O3,
dan N2O4. Pada kondisi tertentu, 1 g
nitrogen tepat bereaksi dengan 1,14 g oksigen. Pada kondisi yang lain, 1
g nitrogen tepat bereaksi dengan 2,28 g oksigen.
Jelaskan bahwa data ini sesuai dengan Hukum Perbandingan Berganda. Bagaimana rumus kimia kedua senyawa itu?
Kunci Jawaban :
Untuk berat nitrogen yang sama (1 g), perbandingan massa oksigen untuk
kedua senyawa itu adalah 1,14 : 2,28 atau 1 : 2. Oleh karena
perbandingan unsur oksigen pada kedua senyawa itu berupa bilangan bulat
dan sederhana maka data ini sesuai Hukum Perbandingan Berganda. Rumus
kimia kedua senyawa itu adalah NO dan NO2.
Contoh Soal Hukum Perbandingan Berganda Berdasarkan Persen Massa :
Unsur hidrogen dan oksigen dapat membentuk air dan suatu
peroksida. Persen massa unsur-unsur dalam air adalah 11,1% berat H dan
88,9% berat O. Persen massa dalam peroksida adalah 5,93% berat H dan
94,07% berat O.
Jelaskan bahwa data ini sesuai Hukum Perbandingan Berganda dan tentukan rumus peroksidanya.
Kunci Jawaban :
Berdasarkan persen berat, dapat diartikan bahwa dalam air terkandung
11,1 g H dan 88,9 g O. Jika berat H = 1 g maka berat O dalam air
adalah 1 g H :
 × 88,9 = 8 g
× 88,9 = 8 g
Dalam peroksida terkandung 5,93 g H dan 94,07 g O.
Jika berat H = 1g, maka berat O dalam peroksida adalah :
Untuk berat H yang sama, perbandingan massa O dalam air dan peroksida adalah 8 : 16 = 1 : 2.
Dengan demikian, data ini sesuai Hukum Perbandingan Berganda. Oleh karena molekul air H2O maka rumus molekul peroksida adalah H2O2.
1.4. Hukum Perbandingan Volume
Hukum-hukum perbandingan yang telah Anda pelajari hanya mengkaji
komposisi senyawa, sedangkan Hukum Perbandingan Volume berhubungan
dengan reaksi-reaksi kimia yang melibatkan wujud gas. Bagaimana
perbandingan volume gas-gas yang bereaksi dan adakah hubungan antara
volume gas-gas yang bereaksi dan koefisien reaksinya?
Untuk menjawab masalah ini, Anda dapat melakukan percobaan menggunakan tabung eudiometer. Misalnya, masukkan gas H2 dan gas O2 dengan
volume terukur ke dalam eudiometer. Kemudian, hubungkan alat itu dengan
arus listrik dan tekan tombol pembangkit bunga api listrik (piezo
electric). Piezo electric adalah alat pembangkit bunga api listrik,
seperti pada bensin dan kompor gas.
Percobaan dilakukan berulangkali pada kondisi tetap. Setiap kali percobaan, volume H2 dijadikan variabel tetap, sedangkan volume O2 dijadikan variabel bebas. Kemudian, dilakukan sebaliknya, volume O2 dijadikan variabel tetap dan volume H2 variabel bebas.
Joseph Louis Gay-Lussac (Kimiawan Prancis), dua abad yang lalu melakukan percobaan seperti itu. Pada percobaan I, volume H2 dibuat tetap, sedangkan volume O2 bervariasi dan sebaliknya. Hasilnya ditabulasikan ke dalam Tabel 1.
Tabel 1. Data Hasil Pengamatan Volume H2 Tetap
V H2
|
V O2
|
V H2O
|
20 mL
|
5 mL
|
10 mL
|
20 mL
|
10 mL
|
20 mL
|
20 mL
|
15 mL
|
20 mL
|
20 mL
|
20 mL
|
20 mL
|
Volume O2 tetap :
V H2
|
V O2
|
V H2O
|
10 mL
|
10 mL
|
10 mL
|
15 mL
|
10 mL
|
15 mL
|
20 mL
|
10 mL
|
20 mL
|
25 mL
|
20 mL
|
20 mL
|
Pada saat volume O2 10 mL, volume H2O tidak berubah, yaitu 20 mL. Demikian pula pada percobaan II, volume H2O tidak berubah lagi (20 mL) setelah volume H2 mencapai 20 mL (volume O2 = 10 mL). Jadi, perbandingan volume dari reaksi H2 dan O2 adalah sebagai berikut.
20 mL gas H2 + 10 mL gas O2
→ 20 mL H2O
Sejalan dengan percobaan tersebut, reaksi gas-gas lain juga diukur perbandingan volumenya, seperti ditunjukkan pada Tabel 2.
Tabel 2. Perbandingan Volume Gas-Gas dalam Reaksi
Persamaan Reaksi
|
Perbandingan Volume
|
H2(g)
+ Cl2(g) → 2HCl(g)
|
10 mL :
10 mL : 20 mL
|
3H2(g)
+ N2(g) → 2NH3(g)
|
15 mL :
5 mL : 10 mL
|
N2(g)
+ 2O2(g) → 2NO2(g)
|
10 mL :
20 mL : 20 mL
|
Berdasarkan data perbandingan volume gas-gas yang bereaksi, Gay-Lussac menyimpulkan sebagai berikut.
Pada suhu dan tekanan tetap, volume gas-gas yang bereaksi dan
volume gas-gas hasil reaksi berbanding lurus dengan koefisien reaksinya
sebagai bilangan bulat dan sederhana. Pernyataan ini disebut Hukum
Perbandingan Volume.
Contoh Soal Hukum Perbandingan Volume :
Ke dalam tabung eudiometer dimasukkan gas O2 dan gas SO2,
kemudian dilewatkan bunga api listrik. Pada suhu 25 °C dan tekanan 1
atm, volume gas-gas yang bereaksi diukur. Hasilnya ditunjukkan pada
tabel berikut.
Pada volume O2 tetap:
Percobaan
|
Volume O2
|
Volume SO2
|
Volume SO3
|
1.
|
10 mL
|
10 mL
|
10 mL
|
2.
|
10 mL
|
15 mL
|
15 mL
|
3.
|
10 mL
|
20 mL
|
20 mL
|
4.
|
10 mL
|
25 mL
|
20 mL
|
Pada volume SO2 tetap:
Percobaan
|
Volume O2
|
Volume SO2
|
Volume SO3
|
1.
|
5 mL
|
20 mL
|
10 mL
|
2.
|
10 mL
|
20 mL
|
20 mL
|
3.
|
15 mL
|
20 mL
|
20 mL
|
4.
|
20 mL
|
20 mL
|
20 mL
|
Bagaimana perbandingan volume SO2 : O2 : SO3 ?
Apakah sesuai dengan Hukum Perbandingan Volume? Tuliskan persamaan
reaksinya beserta koefisien reaksi berdasarkan hasil percobaan.
Kunci Jawaban :
Pada volume O2 tetap
Simak percobaan 3, volume SO3 tidak berubah lagi saat volume SO2 mencapai 20 mL.
Pada volume SO2 tetap
Simak percobaan 2, volume SO3 tidak berubah lagi saat volume O2 mencapai 10 mL.
Perbandingan volume SO2 : O2 : SO3 adalah :
SO2 + O2 → SO3
20 mL : 10 mL : 20 mL
Dengan demikian, data tersebut sesuai dengan Hukum Gay-Lussac.
Persamaan reaksi yang terjadi adalah :
2SO2(g) + O2(g) → 2SO3(g)
Contoh Soal Ebtanas 1992 :
Pada reaksi pembakaran etuna menurut reaksi:
C2H2 (g) + O2 (g) → CO2(g) + H2O (g)
Perbandingan volume gas-gas yang bereaksi adalah ....
A. 2 : 5 : 4 : 2
B. 2 : 5 : 3 : 3
C. 1 : 3 : 2 : 2
D. 1 : 1 : 2 : 1
E. 1 : 1 : 1 : 1
Pembahasan :
Pada suhu dan tekanan, tetapi perbandingan gas-gas yang bereaksi dan hasil reaksi berbanding lurus dengan koefisien reaksinya.
2C2H2 (g) + 5O2 (g) → 4CO2(g) + 2H2O (g)
Jadi, perbandingan volumenya : 2 : 5 : 4 : 2 (A)
1.5. Hukum Avogadro
Pada reaksi pembakaran etuna menurut reaksi:
C2H2 (g) + O2 (g) → CO2(g) + H2O (g)
Perbandingan volume gas-gas yang bereaksi adalah ....
A. 2 : 5 : 4 : 2
B. 2 : 5 : 3 : 3
C. 1 : 3 : 2 : 2
D. 1 : 1 : 2 : 1
E. 1 : 1 : 1 : 1
Pembahasan :
Pada suhu dan tekanan, tetapi perbandingan gas-gas yang bereaksi dan hasil reaksi berbanding lurus dengan koefisien reaksinya.
2C2H2 (g) + 5O2 (g) → 4CO2(g) + 2H2O (g)
Jadi, perbandingan volumenya : 2 : 5 : 4 : 2 (A)
1.5. Hukum Avogadro
Setelah hukum perbandingan volume dipublikasikan dalam
jurnal-jurnal internasional, pakar kimia Italia, Amadeo Avogadro,
berteori dengan hukum tersebut. Dia mengajukan hipotesis sebagai
berikut.
Pada suhu dan tekanan sama, gas-gas yang volumenya sama mengandung jumlah molekul yang sama.
Makna hipotesis itu dapat diartikan bahwa pada suhu dan tekanan yang
sama, perbandingan volume gas-gas yang bereaksi menunjukkan perbandingan
molekul-molekulnya. Sebagai gambaran, tinjau reaksi antara gas N2 dan gas O2 menghasilkan gas NO2.
1 volume N2 + 2 volume O2 →2 volume NO2
1 molekul N2 + 2 molekul O2 →2 molekul NO2
n molekul N2 + 2n molekul O2 →2n molekul NO2
Jika reaksi diukur pada suhu dan tekanan yang sama, jumlah molekul O2 yang bereaksi dua kali jumlah molekul N2 (volumenya 2×) dan jumlah molekul NO2 yang dihasilkan dua kali jumlah molekul N2 atau sama dengan jumlah molekul O2 .
Oleh karena hipotesis Avogadro dapat diterima kebenarannya dan dapat
dibuktikan (kapan pun, di mana pun, oleh siapa pun) maka hipotesis
tersebut telah dikukuhkan sebagai Hukum Avogadro. Pada pembakaran metana
juga berlaku Hukum Avogadro, seperti ditunjukkan pada Gambar 2.
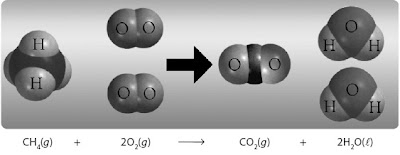 |
| Gambar 2. Reaksi pembakaran metana dengan perbandingan volume tetap |
Sekilas Kimia
Amadeo Avogadro
(1776–1856)
Avogadro menunjukkan bahwa dalam volume yang sama dari dua gas tertentu
selalu terdapat jumlah molekul yang sama jika gas itu
memiliki temperatur dan tekanan yang sama. Sebelum teori Avogadro
lahir, ada paradigma bahwa zat-zat yang bereaksi berupa atom-atom (bukan
molekul). Jika paradigma itu benar, NO2 dibentuk dari 1 atom O dan ½ atom N. Hal ini tidak sesuai dengan model atom (tidak mungkin atom pecahan).
Contoh Soal Penerapan Hipotesis Avogadro :
Pada suhu dan tekanan tertentu, gas N2 direaksikan dengan gas H2 menjadi gas NH3. Jika gas H2 yang bereaksi sebanyak 7,5 × 1023 molekul, berapakah jumlah molekul NH3 yang terbentuk?
Kunci Jawaban :
Pada suhu dan tekanan sama, gas-gas yang volumenya sama mengandung
jumlah molekul yang sama (Avogadro). Koefisien reaksi menyatakan
perbandingan volume gas-gas yang bereaksi (Gay-Lussac).
N2(g)
|
+
|
H2(g)
|
→
|
NH3(g)
|
3 v
|
:
|
1 v
|
:
|
2 v
|
7,5 × 1023
|
?
|
Dalam 3 volume H2 terkandung 7,5 × 1023 molekul maka dalam 2 volume NH3 terkandung :
Jumlah molekul NH3 = 5,0 × 1023 molekul
B. Konsep Mol dan Tetapan Avogadro
Munculnya Hukum Avogadro berpengaruh sangat signifikan
terhadap perkembangan ilmu Kimia, khususnya dalam pengukuran zat-zat
di laboratorium. Pengukuran berat suatu zat pada umumnya
menggunakan satuan gram, sedangkan massa atom dan molekul dinyatakan
dalam satuan Ar dan Mr. Bagaimana hubungan Ar atau Mr dengan berat suatu
zat dalam satuan gram?
2.1. Tetapan Avogadro (L)
Sumbangan Avogadro tidak berhenti sampai hubungan jumlah partikel
(molekul, atom, ion) dan volume gas, tetapi merambah lebih jauh kepada
hubungan jumlah partikel dan massa zat. Sebagai gambaran hubungan jumlah
partikel dan massa suatu zat, mari kita tinjau partikel yang diemisikan
oleh unsur radioaktif berikut ini.
Berdasarkan hasil pengukuran, diketahui bahwa satu gram radium dapat mengemisikan partikel alfa sebanyak 11,6 × 1017 partikel. Partikel alfa sebanyak 11,6 × 1017 setara dengan helium sebanyak 7,7 × 10-6 g.
Radium
|
→
|
Partikel alfa (α )
|
≈
|
Atom helium
|
(1 g)
|
:
|
(11,6 × 1017 partikel)
|
:
|
(7,7 × 10-6 g)
|
Oleh karena partikel alfa adalah inti atom helium maka jumlah atom helium dalam satu gram adalah
Jadi, dalam 1g helium terkandung 1,507 × 1023 atom
helium. Ini menyatakan hubungan massa (g) dan jumlah partikel
(atom). Berdasarkan hasil perhitungan, selalu muncul bilangan sebesar
6,02 × 1023 untuk
jumlah molekul yang massanya sebesar nilai massa atom relatif untuk
unsur atau sebesar massa molekul relatif unsur senyawa.
Contoh Soal Hubungan Jumlah Partikel dan Massa Zat :
Pada P dan T tertentu, 1 g metana mengandung 3,75 × 1022 molekul CH4 . Berapa jumlah molekul gas CH4 dalam 16 g?
Kunci Jawaban :
Dalam 1 g CH4 terkandung 3,75 × 1022 molekul CH4.
Dalam 16 g CH4 terkandung :
Jadi, dalam 16 g metana terkandung 6,0 × 1023 molekul CH
Contoh:
Dalam 18 g air (Mr H2O = 18) terkandung 6,02 × 1023 molekul H2O.
Dalam 23 g natrium (Ar Na = 23) terkandung 6,02 × 1023 atom Na.
Dalam 58,5 g natrium klorida (Mr NaCl = 58,5) terkandung 6,02 × 1023 satuan rumus NaCl.
Oleh karena itu, bilangan sebesar 6,02 × 1023 dinyatakan sebagai tetapan Avogaro yang disingkat L.
L = 6,02 × 1023 partikel
Contoh Soal Ebtanas 1998 :
Sejumlah x molekul gas propana dibakar habis dengan O2 menurut persamaan:
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)
Pada P dan T yang sama, jumlah molekul gas CO2 yang dihasilkan ....
A. x molekul
B. 3x molekul
C. 4x molekul
D. 5x molekul
E. 6x molekul
Pembahasan :
Pada P dan T yang sama, persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam reaksi. Jadi persamaan reaksinya yaitu:
1 molekul C3H8 (g) + 5 molekul O2 (g) → 3 molekul CO2 (g) + 4 molekul H2O (g)
1 molekul C3H8 (g) = x molekul
berarti, CO2 = 3x molekul. (B)
Contoh Soal Ebtanas 1998 :
Sejumlah x molekul gas propana dibakar habis dengan O2 menurut persamaan:
C3H8 (g) + 5O2 (g) → 3CO2 (g) + 4H2O (g)
Pada P dan T yang sama, jumlah molekul gas CO2 yang dihasilkan ....
A. x molekul
B. 3x molekul
C. 4x molekul
D. 5x molekul
E. 6x molekul
Pembahasan :
Pada P dan T yang sama, persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam reaksi. Jadi persamaan reaksinya yaitu:
1 molekul C3H8 (g) + 5 molekul O2 (g) → 3 molekul CO2 (g) + 4 molekul H2O (g)
1 molekul C3H8 (g) = x molekul
berarti, CO2 = 3x molekul. (B)
2.2. Pengertian Mol
Berdasarkan perhitungan, dalam 56 g besi terkandung 6,02 × 1023 atom besi, dalam satu mililiter air terkandung 3,345 × 1022 molekul air.
Angka-angka sebesar ini tidak efisien jika dipakai untuk perhitungan zat-zat di laboratorium.
Agar lebih sederhana, para ilmuwan menetapkan suatu satuan jumlah zat
yang menyatakan banyaknya partikel zat itu. Satuan ini dinamakan mol.
Berdasarkan kesepakatan, untuk partikel yang jumlahnya sebesar tetapan
Avogadro atau 6,02 × 1023 dinyatakan sebesar satu mol. Dengan kata lain, satu mol setiap zat mengandung 6,02 × 1023 partikel zat, baik atom, molekul, maupun ion.
Contoh :
Dalam satu mol besi terkandung 6,02 × 1023 atom Fe.
Dalam satu mol air terkandung 6,02 × 1023 molekul H2O.
Dalam satu mol natrium klorida terkandung 6,02 × 1023 ion Na+ dan 6,02 × 1023 ion Cl–.
Contoh Soal Hubungan Mol dan Jumlah Partikel :
a. Berapa jumlah atom karbon yang terkandung dalam 0,05 mol karbon?
b. Berapa mol gas O2 yang mengandung 1,5 × 1023 molekul O2?
Kunci Jawaban :
a. Dalam 1 mol karbon terkandung 6,02 × 1023 atom karbon.
Dalam 0,05 mol karbon akan mengandung atom karbon sebanyak:
b. Molekul O2 sebanyak 6,02 × 1023 adalah 1 mol.
Jumlah mol untuk 1,5 × 1023 molekul O2 adalah
C. Massa Molar dan Volume Molar Gas
Bagaimana hubungan antara Ar atau Mr dan massa zat agar kita dapat
menentukan jumlah zat-zat yang bereaksi dan meramalkan jumlah hasil
reaksinya? Untuk dapat menjawab hal tersebut, Anda harus memahami massa
molar dan volume molar.
3.1. Massa Molar
Berdasarkan hasil perhitungan, diketahui bahwa dalam 18 g air terkandung 6,02 × 1023 molekul H2O. dalam 23 g natrium terkandung 6,02 × 1023 atom Na, dan dalam 58,5 g natrium klorida terkandung 6,02 × 1023 satuan rumus NaCl.
Pada bab sebelumnya, Anda sudah dapat menentukan Mr H2O =
18; Ar Na = 23; dan Mr NaCl = 58,5. Berdasarkan informasi tersebut,
terlihat adanya hubungan yang teratur antara massa zat (g), Ar atau Mr,
dan jumlah partikel (L). Hubungan tersebut dinyatakan dalam bentuk
tabel berikut.
Tabel 3. Hubungan Massa (Ar/Mr), Jumlah partikel, dan Mol Beberapa Zat
Zat
|
Massa (g)
|
A r/Mr
|
Jumlah
Partikel
|
Mol
|
H2O
|
18
|
18
|
6,02 × 1023 molekul H2O
|
1
|
Na
|
23
|
23
|
6,02 × 1023 atom Na
|
1
|
NaCl
|
58,5
|
58,5
|
6,02 × 1023 satuan NaCl
|
1
|
Berdasarkan hubungan pada tabel tesebut, diketahui bahwa massa zat yang
besarnya sama dengan nilai Ar atau Mr mengandung jumlah
partikel sebanyak 6,02 × 1023 atau
sebesar satu mol. Dengan demikian, disimpulkan bahwa massa satu mol zat
sama dengan nilai Ar (untuk atom) atau Mr (untuk senyawa). Massa satu
mol zat disebut massa molar (Mm) dengan satuan gram per mol (g mol–1).
 |
| Gambar 3. Hubungan besaran kimia. |
Contoh Soal Penerapan Massa Molar :
- Besi beratnya 25 g. Berapa mol besi tersebut ? Diketahui Ar Fe = 56 g mol–1.
- Jumlah mol grafit dalam suatu baterai adalah 1,5 mol. Berapa berat grafit tersebut ? Diketahui Ar C = 12 g mol–1.
- Berapa berat 1 atom besi ? Diketahui Ar Fe = 56 sma.
- Berapa jumlah molekul CO2 yang terdapat dalam 4 g CO2 ? Diketahui Mr CO2 = 44 sma.
Kunci Jawaban :
1. Massa molar besi: Mm Fe = 56 g mol–1
Jumlah mol besi =  = 0,446 mol.
= 0,446 mol.
Massa 1,5 mol C = 1,5 mol x 12 g mol–1 = 18 g.
3. Ar Fe = 56 sma, Jadi, massa molar Fe = 56 g mol–1.
Massa 1 atom Fe adalah :
Jadi, berat 1 atom Fe = 9,3 × 1023 g.
4. Massa molar CO2 = 44 g mol–1
Jumlah mol CO2 =  = 0,09 mol
= 0,09 mol
3.2. Volume Molar Gas
Menurut Amedeo Avogadro: pada suhu dan tekanan tertentu, setiap gas yang
volumenya sama mengandung jumlah molekul yang sama. Artinya, gas apapun
selama volumenya sama dan diukur pada P dan T yang sama akan mengandung
jumlah molekul yang sama. Jika jumlah molekul gas sebanyak tetapan
Avogadro (L= 6,02 × 1023 molekul) maka dapat dikatakan jumlah gas tersebut adalah satu mol.
Berdasarkan perhitungan yang mengacu pada Hukum Avogadro, pada 0 °C dan 1
atm (STP, Standard Temperature and Pressure), volume satu mol gas
adalah 22,4 liter. Volume satu mol gas ini dikenal dengan volume molar
gas, disingkat Vm.
Tabel 4. Volume Molar Gas Beberapa Zat pada Keadaan STP
Zat
|
Massa
(g)
|
Mol
|
Volume
|
Jumlah Molekul
|
NO2
|
46
|
1
|
22,4
|
6,02 × 1023
|
NH3
|
17
|
1
|
22,4
|
6,02 × 1023
|
CO
|
28
|
1
|
22,4
|
6,02 × 1023
|
CO
|
17
|
1
|
22,4
|
6,02 × 1023
|
Sekilas Kimia
Hukum Boyle: Hubungan Tekanan dan Volume
Robert Boyle (1627–1691) adalah seorang kimiawan Inggris. Pada abad
ke-17, Boyle mempelajari sifat gas-gas secara sistematis
dan kuantitatif. Boyle menyelidiki hubungan antara tekanan dan volume
suatu sampel gas dengan menggunakan peralatan seperti yang ditunjukkan
pada gambar. Mula-mula dilakukan penekanan pada gas dengan
menambahkan merkuri (Hg) pada tabung, yang tekanannya sama dengan
tekanan atmosfer. Peningkatan tekanan ditunjukkan oleh merkuri
dengan level berbeda pada dua kolom. Ketika percobaan, temperatur
gas dijaga konstan.
Dari percobaan Boyle tersebut, diketahui bahwa volume gas (V) berbanding terbalik dengan tekanan (P) pada suhu tetap (T konstan).
V ∝ 1/P
(Sumber: Chemistry, 1994)
Dari percobaan Boyle tersebut, diketahui bahwa volume gas (V) berbanding terbalik dengan tekanan (P) pada suhu tetap (T konstan).
V ∝ 1/P
(Sumber: Chemistry, 1994)
Contoh Soal Penerapan Volume Molar Gas :
a. Berapa volume 16 g gas O2 yang diukur pada keadaan STP ? Diketahui Mr O2 = 32.
b. Berapa jumlah molekul N2 yang terdapat dalam 5,6 L gas N2 diukur pada keadaan STP ?
Penyelesaian :
Massa molar O2 = 32 g mol–1
Jumlah mol O2 = = 0,5 mol
Pada STP, volume molar O2 = 22,4 L mol–1,
maka volume 0,5 mol O2 = 0,5 mol × 22,4 L mol–1 = 11,2 L
Jadi, volume untuk 16g O2 pada STP = 11,2 L
b. Pada STP, volume molar N2 = 22,4 L mol–1
Jumlah mol N2 dalam 5,6 L = = 0,25 mol.
Jumlah molekul N2 dalam satu mol = 6,02 × 1023.
Jumlah molekul N2 dalam 0,25 mol = 0,25 mol × 6,02 × 1023 molekul/mol = 1,505 × 1023 molekul.
Jadi, jumlah N2 dalam 5,6 L = 1,505 × 1023 molekul
Penyelesaian :
Massa molar O2 = 32 g mol–1
Jumlah mol O2 = = 0,5 mol
Pada STP, volume molar O2 = 22,4 L mol–1,
maka volume 0,5 mol O2 = 0,5 mol × 22,4 L mol–1 = 11,2 L
Jadi, volume untuk 16g O2 pada STP = 11,2 L
b. Pada STP, volume molar N2 = 22,4 L mol–1
Jumlah mol N2 dalam 5,6 L = = 0,25 mol.
Jumlah molekul N2 dalam satu mol = 6,02 × 1023.
Jumlah molekul N2 dalam 0,25 mol = 0,25 mol × 6,02 × 1023 molekul/mol = 1,505 × 1023 molekul.
Jadi, jumlah N2 dalam 5,6 L = 1,505 × 1023 molekul
3.3. Volume Molar Gas Non STP
Bagaimana menentukan volume suatu gas pada keadaan tidak standar? Untuk
menentukan volume gas pada suhu dan tekanan tertentu dapat dihitung
menggunakan persamaan gas ideal. Persamaan gas ideal adalah suatu
persamaan yang diturunkan berdasarkan asumsi para pakar kimia dengan
mengacu pada hasil-hasil percobaan seperti Charles, Amonton, Boyle, dan
Gay-Lussac.
Hukum Charles menyatakan bahwa: pada tekanan tetap, volume
gas berbanding lurus dengan suhu mutlaknya. Secara matematis dirumuskan
sebagai:
V ≈ T
Hukum Amonton menyatakan bahwa: pada volume tetap, tekanan
gas berbanding lurus dengan suhu mutlaknya. Secara matematis dirumuskan
sebagai:
P ≈ T
Boyle dan Gay-Lussac menggabungkan ketiga besaran gas (tekanan, suhu, dan volume) menghasilkan persamaan berikut:
PV ≈ T
Menurut Avogadro, persamaan tersebut dapat ditulis sebagai:
PV = RT
R adalah tetapan molar gas yang tidak bergantung pada P, T, dan
V, tetapi hanya bergantung pada jumlah mol gas. Menurut percobaan, nilai
R = 0,082 L atm mol–1 K–1.
Berdasarkan uraian tersebut, persamaan gas ideal dapat ditulis sebagai berikut.
Keterangan:
P = Tekanan (atm)
V = Volume (L)
T = Suhu mutlak (K)
n = Jumlah partikel (mol)
R = Tetapan gas (L atm mol–1 K–1) = 0,082 L atm mol–1 K–1.
Contoh Soal Penerapan Pesamaan Gas Ideal :
Berapa volume gas H2 yang terdapat dalam balon pada 27 °C jika tekanan H2 2 atm dan beratnya 0,5 g? Diketahui: R = 0,082 L atm mol–1 K–1..
Kunci Jawaban :
Untuk menentukan volume H2, pertama menghitung jumlah molnya, kemudian menghitung volume gas H2 melalui persamaan untuk gas ideal PV = nRT.
Jumlah mol H2 =  = 0,25 mol.
= 0,25 mol.
Volume H2 pada 27 °C dan 1 atm :
PV = nRT
D. Perhitungan Kimia
Setelah Anda mengetahui hubungan antara besaran-besaran kimia seperti
massa, mol, jumlah partikel, dan Ar atau Mr maka Anda
dapat menerapkannya dalam perhitungan kimia. Misalnya, berapa volume
gas CO2 yang
dihasilkan dari pembakaran 2 liter bensin atau berapa gram aluminium
yang harus direaksikan dengan HCl agar dihasikan 5 liter gas H2? Semua ini dapat Anda lakukan sekarang.
Stoikiometri Reaksi
Kita kembali ke topik persamaan reaksi. Anda sudah mengetahui bahwa
persamaan reaksi menyatakan jumlah atom atau molekul yang terlibat dalam
reaksi (Hukum Avogadro). Banyaknya zat yang terlibat dalam reaksi kimia
ditunjukkan oleh koefisien reaksinya.
Contoh :
 |
| Gambar 4. Reaksi antara gas klorin dan gas hidrogen. |
Reaksi antara gas hidrogen dan gas klorin membentuk hidrogen klorida (Gambar 4) diungkapkan dalam persamaan reaksi berikut.
H2(g) + Cl2(g)
→ 2HCl(g)
Persamaan reaksi ini bermakna bahwa:
1 molekul H2 + 1 molekul Cl2 → 2 molekul HCl
atau
n molekul H2 + n molekul Cl2 → 2n molekul HCl
Jika nilai n dari persamaan reaksi tersebut sama dengan 6,02 × 1023 atau sebesar
tetapan Avogadro maka n molekul sama dengan satu mol. Dengan demikian,
persamaan reaksi tersebut menyatakan perbandingan mol.
2 mol C + 1 mol O2 → 2 mol CO
Dapat disimpulkan bahwa koefisien reaksi pada persamaan
kimia menunjukkan perbandingan jumlah mol zat-zat yang bereaksi dan
zat-zat hasil reaksi. Perbandingan koefisien reaksi ini dinamakan rasio
stoikiometri yang disingkat RS.
Sebagai gambaran aplikasi konsep mol dalam reaksi kimia dapat disimak contoh reaksi berikut:
Contoh:
Berapa mol H2O yang dihasilkan jika 2 mol O2 direaksikan dengan gas H2 berlebih? Pernyataan "berlebih" mengisyaratkan bahwa jumlah H2 lebih melimpah dari yang diperlukan untuk bereaksi secara tepat dengan 2 mol O2. Oleh karena itu, jumlah H2O yang dihasilkan bergantung pada jumlah O2.
2H2(g) + O2(g) →
2H2O(l)
Berdasarkan persamaan reaksi, 2 mol H2 bereaksi dengan 1 mol O2 menghasilkan 2 mol H2O . Jika O2 yang bereaksi sebanyak 2 mol maka jumlah mol H2O dapat ditentukan dari rasio stoikiometri (RS H2O/O2).
Contoh Soal Terapan Mol dalam Reaksi Pembakaran :
Tentukan berat air yang dihasilkan jika 0,25 mol gas butana dibakar dalam oksigen berlebih.
Kunci Jawaban :
Persamaan kimia yang terjadi:
2C4H10(g)
+ 13O2(g) → 8CO2(g) + 10H2O(g)
Dalam persamaan tersebut, 10 mol H2O dihasilkan dari 2 mol C4H10 atau RS (H2O : C4H10) = 10 : 2
Jumlah mol air yang dihasilkan = RS × mol butana
Jumlah mol air yang dihasilkan = RS × mol butana
Jumlah mol air yang dihasilkan =  × 0,25 mol C4H10 = 1,25 mol H2O
× 0,25 mol C4H10 = 1,25 mol H2O
Massa molar H2O = 18 g mol–1
Berat H2O = 1,25 mol × 18 g mol–1 = 22,5 g
Contoh Soal Terapan Mol dalam Proses Fotosintesis :
Berapa jumlah molekul CO2 yang diperlukan untuk membentuk 90 g glukosa pada proses fotosintesis dengan bantuan energi matahari?
Penyelesaian :
Pertama, tentukan dulu jumlah mol glukosa untuk mengetahui mol CO2 melalui RS (glukosa : CO2).
Kedua, tentukan jumlah molekul CO2 melalui tetapan Avogadro.
Persamaan reaksi yang terjadi :
energi
|
||||||
6CO2(g)
|
+
|
6H2O(l)
|
→
|
C6H12O6(s)
|
+
|
12O2(g)
|
Jumlah mol glukosa yang terbentuk adalah
Jumlah mol karbondioksida yang diperlukan = RS x mol glukosa :
Jumlah molekul CO2 yang diperlukan :
3 mol CO2 × 6,02 × 1023 molekul mol–1 = 18,06 × 1023.
Jadi, CO2 yang diperlukan adalah 18,06 × 1023 molekul = 1,806 x 1024.
Sekilas Kimia
CO2 dan Efek Rumah Kaca
Dari pembakaran 1,00 g C4H10 menghasilkan 3,03 g CO2. Satu galon (3,78 L) gasolin (C8H18) menghasilkan 8 kg CO2. Pembakaran bahan bakar tersebut melepaskan sekitar 20 milyar ton CO2 ke atmosfer setiap tahunnya. Meskipun CO2 merupakan komponen kecil di atmosfer, CO2 berperanan penting dalam menyerap radiasi panas, bertindak seolah-olah seperti rumah kaca. Oleh karena itu, kita sering menyebutkan CO2 dan gas penangkap panas lainnya sebagai gas rumah kaca. Panas yang disebabkan oleh gas ini dinamakan efek rumah kaca. (Sumber: Chemistry The Central Science, 2000.)
Catatan :
Koefisien reaksi dalam persamaan reaksi menyatakan perbandingan :
• Jumlah partikel (atom, molekul, ion).
• Jumlah mol.
Dalam stoikiometri reaksi, apapun jenis informasi yang diketahui
dan jenis informasi yang ditanyakan dapat diselesaikan dengan
menggunakan empat langkah berikut.
- Tuliskan persamaan reaksi kimia setara.
- Ubah besaran yang diketahui ke dalam satuan mol.
- Gunakan rasio stoikiometri (RS) dari persamaan kimia setara untuk menentukan besaran yang ditanyakan dalam satuan mol.
- Ubah satuan mol ke dalam besaran yang ditanyakan, misalnya dalam satuan gram atau jumlah partikel.
Secara diagram, keempat langkah tersebut dapat dilihat pada gambar berikut, misalnya untuk reaksi : A →B
 |
| Gambar 5. Diagram langkah penyelesaian stoikiometri reaksi. |
Oktana (C8H18) dibakar dalam mesin mobil. Berapa volume CO2 yang dihasilkan pada pembakaran sempurna 2 liter oktana? Semua diukur pada STP.
Pembahasan :
Tahap 1: Persamaan reaksi kimia setara:
2C8H18(g)
+ 25O2(g) → 16CO2(g) + 18H2O(g)
Tahap 2: Ubah satuan volume oktana menjadi mol menggunakan volume molar.
Tahap 3: Tentukan jumlah mol oksigen menggunakan RS (CO2 : C8H18)
Mol O2 =  x 0,09 mol C8H18 = 0,72 mol
x 0,09 mol C8H18 = 0,72 mol
Tahap 4: Ubah mol O2 ke dalam satuan volume melalui volume molar.
Volume O2 = 0,72 mol × 22,4 L mol–1 = 16,128 L
Jadi, volume CO2 yang dihasilkan dari pembakaran 2 liter oktana adalah 16,128 liter.
Rangkuman :
- Dalam reaksi kimia, massa zat sebelum dan sesudah reaksi selalu tetap (Hukum Kekekalan Massa)
- Perbandingan massa unsur-unsur yang membentuk senyawa selalu tetap, tidak bergantung pada cara pembentukan maupun sumber senyawa tersebut (Hukum Perbandingan Tetap).
- Jika diukur pada suhu dan tekanan sama, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana (Hukum Perbandingan Volume).
- Pada suhu dan tekanan tetap, semua gas apapun yang volumenya sama akan mengandung jumlah molekul yang sama (Hukum Avogadro).
- Satu mol setiap zat mengandung 6,022 × 1023 partikel penyusun zat itu atau sebesar tetapan Avogadro (L)
- pada atom, molekul, maupun ion.
- Massa molar (Mm) suatu zat menunjukkan massa satu mol zat dalam satuan gram. Satuan massa molar adalah gram per mol.
- Volume molar (Vm) menunjukkan volume satu molar gas. Pada keadaan standar (0 oC dan 1 atm), volume molar gas adalah 22,4 liter per mol.
- Untuk gas-gas pada keadaan bukan standar, perhitungan volume molar gas menggunakan persamaan gas ideal, yaitu PV = nRT.
- Koefisien reaksi dalam suatu persamaan reaksi kimia, selain menunjukkan perbandingan volume dan jumlah partikel yang bereaksi juga menyatakan perbandingan mol zat-zat yang bereaksi. Perbandingan koefisien reaksi ini dinamakan rasio stoikiometri, disingkat RS.








No comments:
Post a Comment