TIPS Menghafal Sifat-Sifat Sistem Periodik Unsur
SIFAT-SIFAT SISTEM PERIODIK UNSUR
Berikut ini adalah beberapa sifat dari Sistem Periodik Unsur:
1. Jari jari atom adalah jarak dari inti atom ke lintasan elektron terluar.
- Dalam satu perioda, dari kiri ke kanan jari jari atom berkurang. – Dalam satu golongan, dari atas ke bawah jari-jari atom bertambah. – Jari-jari atom netral lebih besar daripada jari-jari ion positifnya tetapi lebih kecil dari jari-jari ion negatifnya.
Contoh:
jari-jari atom Cl < jari-jari ion Cl-
jari-jari atom Ba > jari-jari ion Ba2+
2. Potensial ionisasi adalah energi yang diperlukan untuk melepaskan elektron yang paling lemah/luar dari atom suatu unsur atau ion dalam keadaan gas.
- Dalam satu perioda, dari kiri ke kanan potensial ionisasi bertambah. – Dalam satu golongan, dari atas ke bawah potensial ionisasi berkurang.
3. Affinitas elektron adalah besarnya energi yang dibebaskan pada saat atom suatu unsur dalam keadaan gas menerima elektron.
- Dalam satu perioda, dari kiri ke kanan affinitas elektron bertambah. - Dalam satu golongan, dari atas ke bawah affinitas elektron berkurang.
4. Keelektronegatifan adalah kemampuan atom suatu unsur untuk menarik elektron ke arah intinya dan digunakan bersama.
Berikut adalah TIPS untuk menghafal Beberapa Sifat dari SIStem Periodik Unsur tersebut:
 Arti gambar disamping:
Arti gambar disamping:
1. NON artinyasifat non logam unsur
2. GI artinya sifat Energi Ionisasi
3. A artinya sifat Afinitas elektron
4. M artinya sifat logam Logam
5. ARI artinya sifat Jari-Jari
6. tanda + menunjukkan sifat dari sistem periodik unsur yang dimaksud semakin kuat
7. Tanda – artinya sifat dari sistem periodik unsur tersebut melemah.
8. Tanda panah dari kiri ke kanan menunjukkan sifat sistem periodik dalam satu perioda dari kiri ke kanan
9. Tanda panah dari atas ke bawah menunjukkan sifat sistem periodik dalam satu golongan dari atas kebawah
Berikut ini adalah beberapa sifat dari Sistem Periodik Unsur:
1. Jari jari atom adalah jarak dari inti atom ke lintasan elektron terluar.
- Dalam satu perioda, dari kiri ke kanan jari jari atom berkurang. – Dalam satu golongan, dari atas ke bawah jari-jari atom bertambah. – Jari-jari atom netral lebih besar daripada jari-jari ion positifnya tetapi lebih kecil dari jari-jari ion negatifnya.
Contoh:
jari-jari atom Cl < jari-jari ion Cl-
jari-jari atom Ba > jari-jari ion Ba2+
2. Potensial ionisasi adalah energi yang diperlukan untuk melepaskan elektron yang paling lemah/luar dari atom suatu unsur atau ion dalam keadaan gas.
- Dalam satu perioda, dari kiri ke kanan potensial ionisasi bertambah. – Dalam satu golongan, dari atas ke bawah potensial ionisasi berkurang.
3. Affinitas elektron adalah besarnya energi yang dibebaskan pada saat atom suatu unsur dalam keadaan gas menerima elektron.
- Dalam satu perioda, dari kiri ke kanan affinitas elektron bertambah. - Dalam satu golongan, dari atas ke bawah affinitas elektron berkurang.
4. Keelektronegatifan adalah kemampuan atom suatu unsur untuk menarik elektron ke arah intinya dan digunakan bersama.
Berikut adalah TIPS untuk menghafal Beberapa Sifat dari SIStem Periodik Unsur tersebut:
 Arti gambar disamping:
Arti gambar disamping:1. NON artinyasifat non logam unsur
2. GI artinya sifat Energi Ionisasi
3. A artinya sifat Afinitas elektron
4. M artinya sifat logam Logam
5. ARI artinya sifat Jari-Jari
6. tanda + menunjukkan sifat dari sistem periodik unsur yang dimaksud semakin kuat
7. Tanda – artinya sifat dari sistem periodik unsur tersebut melemah.
8. Tanda panah dari kiri ke kanan menunjukkan sifat sistem periodik dalam satu perioda dari kiri ke kanan
9. Tanda panah dari atas ke bawah menunjukkan sifat sistem periodik dalam satu golongan dari atas kebawah
- Contoh cara membacanya: Sifat NON logam dalam satu perioda dari kiri ke kana semakin kuat, sedangkan dalam satu golongan dari atas ke bawah semakin lemah. Begitu seterusnya untuk sifat sistem periodik yang lain
4 Komentar »
TIPS MENGHAFAL GOLONGAN IA, IIA, IIIA, IVA, VA, VIA, VIIA, DAN VIIIA DALAM SISTEM PERIODIK MODERN
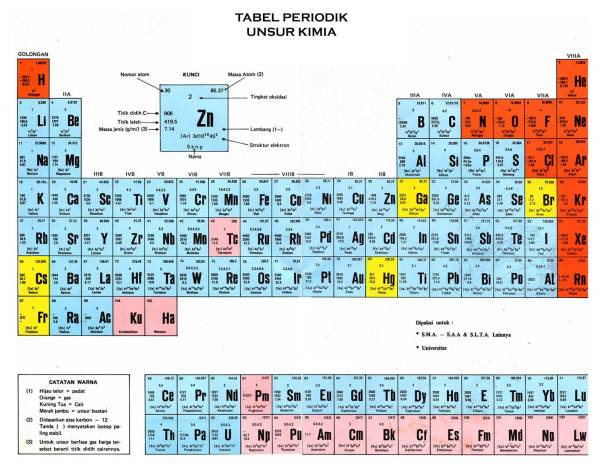
Golongan IA : Li-Na-K-Rb-Cs-Fr
Tips menghafal : LiNa Kawin Rubi Cs Frustasi
Golongan IIA : Be-Mg-Ca-Sr-Ba-Ra
Tips menghafal : Beli Mangga Cari Sirsak Bawa Rambutan
Golongan IIIA : B-Al-Ga-In-Tl
Tips menghafal : Bang Ali Gandeng Iin di Televisi
Golongan IVA : C-Si-Ge-Sn-Pb
Tips menghafal : CeSi Genit Senang Plembungan
Golongan VA : N-P-As-Sb-Bi
Tips menghafal : Nining Punya Asisten Serba Bisa
Golongan VIA : O-S-Se-Te-Po
Tips menghafal : Orang Sekarang Senang TelePon
Golongan VIIA : F-Cl-Br-I-At
Tips menghafal : Festival Celana Baru Itu Antik
Golongan VIIIA : He-Ne-Ar-Kr-Xe-Rn
Tips menghafal : Heboh Negara Arab Karena Xerangan Radon
Perkembangan Sistem Periodik Unsur
1. Hukum TriadeUnsur-unsur yang mempunyai sifat yang sama disusun berdasarkan massa atomnya dalam suatu triade yaitu setiap kelompok terdiri dari tiga unsur. Unsur yang ditengah mempunyai massa atom rata-rata dari jumlah massa atom kedua unsur yang mengapitnya dan sifatnya diantara keduanya
Contoh:

Kelemahannya: banyak unsur yang mempunyai sifat mirip tetapi jumlahnya lebih dari tiga.
2. Hukum Oktaf
 Pengelompokkan
unsur-unsur berdasarkan massa atom.Unsur-unsur disusun dalam kelompok
berisi tujuh unsur. Sifat-sifat unsur akan berulang pada unsur kedelapan
(oktaf). Dengan demikian, unsur ke-8 akan mempunyai sifat yang sama
dengan unsur ke-1.
Pengelompokkan
unsur-unsur berdasarkan massa atom.Unsur-unsur disusun dalam kelompok
berisi tujuh unsur. Sifat-sifat unsur akan berulang pada unsur kedelapan
(oktaf). Dengan demikian, unsur ke-8 akan mempunyai sifat yang sama
dengan unsur ke-1.Contoh:

Kelemahan: tidak berlaku untuk unsur-unsur bernomor massa relative besar, misalnya Cr tidak mirip dengan Al; Mn tidak mirip dengan P; Fe tidak mirip dengan S.
3. Susunan Berkala Mendeleev dan Meyer
Unsur-unsur disusun dalam suatu tabel berdasarkan sifat-sifatnya yang merupakan fungsi dari massa atom relative.
Unsur dengan sifat-sifat yang sama diletakkan dalam satu kolom dari atas ke bawah (Meyer berdasarkan sifat fisika sedangkan Mendeleev berdasarkan sifat kimia dan fisika).
Terdapat 8 golongan (kolom vertical) dan 7 perioda ( baris horizontal)
Mendeleev dapat meramalkan sifat unsur yang belum ditemukan yang akan mengisi tempat yang kosong dalam tabel
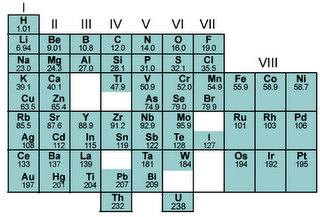
Kelemahan susunan berkala Mendeleev: beberapa urutan unsur terbalik jika ditinjau dari bertambahnya massa atom.
4. Sistem Periodik Modern
Disusun berdasarkan konfigurasi electron dari atom unsur-unsur. Sistem periodic modern disusun menjadi suatu baris-baris (dari kiri ke kanan) dan kolom-kolom (dari atas kebawah). Baris disebut perioda, sedangkan kolom disebut golongan.
Setiap perioda memiliki nomor masing-masing dimulai dari 1-7. Golongan memiliki nomor 1-8 dengan ditambahkan A dan B.
Tips Menghafal golongan IA, IIA, IIIA, IVA, VA, VIA, VIIA, dan VIIIA:
Golongan IA : Li-Na-K-Rb-Cs-Fr
Tips menghafal : LiNa Kawin Rubi Cs Frustasi
Golongan IIA : Be-Mg-Ca-Sr-Ba-Ra
Tips menghafal : Beli Mangga Cari Sirsak Bawa Rambutan
Golongan IIIA : B-Al-Ga-In-Tl
Tips menghafal : Bang Ali Gandeng Iin di Televisi
Golongan IVA : C-Si-Ge-Sn-Pb
Tips menghafal : CeSi Genit Senang Plembungan
Golongan VA : N-P-As-Sb-Bi
Tips menghafal : Nining Punya Asisten Serba Bisa
Golongan VIA : O-S-Se-Te-Po
Tips menghafal : Orang Sekarang Senang TelePon
Golongan VIIA : F-Cl-Br-I-At
Tips menghafal : Festival Celana Baru Itu Antik
Golongan VIIIA : He-Ne-Ar-Kr-Xe-Rn
Tips menghafal : Heboh Negara Arab Karena Xerangan Radon









No comments:
Post a Comment