Thursday, August 1, 2013
SOAL LATIHAN SIFAT KOLIGATIF LARUTAN
OJO DUMEH: SOAL LATIHAN SIFAT KOLIGATIF LARUTAN: Pilihan ganda Latihan Soal Sifat Koligatif Larutan 33 butir. 8 uraian Latihan Contoh Soal Sifat Koligatif Larutan A. Pilihlah salah satu j...
Sunday, June 2, 2013
1
PEMBAHASAN SOAL KIMIA
SELEKSI KOMPETISI SAINS MADRASAH (KSM) TINGKAT KAB/KOTA 2013
Oleh Urip Kalteng (http://urip.wordpress.com)
1. Gas mulia xenon ditemukan pertama kali tahun 1962, gas tersebut dapat bersenyawa dengan platina dan fluor. Jika suatu senyawa tersebut terdiri dari 30% Xe, 44% Pt, dan 26% F, maka rumus empiris senyawa tersebut:
A. XePtF
B. XePtF4
C. XePtF5
D. XePtF6
E. XePtF8
Penyelesaian:
Anggap senyawa tersebut 100 gram, sehingga massa:
Xe = 30 g; Pt = 44 g; F = 26 g
Perbandingan mol (massa/massa molar) setiap unsur dalam senyawa:
Xe
Pt
F
Massa : Massa molar
30 : 131,2
44 : 195
26 : 19
Mol Unsur
0,2287
0,2256
1,2684
Bagi dgn angka mol terkecil
0,2287 : 0,2256
0,2256 : 0,2256
1,2684 : 0,2256
Perbandingan
1,0137
1,0000
5,6223
Pembulatan perbandingan
1
1
6
Massa molar setiap unsur tersedia pada tabel periodik yang disediakan.
Jadi rumus kimia senyawa tersebut adalah XePtF6 alternatif D.
2. Sebanyak 156,0 g sampel unsur X dicampur dengan silikon, membentuk 268,3 g senyawa X3Si4 murni. Massa atom X adalah
A. 48
B. 52
C. 55
D. 57
E. 59
Penyelesaian:
Reaksi yang mungkin: 3X + 4Si X3Si4
156,0 g
(268,3 – 156,0) g
268,3 g
156,0 g
112,3 g
268,3 g
Mol
Mol X
112,3 : 28,09 = 4,00 mol
Mol X3Si4
Berdasar perbandingan koefisien reaksi
3 mol
4 mol
1 mol
Karena yang tersedia unsur X sebesar 156,0 g dan ini setara dengan 3 mol maka massa molar unsur X adalah 156,0 g : 3 mol = 52 g/mol (Alternatif B)
2
3. Senyawa LXO3 sebanyak 4,9020 gram dalam keadaan kering dan murni dipanaskan membentuk 1,9200 gram gas oksigen dan padatan LX sebanyak 2,980 gram. Jika padatan LX ditambahkan AgNO3 terjadi reaksi sempurna membentuk AgX sebanyak 5,7380 gram. Massa atom relatif L dan X adalah....
A. L = 39,10 dan X = 70,90
B. L = 39,10 dan X = 35,45
C. L = 22,99 dan X = 70,90
D. L = 22,99 dan X = 35,45
E. L = 39,10 dan X = 79,90
Penyelesaian:
Reaksi yang mungkin: 2LXO3 2LX + 3O2
Massa
4,9020 g
2,9800 g
1,9200 g
Mol
Mol LXO3
Mol LX
1,92 : 32
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
0,06 mol
Jika 2,98 g LX = 0,04 mol, maka massa molar LX = 2,98 g : 0,04 mol = 74,5 g/mol
Reaksi sempurna AgNO3 + LX AgX + LNO3 AgNO3 + LX AgX + LNO3
Massa
2,9800 g
5,7380 g
Mol
0,04 mol
Mol AgX
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
Massa molar AgX = 5,7380 g : 0,04 mol = 143,45 g/mol
Jadi massa molar X = massa molar AgX – massa molar Ag
= 143,45 g/mol – 108 g/mol
= 35,45 g/mol
Massa molar L = massa molar LX – massa molar X
= 74,5 g/mol – 35,45 g/mol
= 39,05 g/mol
Massa molar di sini dianggap sama dengan massa atom relatif jadi jawaban yang mendekati adalah B. L = 39,10 dan X = 35,45
4. Suatu sel elektrokimia disusun dengan menggunakan elektroda Cu dalam larutan Cu(II) dan elektroda Ni dalam larutan Ni(II) sedemikian rupa sehingga reaksi redoks terjadi secara spontan. Diketahui: E0 Cu2+ | Cu = +0,34 V dan E0 Ni2+|Ni = –0,25 V. Jika konsentrasi ion Cu(II) ditingkatan pada suhu tetap, maka pengaruhnya terhadap Esel sel elektrokimia tersebut adalah...
A. Tidak ada perubahan pada nilai Esel
B. Tidak cukup informasi untuk menentukan perubahan nilai Esel
C. Nilai Esel meningkat
D. Nilai Esel berkurang
E. Nilai Esel = 0 V
Penyelesaian:
Karena reaksi berlangsung secara spontan maka E0 harus bernilai + :
Anoda (oksidasi) : Ni Ni2++ 2e- E0 = +0,25 V
Katoda (reduksi) : Cu2+ + 2e- Cu E0 = +0,34 V
Reaksi Redoks : Ni + Cu2+ Ni2++ Cu E0 = + 0,59 V
Terkait dengan peingkatan konsentrasi Cu2+ maka dapat digunakan Persamaan Nernst
3
x Oksidasi + n e- y Reduksi [ ] [ ]
Jika yang ditingkatkan adalah konsentrasi zat yang ter-reduksi maka nilai log dari persamaan itu akan semakin kecil, dengan semakin kecilnya nilai log maka faktor pengurangnya juga semakin kecil artinya E akan semakin besar (meningkat). Bahkan ketika hasil log-nya negatif maka hasilnya E-nya akan lebih meningkat lagi.
5. Suatu sel elektrokimia dirangkai sebagaimana gambar di bawah ini.
Di antara pernyataan berikut yang tepat mengenai perubahan yang terjadi pada anoda dan katoda ketika sel tersebut dioperasikan adalah... Setengah sel oksidasi Setengah sel reduksi
A.
Massa elektroda bertambah
Massa elektroda berkurang
B.
[HO3+] bertambah
Massa elektroda bertambah
C.
[HO3+] bertambah
Massa elektroda berkurang
D.
[HO3+] berkurang
Massa elektroda bertambah
E.
[HO3+] berkurang
Massa elektroda berkurang
Penyelesaian:
Pada anoda (Pt~inert) terjadi reaksi oksidasi : H2 +2H2O 2H3O+ + 2e-
Pada katoda (Cu) terjadi reduksi : Cu2+ + 2e- Cu(s)
Jadi pada setengah sel oksidasi jumlah [HO3+] bertambah dan massa elektroda (Cu) bertambah
6. Elektolisis umum digunakan untuk mendapatkan logarn murni dari ion-ionnya. Suatu percobaan dilakukan dengan memberikan arus sebesar 3 A selama 2 jam terhadap larutan ion logam X yang bermuatan +2. Di akhir percobaan, didapatkan logam X sebanyak 7,1l g. Logam X tersebut adalah
A. Ba
B. Ni
C. Sr
D. Cu
E. Mn
Penyelesaian:
Dari soal diketahui massa endapan (w) = 7,11 g; i = 3 A; t = (2 x 60 x 60 )detik
W = (e . i . t):96500
7,11 g = (e x 3 x 2x60x60):96500
e = 31,76 g
Karena logam tersebut bermuatan +2 maka massa molar-nya = 2 x 31,76 = 63,52 g/mol
Berdasarkan data pada tabel periodik unsur yang memiliki massa molar sekitar 63,52 adalah logam Cu. Alternatif D yang benar.
4
7. Persamaan reaksi kimia yang tepat untuk menunjukkan kesetimbangan es dan air pada suhu 0 oC adalah
A. H2O(s) H2O(l) H2O(g)
B. H2O(s) H2(g) + O2(g)
C. H2O(s) H2O(l)
D. H2O(s) + energi H2O(l)
E. H2O(s) H2O(l) H2(g) + O2(g)
Penyelesaian:
Persamaan reaksi kimia yang tepat adalah H2O(s) + energi H2O(l)
Ketika pada suhu 0oC air membeku (es) dan siap berubah mencair, ketika dikenai energi maka ia berubah wujud menjadi air cair.
8. Pada suhu tertentu, dalam wadah bervolume 1 L dimasukkan gas H2 dan gas I2 masing-masing sebanyak 2,0 mol. Pada saat kesetimbangan terdapat 3,5 mol gas HI. Nilai Kc reaksi tersebut sebesar
A. 5,3 × 10–3
B. 8,75 × 10–1
C. 3,06 × 100
D. 5,60 × 101
E. 1,96 × 102
Penyelesaian:
Persamaan reaksi setimbang: H2(g) + I2(g) 2HI (g)
Berdasarkan persamaan tersebut maka:
H2(g) + I2(g) 2HI (g)
Mula-mula :
2 mol
2 mol
-
Reaksi :
– 1,75 mol
– 1,75 mol
+3,5 mol
Setimbang :
0,25 mol
0,25 mol
3,5 mol
Karena volume tetap (1) maka pernyataan konsentrasi bisa digunakan jumlah mol zat saja
Kc = [ ] [ ][ ]
9. Kelarutan molar magnesium hidroksida (Ksp = 8 × 10–12 ) dalam suatu larutan penyangga dengan pH = 11 sebesar....
A. 1,7 × 10–4 M
B. 1,0 × 10–11 M
C. 8,0 ×10–12 M
D. 8,0 ×10–9 M
E. 8,0 × 10–6 M
Penyelesaian:
pH = 11 pOH = 3 [OH–] = 10–3 M
Magnesium hidroksida Mg(OH)2
Ksp = [Mg2+][OH-]2
8 × 10–12= [Mg2+](10–3)2
[Mg2+] = (8 × 10–12) : (10–6) = 8 × 10–6 M
Mg(OH)2 Mg2+ + 2OH-
Karena koefisien Mg(OH)2 = koefisien Mg2+ maka kelarutan Mg(OH)2 = [Mg2+] = 8 × 10–6 M
5
10. I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
Perubahan entalpi standar pembentukan yod triklorida ICl3 adalah
A. 176 kJ/mol
B. 138 kJ/mol
C. –88 kJ/mol
D. –138 kJ/mol
E. –214 kJ/mol
Penyelesaian:
Perubahan entalpi standar pembentukan adalah perubahan entalpi untuk pembentukan setiap 1 mol senyawa dari unsur-unsur-nya.
I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
I2(s) + 3 Cl2(g) 2 ICl3(s) ΔHo = -176 kJ (ini pembentukan ICl3(s) sebanyak 2 mol ~ lihat koefisien ICl3(s) ) Jadi perubahan entalpi standar pembentukan ICl3(s) = –176 kJ : 2 mol = –88 kJ/mol
11. Bila 2,3 g dimetil eter (Mr = 46) dibakar pada tekanan tetap, kalor yang dilepaskan adalah 82,5 kJ. Berdasarkan data ini, kalor pembakaran dimetil eter adalah...
A. –2413 kJ/mol
B. +825 kJ/mol
C. –825 kJ/mol
D. +1650 kJ/mol
E. –1650 kJ/mol
Penyelesaian:
Kalor pembakaran dimetil eter untuk setiap mol-nya dapat dihitung dengan suatu cara sebagai berikut:
2,3 g dimetil eter = 2,3 g : 46 g/mol = 0,05 mol ~ 82,5 kJ,
maka kalor pembakaran per mol-nya = 82,5 kJ : 0,05 mol = 1650 kJ/mol
12. Diketahui persamaan termokimia berikut:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = -1400 kJ
2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H2O(l) ΔHo = -3100 kJ
2 H2(g) + O2(g) 2 H2O(l) ΔHo = -570 kJ
Perubahan entalpi untuk reaksi C2H4(g) + H2(g) C2H6(g) adalah
A. –420 kJ
B. –270 kJ
C. –135 kJ
D. +285 kJ
E. +420 kJ
Penyelesaian:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = –1400 kJ
2 CO2(g) + 3 H2O(l) C2H6(g) +3 ½ O2(g) ΔHo = +1550 kJ
H2(g) + ½ O2(g) H2O(l) ΔHo = –285 kJ
C2H4(g) + H2(g) C2H6(g) ΔH = –135 kJ
13. Diketahui energi ikatan:
C=C = 614 kJ/mol; C–Cl = 328 kJ/mol; C–H = 413 kJ/mol
C–C = 348 kJ/mol; Cl–Cl = 244 kJ/mol
Perubahan entalpi bagi reaksi H2C=CH2(g) + Cl2(g) ClH2C–CH2Cl adalah....
A. –31 kJ
B. –62 kJ
C. –93 kJ
D. –124 kJ
E. –146 kJ
6
Penyelesaian: Energi Ikatan pada Ruas Kiri Energi Ikatan pada Ruas Kanan
4 x C–H = 4 x 413 kJ = 1652 kJ
4 x C–H = 4 x 413 kJ = 1652 kJ
1 x C=C = 1 x 614 kJ = 614 kJ
2 x C–Cl = 2 x 328 kJ = 656 kJ
1 x Cl–Cl = 1 x 244 kJ = 244 kJ
1 x C–C = 348 kJ = 348 kJ Total Energi Ikatan = 2.510 kJ Total energi ikatan = 2.656 kJ
Perubahan entalpi = energi ikatan ruas kiri – energi ikatan ruas kanan
Perubahan entalpi = 2.510 kJ – 2.656 kJ = –146 kJ
14. Nitrogen oksida bereaksi dengan hidrogen pada suhu tinggi menurut persamaan:
2NO(g) + 2H2(g) N2(g) + 2H2O(g)
Jika pada waktu tertentu laju reaksi nitrogen oksida 0,36 mol L–1 s–1, maka laju reaksi gas nitrogen adalah....
A. 0,09 mol L–1 s–1
B. 0,18 mol L–1 s–1
C. 0,36 mol L–1 s–1
D. 0,54mol L–1 s–1
E. 0,72 mol L–1 s–1
Penyelesaian:
Hubungan koefisien reaksi di atas secara stoikiometri dengan laju reaksi dapat dituliskan:
Laju rekasi = – ½ [NO]/t = – ½ [H2]/t = + [N2] /t
Laju reaksi = – ½ [NO] /t = + [N2] /t (ingat tanda plus-minus bukan merupakan nilai)
½ x 0,36 mol L–1 s–1 = + [N2] / t
[N2] / t = 0,18 mol L–1 s–1
15. Pada reaksi: H2O2 + 2I– + H+ 2H2O + I2
Jika konsentrasi H2O2 berubah dari 1,00 M menjadi 0,95 M dalam waktu 100 detik, maka perubahan laju rekasi I– dalam M.detik–1 adalah...
A. 0,500
B. 0,200
C. 0,050
D. 0,010
E. 0,001
Penyelesaian:
Penyelesaian soal ini seperti pada pembahasan soal no 14
Laju rekasi = – [ H2O2]/t = – ½ [ I– ]/t
½ [ I– ]/t = [ H2O2]/t
[ I– ]/t = 2 x (1,00 – 0,95)M : 100 detik
= 2 x 0,0005 M/detik
= 0,001 M/detik
16. Pada reaksi: Cl2(g) + 2NO(g) 2NOCl(g)
Jika konsentrasi kedua pereaksi diperbesar 2 kali, laju reaksi menjadi 8 kali semula. Jika hanya konsentrasi Cl2 yang diperbesar 2 kali, laju reaksi menjadi 2 kali semula. Maka orde reaksi NO adalah
A. 0
B. ½
C. 1
D. 2
E. 3
7
Penyelesaian:
Sebaiknya dibuat permisalan seperti contoh berikut:
Percobaan
[Cl2]
[NO]
Laju
1
x
y
v
2
2x
2y
8v
3
2x
y
2v
Orde reaksi (m) terhadap NO kita gunakan data 2 dan 3
(2y/y)m = (8v/2v) 2 m = 4 m = 2
17. Oksidasi NO menjadi NO2 menurut rekasi 2NO(g) + O2(g) 2NO2(g)
Memberikan data sebagai berikut:
Percobaan
[O2], M
[NO], M
Laju NO2 (M/det)
1
0,001
0,001
7,10
2
0,004
0,001
28,40
3
0,004
0,003
255,6
4
0,002
0,002
X
Nilai X dalam tabel tersebut adalah ...
A. 3,65
B. 14,20
C. 28,40
D. 56,80
E. 85,20
Penyelesaian:
Penentuan orde reaksi:
Orde reaksi terhadap O2 (0,004/0,001)x = (28,40/7,10) 4 x = 4 x = 1
Orde reaksi terhadap NO (0,003/0,001)y = (255,6/28,40) 3 y = 9 y = 2
Penentuan konstanta laju reaksi:
Ambil salah satu data percobaan, misal data 1:
v = k[O2] [NO]2
k = V: ([O2] [NO]2) k = 7,10 : (0,001 x (0,001)2) k = 7,10 x 109
Penentuan laju pada data ke 4:
v = 7,10 x 109 x (0,002)(0,002)2 v = 7,10 x 8 v = 56,80
18. Berdasarkan data titik didih berikut, urutan kekuatan interaksi molekular unsur senyawa-senyawa di bawah ini adalah
Senyawa
Titik didih (oC)
Etanol (C2H5OH)
78,4
Etilen glikol (C2H4(OH)2
197,2
Air, H2O
100,0
Dietil eter, C4H10O
34,5
A. dietil eter < etanolB. air < etanol < etilen glikol < dietil eter
C. dietil eter < etanol < air < etilen glikol
D. etilen glikol < dietil eter < etanol < air
E. etanol < air < dietil eter < etilen glikol
Penyelesaian:
Interaksi molekular dapat ditandai dengan tingginya titik didik suatu senyawa, semakin tinggi titik didih menunjukkan interaksinya semakin kuat. Ketika mendidih maka ia harus mendapatkan energi yang cukup untuk melepaskan kekuatan interaksi yang ia miliki hingga berubah menjadi uap (gas).
Urutan yang benar adalah seperti pada alternatif C. dietil eter < etanol < air < etilen glikol
8
19. Diketahui struktur molekul XCl3 adalah segitiga piramida. Pada sistem periodik, unsur X berada pada golongan
A. 3
B. 5
C. 13
D. 15
E. 17
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh
Struktur molekul yang berbentuk setiga piramida harus memiliki rumus umum AX3E, A atom pusat, 3 pasang elektron berikatan dan sebuah pasangan elektron bebas pada atom pusat. elektron valensi atom pusat berjumlah 5, yaitu 2 (dari pasangan elektron bebas) dan 3 (berasal dari elektron yang digunakan berikatan dengan Cl). Jadi unsur X tersebut terletak pada golongan V-A (elektron valensi 5) atau berada pada golongan 15 pada sistem periodik dengan penggolongan terbaru.
20. Senyawa di bawah ini yang bersifat polar adalah ....
A. NH4+
B. SbCl5
C. I3–
D. ClO2–
E. SnCl4
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh perbedaan keelektronegatifan, semakin besar perbedaan-nya maka senyawa semakin polar. Atau dengan mengamati struktur Lewis-nya atau melihat bentuk molekul-nya. Jika simetris maka bersifat non polar, sebaliknta jika asimetris maka bersifat polar.
NH4+ bentuk molekulnya tetrahedral – non polar
SbCl5 bentuk molekulnya bipiramida trigonal – non polar
I3– bentuk molekulnya linier – non polar
ClO2– bentuk molekulnya bengkok - polar
SnCl4 bentuk molekulnya tetrahedral – non polar
21. Pernyataan berikut berkaitan dengan molekul NH3 dan NF3
(1) NH3 lebih mudah larut dalam air dibandingkan NF3
(2) Hibridisasi atom N pada kedua molekul tersebut adalah sp3
(3) Sudut ikatan pada molekul NH3 ( H–N–H) lebih kecil dibandingkan dengan molekul NF3 ( F–N–F)
(4) Titik didih molekul NH3 lebih kecil dibandingkna dengan NF3
Pernyataan yang benar adalah
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 3 saja
E. 4 saja
Penyelesaian:
Perbandingan beberapa sifat NH3 dengan NF3 :
NH3 lebih mudah larut dalam air dibandingkan NF3, senyawa yang polar akan mudah larut dalam air yang juga bersifat polar, NH3 polar dan akan mudah larut dalam air.
Hibridisasi atom N pada kedua molekul tersebut adalah sp3 (1 pasang elektron bebas, dan 3 pasang elektron berikatan)
Sudut ikatan pada molekul NH3 ( H–N–H) justru lebih besar dibandingkan dengan molekul NF3 ( F–N–F). Pada NH3 elektronegatifitas N lebih besar dibanding H, sementara pada NF3 elektronegatifitas N lebih kecil dibandingkan F. NH3 lebih polar karena terpusatnya pasangan elektron bebas dan ini akan menyebabkan pembesaran sudut ikatan antara N-H, sedang pada NF3 cenderung lebih merata sebaran elektronnya. ( H–N–H = 107o, F–N–F = 102o)
9
Titik didih molekul NH3 lebih besar dibandingkan dengan NF3, ini dapat dikaitkan dengan polaritas antara kedua senyawa bahwa NH3 lebih polar dibanding NF3 senyawa polar akan memiliki titik didih yang lebih tinggi yang juga terkait adanya ikatan hidrogen pada senyawa NH3.
22. Kelarutan PbCl2 dalam larutan HCl lebih besar karena
A. Efek ion senama
B. PbCl2 lebih mudah terionisasi dalam suasana asam
C. Pembentukan senyawa kompleks [PbCl4]2–
D. PbCl2 bersifat basa
E. HCl lebih polar dibandingkan air
Penyelesaian:
Ketika PbCl2 dilarutkan dalam HCl (artinya HCl ini berlebih) maka kelarutan PbCl2 akan meningkat kelebihan ion klorida (Cl–) ini akan bereaksi dengan ion Pb2+ membentuk ion kompleks [PbCl4] 2–yang stabil seperti reaksi berikut: PbCl2 Pb2+ + 2Cl– Pb2+ + 4Cl– [PbCl4] 2–
23. Diketahui Ksp AgI = 8,3 × 10–17 dan Ksp PbI2 = 7,9 × 10–9 . Konsentrasi I- minimum yang diperlukan untuk mengendapkan ion Ag+ dalam suatu larutan yang mengandung campuran ion Ag+ (0,1 M) dan Pb2+ (0,1 M) adalah
A. 8,30 × 10–16
B. 9,11 × 10–9
C. 7,90 × 10–8
D. 2,80 × 10–4
E. 1,99 × 10–3
Penyelesaian:
AgI Ag+ + I-
0,1 M [I-]
Ksp AgI = [Ag+][I-]
8,3 × 10–17 = [0,1][I-],
[I-] = 8,3 × 10–17 : 0,1
[I-] = 8,3 × 10–16 M
PbI2 Pb2+ + 2I-
0,1 M [I-]
Ksp PbI2 = [Pb+2] [I-]2
7,9 × 10–9 = [0,1] [ I-]2
[ I-]2 = 7,9 × 10–8
[ I-] = √(7,9) × 10–4 M
Karena yang ditanyakan adalah konsentrasi ion I- minimum maka jawaban yang tepat adalah [I-] = 8,3 × 10–16 M
24. Diketahui Kb NH3 = 1,8 × 10–5 dan Ka HC2H3O2 = 1,8 × 10–5. Nilai pH dari larutan amonium asetat, NH4C2H3O2 0,065 M adalah
A. 1,19
B. 2,96
C. 7,00
D. 11,06
E. 12,81
Penyelesaian:
Ketika garam yang terbentuk dari asam lemah dan basa lemah yang memiliki Ka = Kb maka berapapun konsentrasi garam itu pH-nya dianggap netral = 7
25. Suatu larutan buffer sebanyak 1 L mengandung campuran 0,14 M HC2H3O2 dan 0,27 M C2H3O2–. Diketahui Ka HC2H3O2 = 1,8 × 10–5 . Nilai pH larutan buffer tersebut setelah ditambah 0,025 mol HCl adalah
A. 0,85
B. 1,15
C. 4,92
D. 5,03
E. 6,47
10
Penyelesaian:
Larutan buffer ditambah sedikit asam kuat maka akan terjadi peningkatan jumlah mol asam dan pengurangan jumlah konjugat (karena konjugatnya bereaksi dengan H+ membentuk asam tadi).
HC2H3O2 = CH3COOH, C2H3O2– = CH3COO-
1 L CH3COOH 0,14 M = 0,14 mol
1 L CH3COO- 0,27 M = 0,27 mol
HCl = 0,025 mol =
Ka CH3COOH = 1,8 × 10–5 pKa = 5 – log 1,8
CH3COOH H+ + CH3COO-
Mula-mula :
0,14 mol
0,27 mol
Perubahan :
+ 0,025 mol
– 0,025 mol
Akhir :
0,165 mol
?
0,255 mol
pH = pKa + log (0,255/0,165)
pH = 5 – log 1,8 + log 1,545
pH = 5 – 0,26 + 0,19 = 4,93
26. Dalam perkembangan teori atom tercatat beberapa hal berikut:
(1) Percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom
(3) Data-data eksperimen selain atom hidrogen diperoleh dari hasil percobaan Bohr
Pernyataan yang benar adalah....
A. 1, 2, dan 3
B. 1 dan 2
C. 2 dan 3
D. 1 saja
E. 3 saja
Penyelesaian:
(1) Benar bahwa percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom dengan melakukan penembakan menggunakan sinar alfa pada lempeng tipis emas, ternyata sebagian ada yang dibelokkan (yang mengenai inti atom).
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom hidrogen beserta spektrumnya.
(3) Data-data eksperimen hanya atom hidrogen diperoleh dari hasil percobaan Bohr
27. Berdasarkan letaknya dalam sistem periodik, muatan, dan jumlah elektronnya, maka urutan ukuran atom/ion isoelektronik di bawah ini adalah
A. Ca2+ > K+ > Ar > Cl– > S2–
B. S2– > Cl– > Ar > K+ > Ca2+
C. S2– > Ca2+ > Cl– > K+ > Ar
D. Cl– > S2– > Ca2+ > K+ > Ar
E. Ca2+ > S2– > K+ > Ar > Cl–
Penyelesaian:
Sesuai data pada tabel periodik unsur diketahui bahwa:
S nomor atom 16
Cl nomor atom 17
Ar nomor atom 18
K nomor atom 19
Ca nomor atom 20
Ukuran atom/ion isoeletronik (memiliki jumlah elektron sama dalam hal ini semua punya 18 elektron) semakin kecil jika jumlah proton (= nomor atom) semakin besar.
Dengan demikian urutan yang benar adalah S2– > Cl– > Ar > K+ > Ca2+ sesuai dengan alternatif B
11
28. Pasangan unsur yang mempunyai ukuran/volume atom yang hampir sama adalah
A. K, Ca
B. Ti, Zr
C. K, Rb
D. Ne, Kr
E. HF , Zr
Penyelesaian:
Dapat disimak dalam tabel periodik unsur, bahwa unsur yang terletak dalam satu periode akan memiliki ukuran volume yang hampir sama, terutama yang memang golongannya berdekatan. Dalam hal ini pasangan yang punya volume atom yang hampir sama adalah K dan Ca terletak pada periode ke 3 (K golongan IA (golongan 1), Ca golongan IIA(golongan 2)).
29. Suatu senyawa murni terdiri dari C, H, N, O, S, dan Fe. Jumlah atom Fe dalam senyawa tersebut adalah satu. Kadar Fe dalam senyawa tersebut 8,09% (w/w). Massa molekul relatif senyawa tersebut adalah ....
A. 56
B. 346
C. 453
D. 692
E. 785
Penyelesaian:
Ar Fe = 56 massa molar Fe = 56 g/mol
% Fe = massa molar Fe : massa molar senyawa (Mr)
8,09% = 56 : Mr Senyawa
0,0809 = 56 : Mr Senyawa
Mr Senyawa = 56 : 0,0808 = 692,21 ~ 692
30. Perhatikan pernyataan berikut:
(1) Titik didih/leleh unsur golongan non logam dari bawah ke atas makin besar sebab kekuatan ikatan van des Waals yang terjadi makin kuat
(2) Semua senyawa logam memiliki kecenderungan untuk membentuk ion kompleks
(3) Keelektronegatifan unsur golongan logam dari atas ke bawah makin kecil
Pernyataan di atas benar, kecuali:
A. 1, 2, 3
B. 1, 2
C. 2, 3
D. 1 saja
E. 3 saja
Penyelesaian:
Cukup jelas, titik didih unsur golongan non logam dari bawah ke atas semakin kecil dan tidak semua senyawaan logam dapat membentuk ion kompleks.
31. Sifat-sifat berikut yang bukan sifat koloid adalah
A. Dapat mengalami koagulasi
B. Menunjukkan efek Tyndall
C. Jika mengadsorbsi ion, dapat dipisahkan dengan elektroforesis
D. Terdiri dari satu fasa
E. Menunjukkan gerak Brown
Penyelesaian:
Sifat koloid salah satunya adalah memiliki dua fasa (bukan satu fasa), yaitu fasa terdispersi dan medium pendispersi.
12
32. Senyawa yang dapat digunakan sebagai penstabil emulsi adalah
A. ZnS2
B. Natrium oleat
C. HCl
D. Na2S2O3
E. Natrium asetat
Penyelesaian:
Senyawa yang dapat digunakan sebagai penstabil emulsi antara lain natrium oleat,
33. Di antara unsur-unsur di bawah ini yang mempunyai afinitas elektron terbesar adalah
A. Be
B. B
C. C
D. N
E. Ne
Penyelesaian:
Unsur-unsur yang di sajikan pada alternatif jawaban adalah unsur yang terletak dalam satu periode. Dalam satu periode dari kiri ke kana afinitasnya semakin besar. Ne terletak paling kanan dalam tabel periodik unsur. Jadi Ne-lah yang mempunyai afinitas elektron terbesar.
34. Dalam suasana basa, logam kobalt (Co) dapat mengalami reaksi oksidasi menjadi Co(OH)3 sementara natrium hipoklorit, NaOCl, dapat dioksidasi menjadi NaCl. Apabila reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCl yaitu:
A. 2 dan 3
B. 1 dan 3
C. 3 dan 2
D. 1 dan 2
E. 3 dan 1
Penyelesaian:
Reaksi Oksidasi : Co Co3+ + 3e- |x2
Reaksi Reduksi : H2O + OCl- + 2e- Cl- + 2OH- |x3
Reaksi redoks : 2Co + 3H2O + 3OCl- 2Co3+ + 3Cl- + 6OH-
Reaksi lengkapnya: 2Co + 3H2O + 3NaOCl 2 Co(OH)3 + 3NaCl
Jadi koefisien reaksi kobalt = 2, dan koefisien reaksi NaOCl = 3
35. Hidrogensulfat atau ion bisulfat, HSO4- dapat bertindak sebagai asam atau basa di dalam air. Di antara persamaan reaksi berikut, ion HSO4- yang bertindak sebagai asam adalah dalam reaksi:
A. HSO4– + H2O H2SO4 + OH-
B. HSO4– + H3O+ SO3 + 2H2O
C. HSO4– + OH- H2SO4 + O2-
D. HSO4– + H2O SO42– + H3O+
E. HSO4– + H3O+ H2SO4 + H2O
Penyelesaian:
Jika suatu spesi mampu melepaskan proton (ion H+) maka ia dikatakan bertindak sebagai basa, sementar itu H2O akan bertindak sebagai basa yang ditandai dengan diterima-nya ion H+ dari ion HSO4- membentuk H3O+. Jadi reaksi pada alternatif D yang menunjukkan HSO4- bertindak sebagai asam.
13
36. Larutan 0,2 M natrium klorobenzoat (NaC7H4ClO2) memiliki pH 8,65. Nilai pH larutan 0,2 M asam klorobenzoat (HC7H4ClO2) adalah
A. 5,35
B. 8,65
C. 2,35......? pH = 2,65
D. 3,45
E. 3,25
Penyelesaian:
Natrium klorobenzoat adalah garam yang berasal dari basa kuat dengan asam lemah, sehingga ia bersifat basa (pH > 7)
Untuk dapat menghitung pH asam klorobenzoat harus diketahui Ka asam tersebut, Ka ini dapat dihitung dari hitungan garam-nya.
pH = 8,65 pOH = 14 – 8,65 = 5,35 [OH-] = 10–5,35 M [ ][ ]
[H+] = √ = 10–2,65 pH = 2,65
Dari alternatif jawaban tidak tersedia.
37. Warfarin digunakan sebagai racun tikus. Jumlah pusat kiral yang terdapat dalam molekul warfarin di bawah ini adalah
A. 0
B. 1
C. 2
D. 3
E. 4
Penyelesaian:
Atom C kiral (pusat kiral) adalah atom C yang mengikat 4 gugus berbeda-beda, pada molekul warfarin terdapat 1atom C kiral yang ditunjukkan pada lingkar merah gambar berikut ini:
Setiap ujung ikatan dan setiap sudut menunjukkan
adanya atom C, atom H tidak ditampilkan, setiap
atom C memiliki 4 ikatan, kalau tidak tampak
sebanyak 4 ikatan artinya ada satu ikatan C dengan
atom H.
38. Di antara pasangan senyawa di bawah ini, yang memiliki titik didih yang identik adalah
A. CH3CH2CH2CH2OH dan (CH3)2CHCH2OH
B. CH3(CH2)4CH3 dan (CH3)2CHCH(CH3)2
C.
D.
E.
14
Penyelesaian:
Senyawa dengan rumus struktur sama dan rumus molekul yang sama akan memiliki titik didih yang identik. Pada alternatif D rumus molekul dan rumus strukturnya sama, hanya letak gugus Cl ada yang ke arah belakang bidang datar dan ke arah depan bidang datar.
39. Berikut ini adalah struktur vitamin C (asam askorbat):
Pernyataan yang tepat mengenai jumlah atom karbon kiral dan konfigurasi absolut atom C kiral yang terdapat pada cincin adalah
A. 1 dan R
B. 2 dan R
C. 1 dan S
D. 2 dan S
E. 3 dan R
Penyelesaian:
40. Jumlah isomer, termasuk isomer geometrinya yang dimiliki senyawa C3H4Cl2 adalah
A. 3
B. 4
C. 5
D. 6
E. 7
Penyelesaian:
Tidak tersedia jawaban......!
PEMBAHASAN SOAL KIMIA
SELEKSI KOMPETISI SAINS MADRASAH (KSM) TINGKAT KAB/KOTA 2013
Oleh Urip Kalteng (http://urip.wordpress.com)
1. Gas mulia xenon ditemukan pertama kali tahun 1962, gas tersebut dapat bersenyawa dengan platina dan fluor. Jika suatu senyawa tersebut terdiri dari 30% Xe, 44% Pt, dan 26% F, maka rumus empiris senyawa tersebut:
A. XePtF
B. XePtF4
C. XePtF5
D. XePtF6
E. XePtF8
Penyelesaian:
Anggap senyawa tersebut 100 gram, sehingga massa:
Xe = 30 g; Pt = 44 g; F = 26 g
Perbandingan mol (massa/massa molar) setiap unsur dalam senyawa:
Xe
Pt
F
Massa : Massa molar
30 : 131,2
44 : 195
26 : 19
Mol Unsur
0,2287
0,2256
1,2684
Bagi dgn angka mol terkecil
0,2287 : 0,2256
0,2256 : 0,2256
1,2684 : 0,2256
Perbandingan
1,0137
1,0000
5,6223
Pembulatan perbandingan
1
1
6
Massa molar setiap unsur tersedia pada tabel periodik yang disediakan.
Jadi rumus kimia senyawa tersebut adalah XePtF6 alternatif D.
2. Sebanyak 156,0 g sampel unsur X dicampur dengan silikon, membentuk 268,3 g senyawa X3Si4 murni. Massa atom X adalah
A. 48
B. 52
C. 55
D. 57
E. 59
Penyelesaian:
Reaksi yang mungkin: 3X + 4Si X3Si4
156,0 g
(268,3 – 156,0) g
268,3 g
156,0 g
112,3 g
268,3 g
Mol
Mol X
112,3 : 28,09 = 4,00 mol
Mol X3Si4
Berdasar perbandingan koefisien reaksi
3 mol
4 mol
1 mol
Karena yang tersedia unsur X sebesar 156,0 g dan ini setara dengan 3 mol maka massa molar unsur X adalah 156,0 g : 3 mol = 52 g/mol (Alternatif B)
2
3. Senyawa LXO3 sebanyak 4,9020 gram dalam keadaan kering dan murni dipanaskan membentuk 1,9200 gram gas oksigen dan padatan LX sebanyak 2,980 gram. Jika padatan LX ditambahkan AgNO3 terjadi reaksi sempurna membentuk AgX sebanyak 5,7380 gram. Massa atom relatif L dan X adalah....
A. L = 39,10 dan X = 70,90
B. L = 39,10 dan X = 35,45
C. L = 22,99 dan X = 70,90
D. L = 22,99 dan X = 35,45
E. L = 39,10 dan X = 79,90
Penyelesaian:
Reaksi yang mungkin: 2LXO3 2LX + 3O2
Massa
4,9020 g
2,9800 g
1,9200 g
Mol
Mol LXO3
Mol LX
1,92 : 32
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
0,06 mol
Jika 2,98 g LX = 0,04 mol, maka massa molar LX = 2,98 g : 0,04 mol = 74,5 g/mol
Reaksi sempurna AgNO3 + LX AgX + LNO3 AgNO3 + LX AgX + LNO3
Massa
2,9800 g
5,7380 g
Mol
0,04 mol
Mol AgX
Berdasar perbandingan koefisien reaksi
0,04 mol
0,04 mol
Massa molar AgX = 5,7380 g : 0,04 mol = 143,45 g/mol
Jadi massa molar X = massa molar AgX – massa molar Ag
= 143,45 g/mol – 108 g/mol
= 35,45 g/mol
Massa molar L = massa molar LX – massa molar X
= 74,5 g/mol – 35,45 g/mol
= 39,05 g/mol
Massa molar di sini dianggap sama dengan massa atom relatif jadi jawaban yang mendekati adalah B. L = 39,10 dan X = 35,45
4. Suatu sel elektrokimia disusun dengan menggunakan elektroda Cu dalam larutan Cu(II) dan elektroda Ni dalam larutan Ni(II) sedemikian rupa sehingga reaksi redoks terjadi secara spontan. Diketahui: E0 Cu2+ | Cu = +0,34 V dan E0 Ni2+|Ni = –0,25 V. Jika konsentrasi ion Cu(II) ditingkatan pada suhu tetap, maka pengaruhnya terhadap Esel sel elektrokimia tersebut adalah...
A. Tidak ada perubahan pada nilai Esel
B. Tidak cukup informasi untuk menentukan perubahan nilai Esel
C. Nilai Esel meningkat
D. Nilai Esel berkurang
E. Nilai Esel = 0 V
Penyelesaian:
Karena reaksi berlangsung secara spontan maka E0 harus bernilai + :
Anoda (oksidasi) : Ni Ni2++ 2e- E0 = +0,25 V
Katoda (reduksi) : Cu2+ + 2e- Cu E0 = +0,34 V
Reaksi Redoks : Ni + Cu2+ Ni2++ Cu E0 = + 0,59 V
Terkait dengan peingkatan konsentrasi Cu2+ maka dapat digunakan Persamaan Nernst
3
x Oksidasi + n e- y Reduksi [ ] [ ]
Jika yang ditingkatkan adalah konsentrasi zat yang ter-reduksi maka nilai log dari persamaan itu akan semakin kecil, dengan semakin kecilnya nilai log maka faktor pengurangnya juga semakin kecil artinya E akan semakin besar (meningkat). Bahkan ketika hasil log-nya negatif maka hasilnya E-nya akan lebih meningkat lagi.
5. Suatu sel elektrokimia dirangkai sebagaimana gambar di bawah ini.
Di antara pernyataan berikut yang tepat mengenai perubahan yang terjadi pada anoda dan katoda ketika sel tersebut dioperasikan adalah... Setengah sel oksidasi Setengah sel reduksi
A.
Massa elektroda bertambah
Massa elektroda berkurang
B.
[HO3+] bertambah
Massa elektroda bertambah
C.
[HO3+] bertambah
Massa elektroda berkurang
D.
[HO3+] berkurang
Massa elektroda bertambah
E.
[HO3+] berkurang
Massa elektroda berkurang
Penyelesaian:
Pada anoda (Pt~inert) terjadi reaksi oksidasi : H2 +2H2O 2H3O+ + 2e-
Pada katoda (Cu) terjadi reduksi : Cu2+ + 2e- Cu(s)
Jadi pada setengah sel oksidasi jumlah [HO3+] bertambah dan massa elektroda (Cu) bertambah
6. Elektolisis umum digunakan untuk mendapatkan logarn murni dari ion-ionnya. Suatu percobaan dilakukan dengan memberikan arus sebesar 3 A selama 2 jam terhadap larutan ion logam X yang bermuatan +2. Di akhir percobaan, didapatkan logam X sebanyak 7,1l g. Logam X tersebut adalah
A. Ba
B. Ni
C. Sr
D. Cu
E. Mn
Penyelesaian:
Dari soal diketahui massa endapan (w) = 7,11 g; i = 3 A; t = (2 x 60 x 60 )detik
W = (e . i . t):96500
7,11 g = (e x 3 x 2x60x60):96500
e = 31,76 g
Karena logam tersebut bermuatan +2 maka massa molar-nya = 2 x 31,76 = 63,52 g/mol
Berdasarkan data pada tabel periodik unsur yang memiliki massa molar sekitar 63,52 adalah logam Cu. Alternatif D yang benar.
4
7. Persamaan reaksi kimia yang tepat untuk menunjukkan kesetimbangan es dan air pada suhu 0 oC adalah
A. H2O(s) H2O(l) H2O(g)
B. H2O(s) H2(g) + O2(g)
C. H2O(s) H2O(l)
D. H2O(s) + energi H2O(l)
E. H2O(s) H2O(l) H2(g) + O2(g)
Penyelesaian:
Persamaan reaksi kimia yang tepat adalah H2O(s) + energi H2O(l)
Ketika pada suhu 0oC air membeku (es) dan siap berubah mencair, ketika dikenai energi maka ia berubah wujud menjadi air cair.
8. Pada suhu tertentu, dalam wadah bervolume 1 L dimasukkan gas H2 dan gas I2 masing-masing sebanyak 2,0 mol. Pada saat kesetimbangan terdapat 3,5 mol gas HI. Nilai Kc reaksi tersebut sebesar
A. 5,3 × 10–3
B. 8,75 × 10–1
C. 3,06 × 100
D. 5,60 × 101
E. 1,96 × 102
Penyelesaian:
Persamaan reaksi setimbang: H2(g) + I2(g) 2HI (g)
Berdasarkan persamaan tersebut maka:
H2(g) + I2(g) 2HI (g)
Mula-mula :
2 mol
2 mol
-
Reaksi :
– 1,75 mol
– 1,75 mol
+3,5 mol
Setimbang :
0,25 mol
0,25 mol
3,5 mol
Karena volume tetap (1) maka pernyataan konsentrasi bisa digunakan jumlah mol zat saja
Kc = [ ] [ ][ ]
9. Kelarutan molar magnesium hidroksida (Ksp = 8 × 10–12 ) dalam suatu larutan penyangga dengan pH = 11 sebesar....
A. 1,7 × 10–4 M
B. 1,0 × 10–11 M
C. 8,0 ×10–12 M
D. 8,0 ×10–9 M
E. 8,0 × 10–6 M
Penyelesaian:
pH = 11 pOH = 3 [OH–] = 10–3 M
Magnesium hidroksida Mg(OH)2
Ksp = [Mg2+][OH-]2
8 × 10–12= [Mg2+](10–3)2
[Mg2+] = (8 × 10–12) : (10–6) = 8 × 10–6 M
Mg(OH)2 Mg2+ + 2OH-
Karena koefisien Mg(OH)2 = koefisien Mg2+ maka kelarutan Mg(OH)2 = [Mg2+] = 8 × 10–6 M
5
10. I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
Perubahan entalpi standar pembentukan yod triklorida ICl3 adalah
A. 176 kJ/mol
B. 138 kJ/mol
C. –88 kJ/mol
D. –138 kJ/mol
E. –214 kJ/mol
Penyelesaian:
Perubahan entalpi standar pembentukan adalah perubahan entalpi untuk pembentukan setiap 1 mol senyawa dari unsur-unsur-nya.
I2(g) + 3 Cl2(g) 2 ICl3(s) ΔHo = –214 kJ/mol
I2(s) I2(g) ΔHo = 38 kJ/mol
I2(s) + 3 Cl2(g) 2 ICl3(s) ΔHo = -176 kJ (ini pembentukan ICl3(s) sebanyak 2 mol ~ lihat koefisien ICl3(s) ) Jadi perubahan entalpi standar pembentukan ICl3(s) = –176 kJ : 2 mol = –88 kJ/mol
11. Bila 2,3 g dimetil eter (Mr = 46) dibakar pada tekanan tetap, kalor yang dilepaskan adalah 82,5 kJ. Berdasarkan data ini, kalor pembakaran dimetil eter adalah...
A. –2413 kJ/mol
B. +825 kJ/mol
C. –825 kJ/mol
D. +1650 kJ/mol
E. –1650 kJ/mol
Penyelesaian:
Kalor pembakaran dimetil eter untuk setiap mol-nya dapat dihitung dengan suatu cara sebagai berikut:
2,3 g dimetil eter = 2,3 g : 46 g/mol = 0,05 mol ~ 82,5 kJ,
maka kalor pembakaran per mol-nya = 82,5 kJ : 0,05 mol = 1650 kJ/mol
12. Diketahui persamaan termokimia berikut:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = -1400 kJ
2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H2O(l) ΔHo = -3100 kJ
2 H2(g) + O2(g) 2 H2O(l) ΔHo = -570 kJ
Perubahan entalpi untuk reaksi C2H4(g) + H2(g) C2H6(g) adalah
A. –420 kJ
B. –270 kJ
C. –135 kJ
D. +285 kJ
E. +420 kJ
Penyelesaian:
C2H4(g) + 3 O2(g) 2 CO2(g) + 2 H2O(l) ΔHo = –1400 kJ
2 CO2(g) + 3 H2O(l) C2H6(g) +3 ½ O2(g) ΔHo = +1550 kJ
H2(g) + ½ O2(g) H2O(l) ΔHo = –285 kJ
C2H4(g) + H2(g) C2H6(g) ΔH = –135 kJ
13. Diketahui energi ikatan:
C=C = 614 kJ/mol; C–Cl = 328 kJ/mol; C–H = 413 kJ/mol
C–C = 348 kJ/mol; Cl–Cl = 244 kJ/mol
Perubahan entalpi bagi reaksi H2C=CH2(g) + Cl2(g) ClH2C–CH2Cl adalah....
A. –31 kJ
B. –62 kJ
C. –93 kJ
D. –124 kJ
E. –146 kJ
6
Penyelesaian: Energi Ikatan pada Ruas Kiri Energi Ikatan pada Ruas Kanan
4 x C–H = 4 x 413 kJ = 1652 kJ
4 x C–H = 4 x 413 kJ = 1652 kJ
1 x C=C = 1 x 614 kJ = 614 kJ
2 x C–Cl = 2 x 328 kJ = 656 kJ
1 x Cl–Cl = 1 x 244 kJ = 244 kJ
1 x C–C = 348 kJ = 348 kJ Total Energi Ikatan = 2.510 kJ Total energi ikatan = 2.656 kJ
Perubahan entalpi = energi ikatan ruas kiri – energi ikatan ruas kanan
Perubahan entalpi = 2.510 kJ – 2.656 kJ = –146 kJ
14. Nitrogen oksida bereaksi dengan hidrogen pada suhu tinggi menurut persamaan:
2NO(g) + 2H2(g) N2(g) + 2H2O(g)
Jika pada waktu tertentu laju reaksi nitrogen oksida 0,36 mol L–1 s–1, maka laju reaksi gas nitrogen adalah....
A. 0,09 mol L–1 s–1
B. 0,18 mol L–1 s–1
C. 0,36 mol L–1 s–1
D. 0,54mol L–1 s–1
E. 0,72 mol L–1 s–1
Penyelesaian:
Hubungan koefisien reaksi di atas secara stoikiometri dengan laju reaksi dapat dituliskan:
Laju rekasi = – ½ [NO]/t = – ½ [H2]/t = + [N2] /t
Laju reaksi = – ½ [NO] /t = + [N2] /t (ingat tanda plus-minus bukan merupakan nilai)
½ x 0,36 mol L–1 s–1 = + [N2] / t
[N2] / t = 0,18 mol L–1 s–1
15. Pada reaksi: H2O2 + 2I– + H+ 2H2O + I2
Jika konsentrasi H2O2 berubah dari 1,00 M menjadi 0,95 M dalam waktu 100 detik, maka perubahan laju rekasi I– dalam M.detik–1 adalah...
A. 0,500
B. 0,200
C. 0,050
D. 0,010
E. 0,001
Penyelesaian:
Penyelesaian soal ini seperti pada pembahasan soal no 14
Laju rekasi = – [ H2O2]/t = – ½ [ I– ]/t
½ [ I– ]/t = [ H2O2]/t
[ I– ]/t = 2 x (1,00 – 0,95)M : 100 detik
= 2 x 0,0005 M/detik
= 0,001 M/detik
16. Pada reaksi: Cl2(g) + 2NO(g) 2NOCl(g)
Jika konsentrasi kedua pereaksi diperbesar 2 kali, laju reaksi menjadi 8 kali semula. Jika hanya konsentrasi Cl2 yang diperbesar 2 kali, laju reaksi menjadi 2 kali semula. Maka orde reaksi NO adalah
A. 0
B. ½
C. 1
D. 2
E. 3
7
Penyelesaian:
Sebaiknya dibuat permisalan seperti contoh berikut:
Percobaan
[Cl2]
[NO]
Laju
1
x
y
v
2
2x
2y
8v
3
2x
y
2v
Orde reaksi (m) terhadap NO kita gunakan data 2 dan 3
(2y/y)m = (8v/2v) 2 m = 4 m = 2
17. Oksidasi NO menjadi NO2 menurut rekasi 2NO(g) + O2(g) 2NO2(g)
Memberikan data sebagai berikut:
Percobaan
[O2], M
[NO], M
Laju NO2 (M/det)
1
0,001
0,001
7,10
2
0,004
0,001
28,40
3
0,004
0,003
255,6
4
0,002
0,002
X
Nilai X dalam tabel tersebut adalah ...
A. 3,65
B. 14,20
C. 28,40
D. 56,80
E. 85,20
Penyelesaian:
Penentuan orde reaksi:
Orde reaksi terhadap O2 (0,004/0,001)x = (28,40/7,10) 4 x = 4 x = 1
Orde reaksi terhadap NO (0,003/0,001)y = (255,6/28,40) 3 y = 9 y = 2
Penentuan konstanta laju reaksi:
Ambil salah satu data percobaan, misal data 1:
v = k[O2] [NO]2
k = V: ([O2] [NO]2) k = 7,10 : (0,001 x (0,001)2) k = 7,10 x 109
Penentuan laju pada data ke 4:
v = 7,10 x 109 x (0,002)(0,002)2 v = 7,10 x 8 v = 56,80
18. Berdasarkan data titik didih berikut, urutan kekuatan interaksi molekular unsur senyawa-senyawa di bawah ini adalah
Senyawa
Titik didih (oC)
Etanol (C2H5OH)
78,4
Etilen glikol (C2H4(OH)2
197,2
Air, H2O
100,0
Dietil eter, C4H10O
34,5
A. dietil eter < etanol
C. dietil eter < etanol < air < etilen glikol
D. etilen glikol < dietil eter < etanol < air
E. etanol < air < dietil eter < etilen glikol
Penyelesaian:
Interaksi molekular dapat ditandai dengan tingginya titik didik suatu senyawa, semakin tinggi titik didih menunjukkan interaksinya semakin kuat. Ketika mendidih maka ia harus mendapatkan energi yang cukup untuk melepaskan kekuatan interaksi yang ia miliki hingga berubah menjadi uap (gas).
Urutan yang benar adalah seperti pada alternatif C. dietil eter < etanol < air < etilen glikol
8
19. Diketahui struktur molekul XCl3 adalah segitiga piramida. Pada sistem periodik, unsur X berada pada golongan
A. 3
B. 5
C. 13
D. 15
E. 17
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh
Struktur molekul yang berbentuk setiga piramida harus memiliki rumus umum AX3E, A atom pusat, 3 pasang elektron berikatan dan sebuah pasangan elektron bebas pada atom pusat. elektron valensi atom pusat berjumlah 5, yaitu 2 (dari pasangan elektron bebas) dan 3 (berasal dari elektron yang digunakan berikatan dengan Cl). Jadi unsur X tersebut terletak pada golongan V-A (elektron valensi 5) atau berada pada golongan 15 pada sistem periodik dengan penggolongan terbaru.
20. Senyawa di bawah ini yang bersifat polar adalah ....
A. NH4+
B. SbCl5
C. I3–
D. ClO2–
E. SnCl4
Penyelesaian:
Polaritas senyawa atau ion poliatomik ditentukan oleh perbedaan keelektronegatifan, semakin besar perbedaan-nya maka senyawa semakin polar. Atau dengan mengamati struktur Lewis-nya atau melihat bentuk molekul-nya. Jika simetris maka bersifat non polar, sebaliknta jika asimetris maka bersifat polar.
NH4+ bentuk molekulnya tetrahedral – non polar
SbCl5 bentuk molekulnya bipiramida trigonal – non polar
I3– bentuk molekulnya linier – non polar
ClO2– bentuk molekulnya bengkok - polar
SnCl4 bentuk molekulnya tetrahedral – non polar
21. Pernyataan berikut berkaitan dengan molekul NH3 dan NF3
(1) NH3 lebih mudah larut dalam air dibandingkan NF3
(2) Hibridisasi atom N pada kedua molekul tersebut adalah sp3
(3) Sudut ikatan pada molekul NH3 ( H–N–H) lebih kecil dibandingkan dengan molekul NF3 ( F–N–F)
(4) Titik didih molekul NH3 lebih kecil dibandingkna dengan NF3
Pernyataan yang benar adalah
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 3 saja
E. 4 saja
Penyelesaian:
Perbandingan beberapa sifat NH3 dengan NF3 :
NH3 lebih mudah larut dalam air dibandingkan NF3, senyawa yang polar akan mudah larut dalam air yang juga bersifat polar, NH3 polar dan akan mudah larut dalam air.
Hibridisasi atom N pada kedua molekul tersebut adalah sp3 (1 pasang elektron bebas, dan 3 pasang elektron berikatan)
Sudut ikatan pada molekul NH3 ( H–N–H) justru lebih besar dibandingkan dengan molekul NF3 ( F–N–F). Pada NH3 elektronegatifitas N lebih besar dibanding H, sementara pada NF3 elektronegatifitas N lebih kecil dibandingkan F. NH3 lebih polar karena terpusatnya pasangan elektron bebas dan ini akan menyebabkan pembesaran sudut ikatan antara N-H, sedang pada NF3 cenderung lebih merata sebaran elektronnya. ( H–N–H = 107o, F–N–F = 102o)
9
Titik didih molekul NH3 lebih besar dibandingkan dengan NF3, ini dapat dikaitkan dengan polaritas antara kedua senyawa bahwa NH3 lebih polar dibanding NF3 senyawa polar akan memiliki titik didih yang lebih tinggi yang juga terkait adanya ikatan hidrogen pada senyawa NH3.
22. Kelarutan PbCl2 dalam larutan HCl lebih besar karena
A. Efek ion senama
B. PbCl2 lebih mudah terionisasi dalam suasana asam
C. Pembentukan senyawa kompleks [PbCl4]2–
D. PbCl2 bersifat basa
E. HCl lebih polar dibandingkan air
Penyelesaian:
Ketika PbCl2 dilarutkan dalam HCl (artinya HCl ini berlebih) maka kelarutan PbCl2 akan meningkat kelebihan ion klorida (Cl–) ini akan bereaksi dengan ion Pb2+ membentuk ion kompleks [PbCl4] 2–yang stabil seperti reaksi berikut: PbCl2 Pb2+ + 2Cl– Pb2+ + 4Cl– [PbCl4] 2–
23. Diketahui Ksp AgI = 8,3 × 10–17 dan Ksp PbI2 = 7,9 × 10–9 . Konsentrasi I- minimum yang diperlukan untuk mengendapkan ion Ag+ dalam suatu larutan yang mengandung campuran ion Ag+ (0,1 M) dan Pb2+ (0,1 M) adalah
A. 8,30 × 10–16
B. 9,11 × 10–9
C. 7,90 × 10–8
D. 2,80 × 10–4
E. 1,99 × 10–3
Penyelesaian:
AgI Ag+ + I-
0,1 M [I-]
Ksp AgI = [Ag+][I-]
8,3 × 10–17 = [0,1][I-],
[I-] = 8,3 × 10–17 : 0,1
[I-] = 8,3 × 10–16 M
PbI2 Pb2+ + 2I-
0,1 M [I-]
Ksp PbI2 = [Pb+2] [I-]2
7,9 × 10–9 = [0,1] [ I-]2
[ I-]2 = 7,9 × 10–8
[ I-] = √(7,9) × 10–4 M
Karena yang ditanyakan adalah konsentrasi ion I- minimum maka jawaban yang tepat adalah [I-] = 8,3 × 10–16 M
24. Diketahui Kb NH3 = 1,8 × 10–5 dan Ka HC2H3O2 = 1,8 × 10–5. Nilai pH dari larutan amonium asetat, NH4C2H3O2 0,065 M adalah
A. 1,19
B. 2,96
C. 7,00
D. 11,06
E. 12,81
Penyelesaian:
Ketika garam yang terbentuk dari asam lemah dan basa lemah yang memiliki Ka = Kb maka berapapun konsentrasi garam itu pH-nya dianggap netral = 7
25. Suatu larutan buffer sebanyak 1 L mengandung campuran 0,14 M HC2H3O2 dan 0,27 M C2H3O2–. Diketahui Ka HC2H3O2 = 1,8 × 10–5 . Nilai pH larutan buffer tersebut setelah ditambah 0,025 mol HCl adalah
A. 0,85
B. 1,15
C. 4,92
D. 5,03
E. 6,47
10
Penyelesaian:
Larutan buffer ditambah sedikit asam kuat maka akan terjadi peningkatan jumlah mol asam dan pengurangan jumlah konjugat (karena konjugatnya bereaksi dengan H+ membentuk asam tadi).
HC2H3O2 = CH3COOH, C2H3O2– = CH3COO-
1 L CH3COOH 0,14 M = 0,14 mol
1 L CH3COO- 0,27 M = 0,27 mol
HCl = 0,025 mol =
Ka CH3COOH = 1,8 × 10–5 pKa = 5 – log 1,8
CH3COOH H+ + CH3COO-
Mula-mula :
0,14 mol
0,27 mol
Perubahan :
+ 0,025 mol
– 0,025 mol
Akhir :
0,165 mol
?
0,255 mol
pH = pKa + log (0,255/0,165)
pH = 5 – log 1,8 + log 1,545
pH = 5 – 0,26 + 0,19 = 4,93
26. Dalam perkembangan teori atom tercatat beberapa hal berikut:
(1) Percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom
(3) Data-data eksperimen selain atom hidrogen diperoleh dari hasil percobaan Bohr
Pernyataan yang benar adalah....
A. 1, 2, dan 3
B. 1 dan 2
C. 2 dan 3
D. 1 saja
E. 3 saja
Penyelesaian:
(1) Benar bahwa percobaan Rutherford membuktikan bahwa muatan positif terkonsentrasi pada pusat bola atom dengan melakukan penembakan menggunakan sinar alfa pada lempeng tipis emas, ternyata sebagian ada yang dibelokkan (yang mengenai inti atom).
(2) Postulat Bohr merupakan perumusan kuantitatif pertama tentang struktur atom hidrogen beserta spektrumnya.
(3) Data-data eksperimen hanya atom hidrogen diperoleh dari hasil percobaan Bohr
27. Berdasarkan letaknya dalam sistem periodik, muatan, dan jumlah elektronnya, maka urutan ukuran atom/ion isoelektronik di bawah ini adalah
A. Ca2+ > K+ > Ar > Cl– > S2–
B. S2– > Cl– > Ar > K+ > Ca2+
C. S2– > Ca2+ > Cl– > K+ > Ar
D. Cl– > S2– > Ca2+ > K+ > Ar
E. Ca2+ > S2– > K+ > Ar > Cl–
Penyelesaian:
Sesuai data pada tabel periodik unsur diketahui bahwa:
S nomor atom 16
Cl nomor atom 17
Ar nomor atom 18
K nomor atom 19
Ca nomor atom 20
Ukuran atom/ion isoeletronik (memiliki jumlah elektron sama dalam hal ini semua punya 18 elektron) semakin kecil jika jumlah proton (= nomor atom) semakin besar.
Dengan demikian urutan yang benar adalah S2– > Cl– > Ar > K+ > Ca2+ sesuai dengan alternatif B
11
28. Pasangan unsur yang mempunyai ukuran/volume atom yang hampir sama adalah
A. K, Ca
B. Ti, Zr
C. K, Rb
D. Ne, Kr
E. HF , Zr
Penyelesaian:
Dapat disimak dalam tabel periodik unsur, bahwa unsur yang terletak dalam satu periode akan memiliki ukuran volume yang hampir sama, terutama yang memang golongannya berdekatan. Dalam hal ini pasangan yang punya volume atom yang hampir sama adalah K dan Ca terletak pada periode ke 3 (K golongan IA (golongan 1), Ca golongan IIA(golongan 2)).
29. Suatu senyawa murni terdiri dari C, H, N, O, S, dan Fe. Jumlah atom Fe dalam senyawa tersebut adalah satu. Kadar Fe dalam senyawa tersebut 8,09% (w/w). Massa molekul relatif senyawa tersebut adalah ....
A. 56
B. 346
C. 453
D. 692
E. 785
Penyelesaian:
Ar Fe = 56 massa molar Fe = 56 g/mol
% Fe = massa molar Fe : massa molar senyawa (Mr)
8,09% = 56 : Mr Senyawa
0,0809 = 56 : Mr Senyawa
Mr Senyawa = 56 : 0,0808 = 692,21 ~ 692
30. Perhatikan pernyataan berikut:
(1) Titik didih/leleh unsur golongan non logam dari bawah ke atas makin besar sebab kekuatan ikatan van des Waals yang terjadi makin kuat
(2) Semua senyawa logam memiliki kecenderungan untuk membentuk ion kompleks
(3) Keelektronegatifan unsur golongan logam dari atas ke bawah makin kecil
Pernyataan di atas benar, kecuali:
A. 1, 2, 3
B. 1, 2
C. 2, 3
D. 1 saja
E. 3 saja
Penyelesaian:
Cukup jelas, titik didih unsur golongan non logam dari bawah ke atas semakin kecil dan tidak semua senyawaan logam dapat membentuk ion kompleks.
31. Sifat-sifat berikut yang bukan sifat koloid adalah
A. Dapat mengalami koagulasi
B. Menunjukkan efek Tyndall
C. Jika mengadsorbsi ion, dapat dipisahkan dengan elektroforesis
D. Terdiri dari satu fasa
E. Menunjukkan gerak Brown
Penyelesaian:
Sifat koloid salah satunya adalah memiliki dua fasa (bukan satu fasa), yaitu fasa terdispersi dan medium pendispersi.
12
32. Senyawa yang dapat digunakan sebagai penstabil emulsi adalah
A. ZnS2
B. Natrium oleat
C. HCl
D. Na2S2O3
E. Natrium asetat
Penyelesaian:
Senyawa yang dapat digunakan sebagai penstabil emulsi antara lain natrium oleat,
33. Di antara unsur-unsur di bawah ini yang mempunyai afinitas elektron terbesar adalah
A. Be
B. B
C. C
D. N
E. Ne
Penyelesaian:
Unsur-unsur yang di sajikan pada alternatif jawaban adalah unsur yang terletak dalam satu periode. Dalam satu periode dari kiri ke kana afinitasnya semakin besar. Ne terletak paling kanan dalam tabel periodik unsur. Jadi Ne-lah yang mempunyai afinitas elektron terbesar.
34. Dalam suasana basa, logam kobalt (Co) dapat mengalami reaksi oksidasi menjadi Co(OH)3 sementara natrium hipoklorit, NaOCl, dapat dioksidasi menjadi NaCl. Apabila reaksi tersebut disetarakan maka koefisien reaksi kobalt dan NaOCl yaitu:
A. 2 dan 3
B. 1 dan 3
C. 3 dan 2
D. 1 dan 2
E. 3 dan 1
Penyelesaian:
Reaksi Oksidasi : Co Co3+ + 3e- |x2
Reaksi Reduksi : H2O + OCl- + 2e- Cl- + 2OH- |x3
Reaksi redoks : 2Co + 3H2O + 3OCl- 2Co3+ + 3Cl- + 6OH-
Reaksi lengkapnya: 2Co + 3H2O + 3NaOCl 2 Co(OH)3 + 3NaCl
Jadi koefisien reaksi kobalt = 2, dan koefisien reaksi NaOCl = 3
35. Hidrogensulfat atau ion bisulfat, HSO4- dapat bertindak sebagai asam atau basa di dalam air. Di antara persamaan reaksi berikut, ion HSO4- yang bertindak sebagai asam adalah dalam reaksi:
A. HSO4– + H2O H2SO4 + OH-
B. HSO4– + H3O+ SO3 + 2H2O
C. HSO4– + OH- H2SO4 + O2-
D. HSO4– + H2O SO42– + H3O+
E. HSO4– + H3O+ H2SO4 + H2O
Penyelesaian:
Jika suatu spesi mampu melepaskan proton (ion H+) maka ia dikatakan bertindak sebagai basa, sementar itu H2O akan bertindak sebagai basa yang ditandai dengan diterima-nya ion H+ dari ion HSO4- membentuk H3O+. Jadi reaksi pada alternatif D yang menunjukkan HSO4- bertindak sebagai asam.
13
36. Larutan 0,2 M natrium klorobenzoat (NaC7H4ClO2) memiliki pH 8,65. Nilai pH larutan 0,2 M asam klorobenzoat (HC7H4ClO2) adalah
A. 5,35
B. 8,65
C. 2,35......? pH = 2,65
D. 3,45
E. 3,25
Penyelesaian:
Natrium klorobenzoat adalah garam yang berasal dari basa kuat dengan asam lemah, sehingga ia bersifat basa (pH > 7)
Untuk dapat menghitung pH asam klorobenzoat harus diketahui Ka asam tersebut, Ka ini dapat dihitung dari hitungan garam-nya.
pH = 8,65 pOH = 14 – 8,65 = 5,35 [OH-] = 10–5,35 M [ ][ ]
[H+] = √ = 10–2,65 pH = 2,65
Dari alternatif jawaban tidak tersedia.
37. Warfarin digunakan sebagai racun tikus. Jumlah pusat kiral yang terdapat dalam molekul warfarin di bawah ini adalah
A. 0
B. 1
C. 2
D. 3
E. 4
Penyelesaian:
Atom C kiral (pusat kiral) adalah atom C yang mengikat 4 gugus berbeda-beda, pada molekul warfarin terdapat 1atom C kiral yang ditunjukkan pada lingkar merah gambar berikut ini:
Setiap ujung ikatan dan setiap sudut menunjukkan
adanya atom C, atom H tidak ditampilkan, setiap
atom C memiliki 4 ikatan, kalau tidak tampak
sebanyak 4 ikatan artinya ada satu ikatan C dengan
atom H.
38. Di antara pasangan senyawa di bawah ini, yang memiliki titik didih yang identik adalah
A. CH3CH2CH2CH2OH dan (CH3)2CHCH2OH
B. CH3(CH2)4CH3 dan (CH3)2CHCH(CH3)2
C.
D.
E.
14
Penyelesaian:
Senyawa dengan rumus struktur sama dan rumus molekul yang sama akan memiliki titik didih yang identik. Pada alternatif D rumus molekul dan rumus strukturnya sama, hanya letak gugus Cl ada yang ke arah belakang bidang datar dan ke arah depan bidang datar.
39. Berikut ini adalah struktur vitamin C (asam askorbat):
Pernyataan yang tepat mengenai jumlah atom karbon kiral dan konfigurasi absolut atom C kiral yang terdapat pada cincin adalah
A. 1 dan R
B. 2 dan R
C. 1 dan S
D. 2 dan S
E. 3 dan R
Penyelesaian:
40. Jumlah isomer, termasuk isomer geometrinya yang dimiliki senyawa C3H4Cl2 adalah
A. 3
B. 4
C. 5
D. 6
E. 7
Penyelesaian:
Tidak tersedia jawaban......!
OSK 2013 (No 21-25 )
Soal Nomor 21:
Kedua senyawa berikut ini, CH3-CH2OH dan CH3-O-CH3, mempunyai massa relatif yang sama, tetapi titik didihnya tidak sama, dan titik didih masing-masing adalah 78oC dan -24oC.
Perbedaan titik didih ini disebabkan oleh adanya perbedaan:
A. rumus molekul
B. panas pembakaran
C. panas spesifik
D. berat jenis
E. ikatan antar molekulnya
Pembahasan:
Dua senyawa tersebut punya Mr yang sama. Pada senyawa organik seperti pada soal ini tanpa ada data yang lain maka bisa disimpulkan bahwa perbedaan titik didih itu hanya disebabkan oleh adanya perbedaan ikatan antar molekulnya. Pada CH3-CH2OH (alkohol) memungkinkan terjadinya ikatan hidrogen antar molekulnya, sehingga untuk mendidihkannya (dari cair menjadi gas) memerlukan energi lebih besar untuk memutuskan ikatan hidrogen sehingga bisa berubah wujud menjadi gas. Sedangkan pada CH3-O-CH3 (eter) tidak memungkinkan terjadinya ikatan hidrogen sehingga untuk mendidih tidak diperlukan eenergi yang lebih besar dibanding
Jawaban E.
Soal Nomor 22:
Pasangan isomer dari senyawa dengan rumus molekul C3H6O adalah:
A. Propanal dan propanol
B. Propanol dan metoksi etana
C. Propanon dan propanal
D. Aseton dan propanon
E. Asetaldehid dan aseton
Pembahasan:
Isomer => rumus molekul sama tetapi rumus struktur berbeda
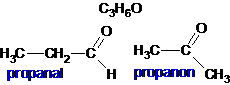
Jawaban C.
Soal Nomor 23:
Bila senyawa isobutilena direaksikan dengan HCI , maka akan dihasilkan senyawa:
A. 1-kloro propana
B. 3-kloro-2-metil propena
C. 2-kloro propana
D. ter-butil klorida
E. Etanal
Pembahasan:
Isobutilena = isobutena

Jawaban D.
Soal Nomor 24:
Bila senyawa (CH3)2CHCHBrCH2CH3 direaksikaan dengan KOH alkoholis, maka produk utama yang dihasilkan adalah:
A. (CH3)2CHCH=CH3
B. (CH3)2C=CHCH2CH3
C. (CH3)2CHCH2CHOHCH3
D. (CH3)2CHCHOHCH2CH3
E. (CH3)2COCH2CH2CH3
Pembahasan:
Reaksi halogenalkana dan KOH alkoholis (KOH yang dilarutkan dalam alkohol) memberikan hasil berbeda dengan reaksi halogenalkana dan larutan KOH biasa (KOH yang dilarutkan dalam air).
- Reaksi halogen alkana dan KOH alkoholis akan menghasilkan alkena
- Reaks halogenalkana dan KOH biasa akan menghasilkan alkohol
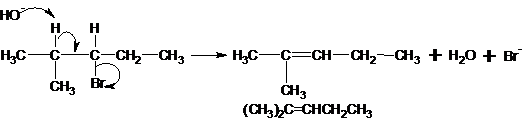
Jawaban B.
Soal Nomor 25:
Senyawa berikut ini, manakah yang didalam air memberikan sifat basa yang paling kuat?
A. CH3CH2CH2OH
B. CH3CH2CHO
C. CH3CH2CO2H
D. CH3CH2CH2NH2
E CH3-CCH
Pembahasan:
Sifat basa paling kuat di antara senyawa organik di atas dimiliki oleh senyawa yang memiliki gugus amina (-NH2)
Jawaban D.
Kedua senyawa berikut ini, CH3-CH2OH dan CH3-O-CH3, mempunyai massa relatif yang sama, tetapi titik didihnya tidak sama, dan titik didih masing-masing adalah 78oC dan -24oC.
Perbedaan titik didih ini disebabkan oleh adanya perbedaan:
A. rumus molekul
B. panas pembakaran
C. panas spesifik
D. berat jenis
E. ikatan antar molekulnya
Pembahasan:
Dua senyawa tersebut punya Mr yang sama. Pada senyawa organik seperti pada soal ini tanpa ada data yang lain maka bisa disimpulkan bahwa perbedaan titik didih itu hanya disebabkan oleh adanya perbedaan ikatan antar molekulnya. Pada CH3-CH2OH (alkohol) memungkinkan terjadinya ikatan hidrogen antar molekulnya, sehingga untuk mendidihkannya (dari cair menjadi gas) memerlukan energi lebih besar untuk memutuskan ikatan hidrogen sehingga bisa berubah wujud menjadi gas. Sedangkan pada CH3-O-CH3 (eter) tidak memungkinkan terjadinya ikatan hidrogen sehingga untuk mendidih tidak diperlukan eenergi yang lebih besar dibanding
Jawaban E.
Soal Nomor 22:
Pasangan isomer dari senyawa dengan rumus molekul C3H6O adalah:
A. Propanal dan propanol
B. Propanol dan metoksi etana
C. Propanon dan propanal
D. Aseton dan propanon
E. Asetaldehid dan aseton
Pembahasan:
Isomer => rumus molekul sama tetapi rumus struktur berbeda

Jawaban C.
Soal Nomor 23:
Bila senyawa isobutilena direaksikan dengan HCI , maka akan dihasilkan senyawa:
A. 1-kloro propana
B. 3-kloro-2-metil propena
C. 2-kloro propana
D. ter-butil klorida
E. Etanal
Pembahasan:
Isobutilena = isobutena

Jawaban D.
Soal Nomor 24:
Bila senyawa (CH3)2CHCHBrCH2CH3 direaksikaan dengan KOH alkoholis, maka produk utama yang dihasilkan adalah:
A. (CH3)2CHCH=CH3
B. (CH3)2C=CHCH2CH3
C. (CH3)2CHCH2CHOHCH3
D. (CH3)2CHCHOHCH2CH3
E. (CH3)2COCH2CH2CH3
Pembahasan:
Reaksi halogenalkana dan KOH alkoholis (KOH yang dilarutkan dalam alkohol) memberikan hasil berbeda dengan reaksi halogenalkana dan larutan KOH biasa (KOH yang dilarutkan dalam air).
- Reaksi halogen alkana dan KOH alkoholis akan menghasilkan alkena
- Reaks halogenalkana dan KOH biasa akan menghasilkan alkohol
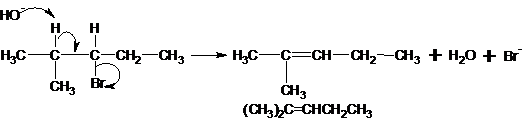
Jawaban B.
Soal Nomor 25:
Senyawa berikut ini, manakah yang didalam air memberikan sifat basa yang paling kuat?
A. CH3CH2CH2OH
B. CH3CH2CHO
C. CH3CH2CO2H
D. CH3CH2CH2NH2
E CH3-CCH
Pembahasan:
Sifat basa paling kuat di antara senyawa organik di atas dimiliki oleh senyawa yang memiliki gugus amina (-NH2)
Jawaban D.
OSK 2013 ( No :16-20)
Soal Nomor 16:
Perhatikan reaksi redoks berikut ini:
I2 + 2S2O3-2 → S4O6-2 +2I-
Dalam titrasi, sebanyak 40 mL larutan membutuhkan 4,0 x 10-3 mol I2 untuk bereaksi sempurna. Berapa konsentrasi larutan Na2S2O3 ?
A. 0,10
B. 0,16
C. 0,20
D. 0,32
E. 0,40
Pembahasan:
I2 + 2S2O3-2 → S4O6-2 +2I-
Berdasarkan persamaan reaksi yang setara di atas maka dalam titrasi tersebut jumlah mol S2O3-2 dapat dihitung berdasarkan perbandingan koefisien setara.
Mol S2O3-2 = 2/1 x 4,0 x 10-3 mol = 8,0 x 10-3 mol
Karena volume larutan S2O3-2 adalah 40 mL ~ 0,04 L, maka
[S2O3-2] = (8,0 x 10-3 mol) /(0,04 L) = 2 x 10-1 M ~ 0,2 M ← [Na2S2O3]
Jawaban C.
Soal Nomor 17:
Perhatikan reaksi redoks berikut ini:
C2H5OH +2Cr2O72- + 16H+ → CO2 + 4Cr3+ + 11H2O
Setiap atom karbon akan kehilangan:
A. 1 elektron
B. 2 elektron
C. 4 elektron
D. 6 elektron
E. 0 elektron
Pembahasan:
Bilangan oksidasi C dalam C2H5OH adalah -2 dan bilangan oksidasi C dalam CO2 adalah + 4, perubahan biloks C dari -2 ke +4 adalah 6, berarti ia akan melepaskan (kehilangan) 6 elektron.
Jawaban D.
Soal Nomor 18:
Sejumlah garam klorida lelehan dielektrolisis dengan suatu arus listrik 3,00 A. Jumlah deposit logam yang manakah akan memerlukan waktu elektrolisis terlama?
A. 50 g Mg
B. 75 g Al
C. 100 g Ca
D. 125 g Fe
E. Jawaban A, B, C dan D semuanya benar
Pembahasan:
Elektrolis suatu lelehan garam pada pada elektroda akan menghasilkan deposit logam (dari ion logamnya) yang biasanya akan menempel di elektroda dan gas klor (dari ion klorida) di sekitar elektroda lainnya.
Untuk menghitung lama waktu bisa menggunakan rumus sebagai berikut:
W = (e . i . t)/96500 → t = (W x 96500) : (e.i)
W = massa deposit logam (g); e = massa ekivalen (g); i = arus listrik (A); t = waktu (detik).
Mg2+ → Mg + 2e- →Ar Mg = 24 → massa ekivalen Mg = 24/2 = 12
Al3+ → Al + 3e- →Ar Al = 27 → massa ekivalen Al = 27/3 = 9
Ca2+ → Ca + 2e- →Ar Ca = 40 → massa ekivalen Ca = 40/2 = 20
Fe3+ → Fe + 3e- → Ar Fe = 56 → massa ekivalen Fe = 56/3 = 18,67
Fe2+ → Fe + 2e- → Ar Fe = 56 → massa ekivalen Fe = 56/2 = 28
t Mg = (50 g × 96500 C) : (12 g × 3,00 A) = 134.027,78 detik
t Al = (75 g × 96500 C) : (9 g × 3,00 A) = 268.055,56 detik
t Ca = (100 g × 96500 C) : (20 g × 3,00 A) = 168.833,33 detik
t Fe = (125 g × 96500 C) : (18,67 g × 3,00 A) = 215.363,33 detik
t Fe = (1250 g 96500 C) : (28 g 3,00 A) = 143.601,19 detik
Jadi yang memerlukan waktu paling lama adalah logam Al 75 g.
Jawaban B.
Soal Nomor 19:
Perhatikan Gambar sel elektrokimia beikut ini:
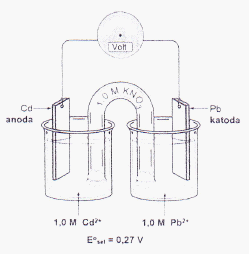
Bila sel tersebut dioperasikan, maka elektron akan mengalir kearah:
A. Elektroda Pb, dimana Pb akan dioksidasi
B. Elektroda Cd, dimana Cd akan dioksidasi
C. Elektroda Pb, dimana Pb2+ akan direduksi.
D. Elektroda Cd, dimana Cd2+ akan direduksi.
E. Elektroda Pb dimana Cd2+ akan dioksidasi
Pembahasan:
Mengalirnya elektron itu dari reaksi yang bisa menghasilkan elektron (reaksi oksidasi, terjadi di anoda) ke reaksi yang memerlukan elektron (reaksi reduksi, terjadi di katoda). Jadi elektron akan mengalir ke katoda Pb dan terjadi reaksi reduksi Pb2+ menjadi Pb.
Jawaban C.
Soal Nomor 20:
Nama IUPAC dari senyawa berikut adalah
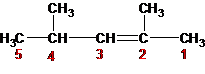
A. 2,3-dimetil-4-pentana
B. 1,1-dimetil-2-isopropiletena
C. 2,3-dimetil-2-pentana
D. 2,4-dimetil-2-pentena
E. 2,2-di metil-5-pentana
Pembahasan:
Tata nama berdasar IUPAC harus dimulai dari sisi di mana ikatan rangkap berada pada nomor urut C yang terkecil.
Jawaban D.
Perhatikan reaksi redoks berikut ini:
I2 + 2S2O3-2 → S4O6-2 +2I-
Dalam titrasi, sebanyak 40 mL larutan membutuhkan 4,0 x 10-3 mol I2 untuk bereaksi sempurna. Berapa konsentrasi larutan Na2S2O3 ?
A. 0,10
B. 0,16
C. 0,20
D. 0,32
E. 0,40
Pembahasan:
I2 + 2S2O3-2 → S4O6-2 +2I-
Berdasarkan persamaan reaksi yang setara di atas maka dalam titrasi tersebut jumlah mol S2O3-2 dapat dihitung berdasarkan perbandingan koefisien setara.
Mol S2O3-2 = 2/1 x 4,0 x 10-3 mol = 8,0 x 10-3 mol
Karena volume larutan S2O3-2 adalah 40 mL ~ 0,04 L, maka
[S2O3-2] = (8,0 x 10-3 mol) /(0,04 L) = 2 x 10-1 M ~ 0,2 M ← [Na2S2O3]
Jawaban C.
Soal Nomor 17:
Perhatikan reaksi redoks berikut ini:
C2H5OH +2Cr2O72- + 16H+ → CO2 + 4Cr3+ + 11H2O
Setiap atom karbon akan kehilangan:
A. 1 elektron
B. 2 elektron
C. 4 elektron
D. 6 elektron
E. 0 elektron
Pembahasan:
Bilangan oksidasi C dalam C2H5OH adalah -2 dan bilangan oksidasi C dalam CO2 adalah + 4, perubahan biloks C dari -2 ke +4 adalah 6, berarti ia akan melepaskan (kehilangan) 6 elektron.
Jawaban D.
Soal Nomor 18:
Sejumlah garam klorida lelehan dielektrolisis dengan suatu arus listrik 3,00 A. Jumlah deposit logam yang manakah akan memerlukan waktu elektrolisis terlama?
A. 50 g Mg
B. 75 g Al
C. 100 g Ca
D. 125 g Fe
E. Jawaban A, B, C dan D semuanya benar
Pembahasan:
Elektrolis suatu lelehan garam pada pada elektroda akan menghasilkan deposit logam (dari ion logamnya) yang biasanya akan menempel di elektroda dan gas klor (dari ion klorida) di sekitar elektroda lainnya.
Untuk menghitung lama waktu bisa menggunakan rumus sebagai berikut:
W = (e . i . t)/96500 → t = (W x 96500) : (e.i)
W = massa deposit logam (g); e = massa ekivalen (g); i = arus listrik (A); t = waktu (detik).
Mg2+ → Mg + 2e- →Ar Mg = 24 → massa ekivalen Mg = 24/2 = 12
Al3+ → Al + 3e- →Ar Al = 27 → massa ekivalen Al = 27/3 = 9
Ca2+ → Ca + 2e- →Ar Ca = 40 → massa ekivalen Ca = 40/2 = 20
Fe3+ → Fe + 3e- → Ar Fe = 56 → massa ekivalen Fe = 56/3 = 18,67
Fe2+ → Fe + 2e- → Ar Fe = 56 → massa ekivalen Fe = 56/2 = 28
t Mg = (50 g × 96500 C) : (12 g × 3,00 A) = 134.027,78 detik
t Al = (75 g × 96500 C) : (9 g × 3,00 A) = 268.055,56 detik
t Ca = (100 g × 96500 C) : (20 g × 3,00 A) = 168.833,33 detik
t Fe = (125 g × 96500 C) : (18,67 g × 3,00 A) = 215.363,33 detik
t Fe = (1250 g 96500 C) : (28 g 3,00 A) = 143.601,19 detik
Jadi yang memerlukan waktu paling lama adalah logam Al 75 g.
Jawaban B.
Soal Nomor 19:
Perhatikan Gambar sel elektrokimia beikut ini:

Bila sel tersebut dioperasikan, maka elektron akan mengalir kearah:
A. Elektroda Pb, dimana Pb akan dioksidasi
B. Elektroda Cd, dimana Cd akan dioksidasi
C. Elektroda Pb, dimana Pb2+ akan direduksi.
D. Elektroda Cd, dimana Cd2+ akan direduksi.
E. Elektroda Pb dimana Cd2+ akan dioksidasi
Pembahasan:
Mengalirnya elektron itu dari reaksi yang bisa menghasilkan elektron (reaksi oksidasi, terjadi di anoda) ke reaksi yang memerlukan elektron (reaksi reduksi, terjadi di katoda). Jadi elektron akan mengalir ke katoda Pb dan terjadi reaksi reduksi Pb2+ menjadi Pb.
Jawaban C.
Soal Nomor 20:
Nama IUPAC dari senyawa berikut adalah
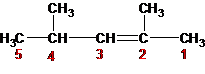
A. 2,3-dimetil-4-pentana
B. 1,1-dimetil-2-isopropiletena
C. 2,3-dimetil-2-pentana
D. 2,4-dimetil-2-pentena
E. 2,2-di metil-5-pentana
Pembahasan:
Tata nama berdasar IUPAC harus dimulai dari sisi di mana ikatan rangkap berada pada nomor urut C yang terkecil.
Jawaban D.
OSK 2013 ( No : 11-15 )
Soal Nomor 11:
Perhatikan 3 reaksi yang berlangsung dalam 3 wadah berikut ini:
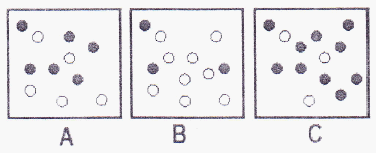 Persamaan hukum laju reaksi dalam ketiga wadah tersebut diberikan oleh:
Persamaan hukum laju reaksi dalam ketiga wadah tersebut diberikan oleh:
laju = r = k [●] [o]
Berdasarkan persamaan reaksi yang diberikan, berikut ini manakah pernyataan yang benar?
A. Laju reaksi A = laju reaksi B
B. Laju reaksi A = Laju reaksi C
C. Laju reaksi B = laju reaksi C
D. Laju reaksi A = Laju reaksi B = Laju reaksi C
E. Laju reaksi A, B dan C tidak dapat ditentukan
Pembahasan:
Syarat untuk bisa membandingkan laju reaksi satu dengan yang lainnya adalah diketahui data akuratnya. Perubahan konsentrasi setiap zat harus jelas. Tidak cukup hanya dengan melihat visual seperti di atas dan hanya dari persamaan laju reaksinya saja.
Jawabannya E.
Soal Nomor 12:
Berikut adalah reaksi yang berlangsung dalam larutan benzena yang mengandung piridin 0,1 M: CH3OH (A) + (C6H5)3CCl (B) → CH3OC(C6H5)3 (C) + HCl, dengan hasil percobaan sebagai berikut:
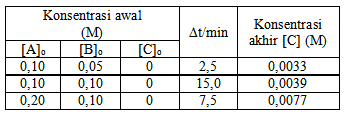
Hukum laju dan nilai tetapan laju untuk reaksi tersebut berturut-turut adalah
A. r= k [A]2[B] dan 4,6 x 10-3 L2mol-2s-1
B. r = k [A][B] dan 3,8 x 10-3 Lmol-1s-1
C. r= k [A][B]2 dan 5,2 x 10-3 L2mol-2s-1
D. r = k [A] dan 2,6 x 10-3 s-1
E. r =k [B] dan 7,4 x 10-3 s-1
Pembahasan:
Berdasarkan rujukan soal yang ada di internet (ingat banyak soal yang diambil dari referensi lain sebelumnya), jadi kalau di cari pasti ketemu saja ), soal ini terjadi kekeliruan pada data Δt/min baris pertama,
tertulis 2,5 seharusnya adalah 25. Lagi pula kalau dipaksakan maka tidak
ada alternatif jawaban yang benar.
), soal ini terjadi kekeliruan pada data Δt/min baris pertama,
tertulis 2,5 seharusnya adalah 25. Lagi pula kalau dipaksakan maka tidak
ada alternatif jawaban yang benar.
Oleh karena itu di sini akan digunakan data yang benar itu.
Laju reaksi setiap bagian akan dihitung terlebih dahulu dengan rumus
R = ([C]/Δt) x (1 menit/60 detik)
dan hasilnya terdapat pada kolom ke paling kanan tabel di bawah ini.
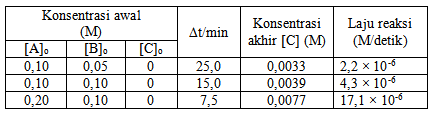
Orde reaksi terhadap A dapat ditentukan dengan menggunakan data kedua dan ketiga (konsentrasi B yang sama/tetap), dan sebaliknya.
- orde terhadap A: (0,2/0,1)x = (17,1 × 10-6 : 4,3 × 10-6) → 2x = 4 → x = 2
- orde terhadap B: (0,1/0,05)y = (4,3 × 10-6 : 2,2 × 10-6) → 2y = 2 → y = 1
Jadi r = r= k [A]2[B]
Menghitung tetapan laju reaksi (k)
Biasanya k bisa ditentukan dengan menggunakan salah satu data hasil percobaan, dalam pembahasan ini digunakan data kedua.
k = r / [A]2[B] → 4,3 × 10-6 / (0,1)2 × (0,1) = 4,3 × 10-3
Jawaban A.
Soal Nomor 13:
Grafik berikut ini, manakah yang menjelaskan hubungan antara [H3O+] dan pH dalam larutan?
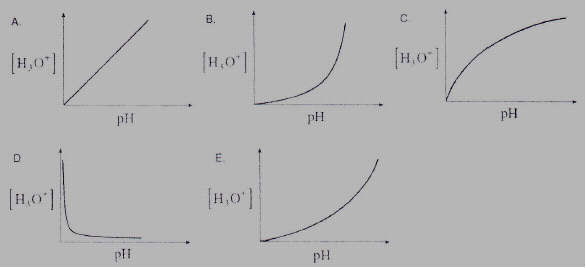
Pembahasan:
[H3O+] berbanding terbalik terhadap pH. [H3O+] turun maka pH akan meningkat, [H3O+] meningkat maka pH akan turun.
Jawabannya D.
Soal Nomor 14:
Berapa pH larutan yang terbentuk bila sebanyak 0,0600 mol NaOH ditambahkan ke dalam 1 L larutan HCl 0,0500 M.
A. 3,45
B. 8,90
C. 12,00
D. 12,78
E. 13,50
Pembahasan:
mol NaOH = 0,06 mol
mol HCl = 0,05 M x 1 L = 0,05 mol
[OH-] = 0,01 M ~ 10-2 M —> NaOH adalah basa kuat.
pOH = -log [OH-] = – log 10-2 = 2
pH = 14 – pOH = 14 – 2 = 12
Jawaban C.
Soal Nomor 15:
Dalam larutan jenuh nikel karbonat, NiCO3 , mengandung 0,090 g dalam 2,0 L larutan. Berapakah nilai Ksp untuk NiCO3:
A. 7,58 x 10-4
B. 3,79 x 10-4
C. 5,74 x 10-7
D. 1,44 x 10-7
E. 2,87 x 10-8
Pembahasan:
mol NiCO3 = massa NiCO3 : Mr NiCO3 = 0,09 g : 119 g/mol = 0,00076 mol
Kelarutan NiCO3 = 0,00076 mol : 2 L = 0,00038 M
Jawaban D.
Perhatikan 3 reaksi yang berlangsung dalam 3 wadah berikut ini:
 Persamaan hukum laju reaksi dalam ketiga wadah tersebut diberikan oleh:
Persamaan hukum laju reaksi dalam ketiga wadah tersebut diberikan oleh:laju = r = k [●] [o]
Berdasarkan persamaan reaksi yang diberikan, berikut ini manakah pernyataan yang benar?
A. Laju reaksi A = laju reaksi B
B. Laju reaksi A = Laju reaksi C
C. Laju reaksi B = laju reaksi C
D. Laju reaksi A = Laju reaksi B = Laju reaksi C
E. Laju reaksi A, B dan C tidak dapat ditentukan
Pembahasan:
Syarat untuk bisa membandingkan laju reaksi satu dengan yang lainnya adalah diketahui data akuratnya. Perubahan konsentrasi setiap zat harus jelas. Tidak cukup hanya dengan melihat visual seperti di atas dan hanya dari persamaan laju reaksinya saja.
Jawabannya E.
Soal Nomor 12:
Berikut adalah reaksi yang berlangsung dalam larutan benzena yang mengandung piridin 0,1 M: CH3OH (A) + (C6H5)3CCl (B) → CH3OC(C6H5)3 (C) + HCl, dengan hasil percobaan sebagai berikut:

Hukum laju dan nilai tetapan laju untuk reaksi tersebut berturut-turut adalah
A. r= k [A]2[B] dan 4,6 x 10-3 L2mol-2s-1
B. r = k [A][B] dan 3,8 x 10-3 Lmol-1s-1
C. r= k [A][B]2 dan 5,2 x 10-3 L2mol-2s-1
D. r = k [A] dan 2,6 x 10-3 s-1
E. r =k [B] dan 7,4 x 10-3 s-1
Pembahasan:
Berdasarkan rujukan soal yang ada di internet (ingat banyak soal yang diambil dari referensi lain sebelumnya), jadi kalau di cari pasti ketemu saja
Oleh karena itu di sini akan digunakan data yang benar itu.
Laju reaksi setiap bagian akan dihitung terlebih dahulu dengan rumus
R = ([C]/Δt) x (1 menit/60 detik)
dan hasilnya terdapat pada kolom ke paling kanan tabel di bawah ini.

Orde reaksi terhadap A dapat ditentukan dengan menggunakan data kedua dan ketiga (konsentrasi B yang sama/tetap), dan sebaliknya.
- orde terhadap A: (0,2/0,1)x = (17,1 × 10-6 : 4,3 × 10-6) → 2x = 4 → x = 2
- orde terhadap B: (0,1/0,05)y = (4,3 × 10-6 : 2,2 × 10-6) → 2y = 2 → y = 1
Jadi r = r= k [A]2[B]
Menghitung tetapan laju reaksi (k)
Biasanya k bisa ditentukan dengan menggunakan salah satu data hasil percobaan, dalam pembahasan ini digunakan data kedua.
k = r / [A]2[B] → 4,3 × 10-6 / (0,1)2 × (0,1) = 4,3 × 10-3
Jawaban A.
Soal Nomor 13:
Grafik berikut ini, manakah yang menjelaskan hubungan antara [H3O+] dan pH dalam larutan?

Pembahasan:
[H3O+] berbanding terbalik terhadap pH. [H3O+] turun maka pH akan meningkat, [H3O+] meningkat maka pH akan turun.
Jawabannya D.
Soal Nomor 14:
Berapa pH larutan yang terbentuk bila sebanyak 0,0600 mol NaOH ditambahkan ke dalam 1 L larutan HCl 0,0500 M.
A. 3,45
B. 8,90
C. 12,00
D. 12,78
E. 13,50
Pembahasan:
mol NaOH = 0,06 mol
mol HCl = 0,05 M x 1 L = 0,05 mol
NaOH + HCl → NaCl + H2O Awal : 0,06 mol 0,05 mol - - Reaksi : -0,05 mol -0,05 mol 0,05 mol 0,05 mol Akhir : 0,01 mol - 0,05 mol 0,05 molKosentrasi NaOH yang tersisa [NaOH] = 0,01 mol : 1 L = 0,01 M
[OH-] = 0,01 M ~ 10-2 M —> NaOH adalah basa kuat.
pOH = -log [OH-] = – log 10-2 = 2
pH = 14 – pOH = 14 – 2 = 12
Jawaban C.
Soal Nomor 15:
Dalam larutan jenuh nikel karbonat, NiCO3 , mengandung 0,090 g dalam 2,0 L larutan. Berapakah nilai Ksp untuk NiCO3:
A. 7,58 x 10-4
B. 3,79 x 10-4
C. 5,74 x 10-7
D. 1,44 x 10-7
E. 2,87 x 10-8
Pembahasan:
mol NiCO3 = massa NiCO3 : Mr NiCO3 = 0,09 g : 119 g/mol = 0,00076 mol
Kelarutan NiCO3 = 0,00076 mol : 2 L = 0,00038 M
NiCO3 ⇌ Ni2+ + CO32- 0,00038 M 0,00038 M 0,00038 MKsp NiCO3 = [Ni2+][CO32-] = (0,00038 M)2 = 0,000000144 = 1,44 x 10-7
Jawaban D.
OSK 2013 PG ( No :6-10)
Soal Nomor 6:
Berikut ini, yang manakah urutan dari bilangan kuantum suatu elektron dalam orbital 4d?
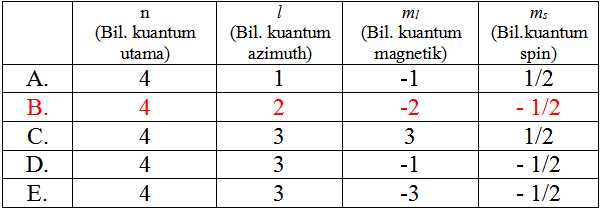
Pembahasan:
Bilangan kuantum suatu elektron dalam orbital 4d yang n = 4; l = 2 (d)
Jawabannya B
Soal Nomor 7:
Berikut ini diberikan data entalpi reaksi:
2 CH2N2(s) + 3 O2(g) → 2N2(g) + 2 H2O(l) + 2CO2(g) ΔHo = – 354,40 kkal
C(s) + O2(g) → CO2(g) ΔHo = – 93,97 kkal
2H2(g) + O2(g) → 2H2O(l) ΔHo = – 136,64 kkal
Nilai entalpi pembentukan bagi CH2N2 (s) adalah :
Pada soal ini aslinya ada yang keliru, pada persamaan reaksi pertama seharusnya 2H2O(l) tetapi hanya tertulis 2 H2(l).
Entalpi pembentukan adalah energi yang digunakan untuk membentuk 1 mol senyawa dari unsur-unsurnya.
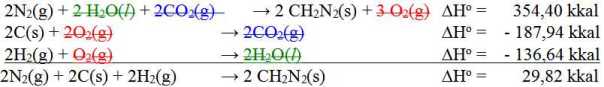
N2(g) + C(s) + H2(g) → CH2N2(s) ΔHo = 14,91 kkal
Jawabannya B
Soal Nomor 8:
Dalam senyawa atau ion yang mengandung sulfur berikut ini, muatan formal atom S dalam SO2, SO3, SO32-, dan SO42- berturut-turut adalah
Muatan formal = jumlah elektron valensi unsur – jumlah elektron bebas – 1/2 elektron berikatan
S dan O memiliki 6 elektron valensi
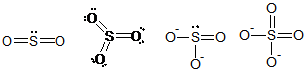 Muatan formal S pada SO2 = 6 – 2 – 4 = 0
Muatan formal S pada SO2 = 6 – 2 – 4 = 0
Muatan formal S pada SO3 = 6 – 0 – 6 = 0
Muatan formal S pada SO32- = 6 – 2 – 4 = 0
Muatan formal S pada SO42- = 6 – 0 – 6 = 0
Atom S itu berada diperiode tiga (3), sangat dimungkinkan untuk menggunakan orbital 3d sehingga tidak lagi mengikuti kaidah oktet. Beda dengan unsur yang berada di periode 2 yang tidak memiliki orbital 2d. Jadi tidak bisa dipaksa harus mengikuti kaidah oktet, ini terkait juga dengan tingkat energi masing-masing molekul yang lebih disukai pada energi yang relatif lebih rendah.
Jawabannya A
Soal Nomor 9:
Diberikan molekul berikut ini:
I. H2C=CHCl
II. cis-ClHC=CHCl
III. trans-ClHC=CHCl
Manakah molekul tersebut yang mempunyai momen dipol tidak sama dengan NOL?
Molekul III (trans-ClHC=CHCl) memiliki momen dipol sama dengan nol, sedangkan pada molekul I dan II momen dipolenya tidak sama dengan nol, hayooo apa alasan….?
Jawabannya C
Soal Nomor 10:
Berikut ini adalah reaksi kesetimbangan:
4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ
Bila reaksi sudah mencapai kesetimbangan, berikut ini manakah keadaan yang akan menggeser kesetimbangan ke arah kiri (membentuk reaktan lebih banyak):
Reaksi 4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ adalah reaksi eksoterm, maka agar bergeser ke reaktan maka dapat dilakukan dengan menaikkan temperaturnya. Koefisien zat berwujud gas sama sehingga tekanan tidak mempengaruhi, sementara menambah konsentrasi A akan menggeser kesetimbangan ke kanan.
Jawabannya E
Berikut ini, yang manakah urutan dari bilangan kuantum suatu elektron dalam orbital 4d?

Pembahasan:
Bilangan kuantum suatu elektron dalam orbital 4d yang n = 4; l = 2 (d)
Jawabannya B
Soal Nomor 7:
Berikut ini diberikan data entalpi reaksi:
2 CH2N2(s) + 3 O2(g) → 2N2(g) + 2 H2O(l) + 2CO2(g) ΔHo = – 354,40 kkal
C(s) + O2(g) → CO2(g) ΔHo = – 93,97 kkal
2H2(g) + O2(g) → 2H2O(l) ΔHo = – 136,64 kkal
Nilai entalpi pembentukan bagi CH2N2 (s) adalah :
- 123,79 kkal/mol
- 14,91 kkalmol
- -14,91 kkal/mol
- - 29,82 kkal/mol
- 29,82 kkal/mol
Pada soal ini aslinya ada yang keliru, pada persamaan reaksi pertama seharusnya 2H2O(l) tetapi hanya tertulis 2 H2(l).
Entalpi pembentukan adalah energi yang digunakan untuk membentuk 1 mol senyawa dari unsur-unsurnya.
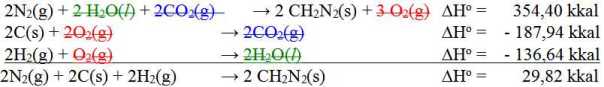
N2(g) + C(s) + H2(g) → CH2N2(s) ΔHo = 14,91 kkal
Jawabannya B
Soal Nomor 8:
Dalam senyawa atau ion yang mengandung sulfur berikut ini, muatan formal atom S dalam SO2, SO3, SO32-, dan SO42- berturut-turut adalah
- 0, 0, 0, 0
- -2, 0, 0, +1
- 0, +1, -2, 4
- 0, 0, +1, -2
- +1, 0, 0, -2
Muatan formal = jumlah elektron valensi unsur – jumlah elektron bebas – 1/2 elektron berikatan
S dan O memiliki 6 elektron valensi
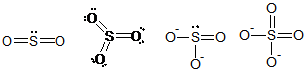 Muatan formal S pada SO2 = 6 – 2 – 4 = 0
Muatan formal S pada SO2 = 6 – 2 – 4 = 0Muatan formal S pada SO3 = 6 – 0 – 6 = 0
Muatan formal S pada SO32- = 6 – 2 – 4 = 0
Muatan formal S pada SO42- = 6 – 0 – 6 = 0
Atom S itu berada diperiode tiga (3), sangat dimungkinkan untuk menggunakan orbital 3d sehingga tidak lagi mengikuti kaidah oktet. Beda dengan unsur yang berada di periode 2 yang tidak memiliki orbital 2d. Jadi tidak bisa dipaksa harus mengikuti kaidah oktet, ini terkait juga dengan tingkat energi masing-masing molekul yang lebih disukai pada energi yang relatif lebih rendah.
Jawabannya A
Soal Nomor 9:
Diberikan molekul berikut ini:
I. H2C=CHCl
II. cis-ClHC=CHCl
III. trans-ClHC=CHCl
Manakah molekul tersebut yang mempunyai momen dipol tidak sama dengan NOL?
- hanya I
- hanya III
- hanya I dan II
- Hanya II dan III
- I, II, dan III
Molekul III (trans-ClHC=CHCl) memiliki momen dipol sama dengan nol, sedangkan pada molekul I dan II momen dipolenya tidak sama dengan nol, hayooo apa alasan….?
Jawabannya C
Soal Nomor 10:
Berikut ini adalah reaksi kesetimbangan:
4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ
Bila reaksi sudah mencapai kesetimbangan, berikut ini manakah keadaan yang akan menggeser kesetimbangan ke arah kiri (membentuk reaktan lebih banyak):
- Menurunkan temperatur
- Menaikkan tekanan parsial C
- Menaikkan tekanan sistem
- Menambah konsentrasi A
- Menaikkan temperatur
Reaksi 4A (s) + 2B(g) ⇌ 2C(g) ΔHreaksi = – 60 kJ adalah reaksi eksoterm, maka agar bergeser ke reaktan maka dapat dilakukan dengan menaikkan temperaturnya. Koefisien zat berwujud gas sama sehingga tekanan tidak mempengaruhi, sementara menambah konsentrasi A akan menggeser kesetimbangan ke kanan.
Jawabannya E
OSK 2013 PG 1-5
Soal Nomor 1
Dalam suatu reaksi redoks ternyata kalium dikromat (K2Cr2O7) bereaksi dengan timah diklorida (SnCl2) dalam suasana asam menjadi CrCl3 dan kalium klorida (KCl). Setelah reaksi disetarakan, maka koefisien reaksi dari kalium dikromat dan timah diklorida adalah
Dalam reaksi redoks selalu ada reaksi oksidasi dan reduksi. Dari reaksi tersebut yang mengalami reduksi adalah Cr (dari K2Cr2O7 menjadi CrCl3) dan yang harus mengalami oksidasi adalah Sn (dari Sn2+ menjadi Sn4+). Asam yang digunakan (sebagai penyuasana) semestinya adalah HCl.
Adapun reaksi redoksnya:
Reaksi reduksi : Cr2O72- + 14 H+ + 6e- → 2Cr3+ + 7 H2O | x 1|
Reaksi oksidasi : Sn2+ → Sn4+ + 2e- | x 3|
Reaksi total : Cr2O72- + 14 H+ + 3Sn2+ → 2Cr3+ + 7 H2O + 3Sn4+
Sehingga reaksi lengkapnya bisa dituliskan sebagai berikut:
K2Cr2O7 + 3 SnCl2 + 14 HCl → 2 CrCl3 + 7 H2O + 2 KCl + 3 SnCl4
Jadi jawaban yang tepat adalah B. 1 dan 3
Soal Nomor 2
Pada suhu kamar dan tekanan atmosfer, 1 gram oksigen mengisi ruang 0,764 liter, sedang gram oksida nitrogen dalam kondisi yang sama mengisi ruang 0,266 liter. Berdasarkan hal tersebut maka rumus oksida nitrogen termaksud adalah:
(Ar N =14, Ar O = 16)
Pada keadaan yang sama setiap 1 mol gas akan memiliki volume yang sama pula (Hukum Gay Lussac).
1 g O2 = 1/32 mol ~ 0,764 liter artinya 1 mol gas O2 volumenya = 32 x 0,764 = 24,448 L/mol.
Jika masa oksida nitrogen memiliki volume 0,266 L = 0,266 L : 24,448 L/mol = 0,01088 mol.
Artinya kita tinggal menentukan manakah oksida nitrogen yang 1 gram sama dengan 0,01088 mol. Dalam hal ini Mr oksida nitrogen = 1 : 0,01088 = 91,911 g/mol.
Yang paling mendekati adalah jawaban C. NO5
Soal Nomor 3
Bila 1 liter etil alkohol pada temperatur 20 oC mengandung 1,04 x 1025 molekul, maka jumlah molekul selain etil alkohol dalam 1 liter cuplikan etil alkohol yang kemurniannya dinyatakan 99,99% adalah sebanyak
Jumlah % molekul selain etil alkohol adalah 100% – 99,99% = 0,01%
Sehingga jumlah molekulnya = 0,01% x 1,04 x 1025 = 1,04 x 1021
Jawabannya B
Soal Nomor 4
Urutan kepolaran ikatan O-H, Mg-O, Ca-O, dan Sr-O adalah,
Semakin besar perbedaan elektronegativitas maka akan semakin polar. Elektronegativitas O >H>Mg>Ca>Sr. H punya elektronegativitas terbesar dibandingkan dengan unsur logam alkali tanah. Unsur Mg, Ca, Sr berturut-turut adalah anggota golongan unsur logam alkali, yang dari atas ke bawah memiliki elektronegativitas yang semakin kecil. Oksigen punya elektronegativitas yang besar dan semua berikatan dengan unsur yang akan diperbandingkan. Maka urutan perbedaannya dengan oksigen dari yang terbesar Sr-O > Ca-O > Mg-O > H-O
Jawabannya D. Sr-O > Ca-O > Mg-O > H-O
Soal Nomor 5
Dalam suatu percobaan, reaksi antara N2F4 dengan S2O6F2 dilakukan pada suhu ruang. Gas yang dihasilkan mempunyai titik didih -2,5oC. Analisis terhadap gas ini memberikan hasil : 9,48% N, 20,9% S,dan 38,0% F. Bila diketahui Ar N = 14,0 ; Ar S = 32,1 dan Ar F = 19,0 ; Ar O = 16,0, maka rumus empiris gas tersebut adalah:
Penentuan rumus empiris dari persen unsur yang diketahui dan persen O yang harus dihitung hingga total 100 % (31,62% O) adalah dengan menganggap jumlah zat 100 g. Perbandingan mol masing-masing unsur adalah:
Dalam suatu reaksi redoks ternyata kalium dikromat (K2Cr2O7) bereaksi dengan timah diklorida (SnCl2) dalam suasana asam menjadi CrCl3 dan kalium klorida (KCl). Setelah reaksi disetarakan, maka koefisien reaksi dari kalium dikromat dan timah diklorida adalah
- 3 dan 1
- 1 dan 3
- 2 dan 3
- 3 dan 2
- 1 dan 1
Dalam reaksi redoks selalu ada reaksi oksidasi dan reduksi. Dari reaksi tersebut yang mengalami reduksi adalah Cr (dari K2Cr2O7 menjadi CrCl3) dan yang harus mengalami oksidasi adalah Sn (dari Sn2+ menjadi Sn4+). Asam yang digunakan (sebagai penyuasana) semestinya adalah HCl.
Adapun reaksi redoksnya:
Reaksi reduksi : Cr2O72- + 14 H+ + 6e- → 2Cr3+ + 7 H2O | x 1|
Reaksi oksidasi : Sn2+ → Sn4+ + 2e- | x 3|
Reaksi total : Cr2O72- + 14 H+ + 3Sn2+ → 2Cr3+ + 7 H2O + 3Sn4+
Sehingga reaksi lengkapnya bisa dituliskan sebagai berikut:
K2Cr2O7 + 3 SnCl2 + 14 HCl → 2 CrCl3 + 7 H2O + 2 KCl + 3 SnCl4
Jadi jawaban yang tepat adalah B. 1 dan 3
Soal Nomor 2
Pada suhu kamar dan tekanan atmosfer, 1 gram oksigen mengisi ruang 0,764 liter, sedang gram oksida nitrogen dalam kondisi yang sama mengisi ruang 0,266 liter. Berdasarkan hal tersebut maka rumus oksida nitrogen termaksud adalah:
(Ar N =14, Ar O = 16)
- NO2 → Mr = 14 + 32 = 46
- NO3 → Mr= 14 + 48 = 62
- NO5 → Mr= 14 + 80 = 94
- N2O3 → Mr = 28 + 48= 76
- N2O5 → Mr = 28 + 80 = 108
Pada keadaan yang sama setiap 1 mol gas akan memiliki volume yang sama pula (Hukum Gay Lussac).
1 g O2 = 1/32 mol ~ 0,764 liter artinya 1 mol gas O2 volumenya = 32 x 0,764 = 24,448 L/mol.
Jika masa oksida nitrogen memiliki volume 0,266 L = 0,266 L : 24,448 L/mol = 0,01088 mol.
Artinya kita tinggal menentukan manakah oksida nitrogen yang 1 gram sama dengan 0,01088 mol. Dalam hal ini Mr oksida nitrogen = 1 : 0,01088 = 91,911 g/mol.
Yang paling mendekati adalah jawaban C. NO5
Soal Nomor 3
Bila 1 liter etil alkohol pada temperatur 20 oC mengandung 1,04 x 1025 molekul, maka jumlah molekul selain etil alkohol dalam 1 liter cuplikan etil alkohol yang kemurniannya dinyatakan 99,99% adalah sebanyak
- 2,72 x 1020
- 1,04 x 1021
- 3,15 x 1022
- 3,13 x 1023
- 2,14 x 1024
Jumlah % molekul selain etil alkohol adalah 100% – 99,99% = 0,01%
Sehingga jumlah molekulnya = 0,01% x 1,04 x 1025 = 1,04 x 1021
Jawabannya B
Soal Nomor 4
Urutan kepolaran ikatan O-H, Mg-O, Ca-O, dan Sr-O adalah,
- Sr-O > Mg-O > O-H > Ca-O
- O-H > Mg-O > Ca-O > Sr-O
- O-H > Sr-O > Ca-O > Mg-O
- Sr-O > Ca-O > Mg -O > O-H
- Mg-O > Ca-O > Sr-O > O-H
Semakin besar perbedaan elektronegativitas maka akan semakin polar. Elektronegativitas O >H>Mg>Ca>Sr. H punya elektronegativitas terbesar dibandingkan dengan unsur logam alkali tanah. Unsur Mg, Ca, Sr berturut-turut adalah anggota golongan unsur logam alkali, yang dari atas ke bawah memiliki elektronegativitas yang semakin kecil. Oksigen punya elektronegativitas yang besar dan semua berikatan dengan unsur yang akan diperbandingkan. Maka urutan perbedaannya dengan oksigen dari yang terbesar Sr-O > Ca-O > Mg-O > H-O
Jawabannya D. Sr-O > Ca-O > Mg-O > H-O
Soal Nomor 5
Dalam suatu percobaan, reaksi antara N2F4 dengan S2O6F2 dilakukan pada suhu ruang. Gas yang dihasilkan mempunyai titik didih -2,5oC. Analisis terhadap gas ini memberikan hasil : 9,48% N, 20,9% S,dan 38,0% F. Bila diketahui Ar N = 14,0 ; Ar S = 32,1 dan Ar F = 19,0 ; Ar O = 16,0, maka rumus empiris gas tersebut adalah:
- NSF3
- NSF2
- NSO4F4
- NSO3F3
- NSO2F2
Penentuan rumus empiris dari persen unsur yang diketahui dan persen O yang harus dihitung hingga total 100 % (31,62% O) adalah dengan menganggap jumlah zat 100 g. Perbandingan mol masing-masing unsur adalah:
N : S : O : F
9,48/14 : 20,9/32,1 : 31,62/16 : 38,0/19
0,677143 : 0,65109 : 2 : 1,97625 ---> bagi dg angka terkecil
1,040014 : 1 : 3,07177 : 3,035293 ---> lakukan pembulatan
1 : 1 : 3 : 3
Jawabannya D. NSO3F3
OSK 2013 No 3
Soal 3. Tulang dan senyawa fosfat [24 poin]
Tulang dan gigi dibentuk dari senyawa kalsium fosfat yang mengandung unsur kalsium, fosfor dan oksigen. Kalsium fosfat dapat bereaksi dengan asam sulfat menghasilkan campuran kalsium sulfat dihidrat dan kalsium dihidrogenfosfat monohidrat yang dapat digunakan sebagai pupuk superfosfat. Kalsium fosfat juga dapat bereaksi dengan asam fosfat membentuk kalsium dihidrogenfosfat yang dikenal sebagai pupuk tripelfosfat. Jika ammonia direaksikan dengan asam fosfat terbentuk ammonium dihidrogen fosfat yang menjadi pupuk yang sangat efisien.

Tulang dan gigi dibentuk dari senyawa kalsium fosfat yang mengandung unsur kalsium, fosfor dan oksigen. Kalsium fosfat dapat bereaksi dengan asam sulfat menghasilkan campuran kalsium sulfat dihidrat dan kalsium dihidrogenfosfat monohidrat yang dapat digunakan sebagai pupuk superfosfat. Kalsium fosfat juga dapat bereaksi dengan asam fosfat membentuk kalsium dihidrogenfosfat yang dikenal sebagai pupuk tripelfosfat. Jika ammonia direaksikan dengan asam fosfat terbentuk ammonium dihidrogen fosfat yang menjadi pupuk yang sangat efisien.

OSK 2013 No 4
Soal 4. Kesetimbangan Kimia [18 poin]
Reaksi kesetimbangan berikut ini terjadi pada temperatur 686oC.
CO2 (g) + H2(g) CO(g) + H2O(g)
Dalam keadaan kesetimbangan, konsentrasi masing masing spesi yang berada dalam reaksi tersebut adalah:
[CO] = 0,050 M, [H2] = 0,045 M, [CO2] = 0,086 M, and [H2O] = 0,040 M.


Wednesday, March 27, 2013
termokimia
Bank Soal UN Energitika Kalor Reaksi
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Kalor Reaksi
(1) Soal Ebtanas Kimia Tahun 2001
Diketahui reaksi :
S (s) + O2 (g) → SO2 (g) ∆H1 = –299 kJ mol-1
SO2 (g) + 1/2 O2 (g) → SO3 (g) ∆H2 = X kJ mol-1
S (s) + 3/2 O2 (g) → SO3 (g) ∆H3 = –396 kJ mol-1
Besarnya X adalah...
A. –49,9 kJ mol-1
B. –97 kJ mol-1
C. –194 kJ mol-1
D. +49,9 kJ mol-1
E. +97 kJ mol-1
(2) Soal Ebtanas Kimia Tahun 2001
Diketahui energi ikatan dari
O – H = 464 kJ
O = O = 500 kJ
H – H = 436 kJ
Kalor yang diperlukan untuk menguraikan 9 gram air (Mr = 18) adalah...
A. 8 kJ
B. 121 kJ
C. 222 kJ
D. 242 kJ
E. 472 kJ
(4) Soal Ebtanas Kimia Tahun 2002
Berdasarkan diagram :

Perubahan entalpi untuk A2B → CD2 adalah...
A. ΔH1 + ΔH2 + ΔH3
B. − ΔH1 + ΔH2 + ΔH3
C. − ΔH1 − ΔH2 − ΔH3
D. ΔH1 − ΔH2 − ΔH3
E. − ΔH1 + ΔH2 − ΔH3
(5) Soal Ebtanas Kimia Tahun 2002
Diagram tahap reaksi pembentukan gas SO3 sebagai berikut:

Berdasarkan diagram tersebut harga ΔH2 adalah....
A. 790,4 kJ
B. 593,8 kJ
C. 196,6 kJ
D. − 196,6 kJ
E. − 593,8 kJ
(8) Soal Unas Kimia Tahun 2008
Diketahui energi ikatan rata-rata :
C≡C: 839 kJ/mol
C−C: 343 kJ/mol
H-H: 436 kJ/mol
C-H: 410 kJ/mol
Perubahan entalpi yang terjadi pada reaksi :
CH3 −C≡CH+2 H2 →CH3 −CH2 −CH3 sebesar ...
A. +272 kJ/mol
B. – 272 kJ/mol
C. – 1.711 kj/mol
D. – 1.983 kJ/mol
E. – 3.694 kJ/mol
Bank Soal UN Fenomena Korosi
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Korosi
(1) Soal Ujian Nasional Kimia Tahun 2004
Di daerah industri, udara dapat mengandung gas-gas SO2, CO2, O2, N2, CO dan H2O. Pasangan gas-gas yang dapat menyebabkan terjadinya korosi adalah...
A. O2 dan N2
B. CO dan N2
C. CO2 dan CO
D. SO2 dan H2O
E. CO dan H2O
(2) Soal Ujian Nasional Kimia Tahun 2008
Berikut ini percobaan logam besi (Fe) yang dihubungkan dengan logam lain. Masing-masing logam yang telah dihubungkan diletakkan di tempat yang sedikit lembab dan bersuasana asam, seperti gambar :

Besi yang akan mengalami korosi paling cepat yaitu percobaan nomor...
A. I
B. II
C. III
D. IV
E. V
(3) Soal Ujian Nasional Kimia Tahun 2009
Beberapa metode pencegahan korosi besi:
1. mengecat;
2. melumuri oli;
3. dibalut dengan plastik;
4. perlindungan katoda; dan
5. galvanisasi.
Metode yang paling tepat digunakan untuk melindungi pipa besi yang ada di dalam tanah adalah...
A. 1
B. 2
C. 3
D. 4
E. 5
(4) Soal Ujian Nasional Kimia Tahun 2010
Perhatikan gambar percobaan korosi berikut:

Paku yang mengalami korosi paling cepat terjadi pada nomor...
A. 1
B. 2
C. 3
D. 4
E. 5
kimia inti
Bank Soal UN Radioaktivitas
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Radioaktivitas
(1) Soal Ebtanas Tahun 2001
Isotop La-140 mula-mula 10 gram dan waktu paruhnya 40 hari. Setelah 120 hari La-140 yang tersisa adalah...
A. 1.25 gram
B. 2,50 gram
C. 3,75 gram
D. 5,00 gram
E. 6,25 gram
(2) Soal Ebtanas Tahun 2001
Uranium meluruh dengan persamaan :
23992U → 20782U + α + β Partikel α dan β yang dipancarkan berturut-turut sebanyak...
A. 6 dan 2
B. 6 dan 4
C. 7 dan 4
D. 8 dan 4
E. 8 dan 6
(3) Soal Ebtanas Tahun 2001
Radioisotop yang digunakan untuk sterilisasi alat-alat kedokteran adalah....
A. Cs-137
B. I-131
C. Co-60
D. Ca-47
E. Na-24
(4) Soal Ebtanas Tahun 2003
Pada reaksi inti :
23892U + 42He → 23994Pu + 3X maka X adalah...
A. proton
B. gamma
C. elektron
D. positron
E. neutron
(5) Soal Unas Tahun 2004
Perhatikan isotop-isotop berikut :
1. 2411Na
2. 2914Si
3. 3215P
4. 6026Fe
5. 6027Co
Isotop yang digunakan untuk mendeteksi efisiensi penggunaan pupuk dan terapi kanker adalah...
A. 1 dan 2
B. 2 dan 4
C. 1 dan 3
D. 3 dan 4
E. 3 dan 5
uji elektrolit
Sifat larutan - Daya hantar listrik
(1) Soal Ebtanas Tahun 2001
Data percobaan daya hantar listrik sebagai berikut:
Pasangan yang digolongkan zat elektrolit kuat dan non elektrolit berturut-turut adalah...
A. 1 dan 4
B. 1 dan 3
C. 1 dan 2
D. 2 dan 4
E. 2 dan 3
(3) Soal Ebtanas Tahun 2003
Berikut hasil percobaan:
Dari data yang termasuk elektrolit kuat adalah...
A. CaCl2 dan NaOH
B. CH3COOH dan CaCl2
C. CH3COOH dan C2H5OH
D. CH3COOH dan NH4OH
E. C2H5OH dan NH4OH
(4) Soal Ujian Nasional Tahun 2008
Perhatikan pengujian sifat elektrolit larutan-larutan berikut :

Pasangan larutan yang bersifat elektrolit kuat dan non elektrolit berturut-turut adalah....
A. 1 dan 2
B. 1 dan 5
C. 3 dan 4
D. 3 dan 5
E. 4 dan 5
(6) Soal UN Kimia Tahun 2011
Perhatikan gambar pengujian daya hantar larutan berikut ini !

Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut adalah....
A. 1 dan 2
B. 1 dan 3
C. 1 dan 5
D. 2 dan 3
E. 4 dan 5
(1) Soal Ebtanas Tahun 2001
Data percobaan daya hantar listrik sebagai berikut:
| Zat | Lampu | Pengamatan lain |
| 1 | Nyala terang | Banyak gelembung |
| 2 | Nyala redup | Banyak gelembung |
| 3 | Tidak menyala | Sedikit gelembung |
| 4 | Tidak menyala | Tidak ada gelembung |
Pasangan yang digolongkan zat elektrolit kuat dan non elektrolit berturut-turut adalah...
A. 1 dan 4
B. 1 dan 3
C. 1 dan 2
D. 2 dan 4
E. 2 dan 3
(3) Soal Ebtanas Tahun 2003
Berikut hasil percobaan:
| No. | Larutan | Lampu | Perubahan |
| 1 | CaCl2 0,10 M | nyala terang | banyak gas |
| 2 | CH3COOH 0,10 M | redup | sedikit gas |
| 3 | C2H5OH 0,10 M | padam | tidak ada gas |
| 4 | NaOH 0,10 M | nyala terang | banyak gas |
| 5 | NH4OH 0,10 M | padam | sedikit gas |
Dari data yang termasuk elektrolit kuat adalah...
A. CaCl2 dan NaOH
B. CH3COOH dan CaCl2
C. CH3COOH dan C2H5OH
D. CH3COOH dan NH4OH
E. C2H5OH dan NH4OH
(4) Soal Ujian Nasional Tahun 2008
Perhatikan pengujian sifat elektrolit larutan-larutan berikut :

Pasangan larutan yang bersifat elektrolit kuat dan non elektrolit berturut-turut adalah....
A. 1 dan 2
B. 1 dan 5
C. 3 dan 4
D. 3 dan 5
E. 4 dan 5
(6) Soal UN Kimia Tahun 2011
Perhatikan gambar pengujian daya hantar larutan berikut ini !

Larutan yang bersifat elektrolit kuat dan elektrolit lemah berturut-turut adalah....
A. 1 dan 2
B. 1 dan 3
C. 1 dan 5
D. 2 dan 3
E. 4 dan 5
uan pH
Bank Soal UN Konsep pH Larutan
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Kimia Study Center - Kumpulan contoh soal ujian nasional kimia tahun 2001 - 2011 tentang pH larutan.
Konsep pH Larutan
(1) Soal Ebtanas Tahun 2001
Asam lemah HA, pHnya = 3. Ka : HA = 1 × 10-5 Konsentrasi HA adalah....
A. 0,1 M
B. 0,01 M
C. 0,001 M
D. 0,0001 M
E. 0,00001 M
(3) Soal Ebtanas Tahun 2003
Besarnya konsentrasi H+ dari CH 3COOH 0,1 M adalah....(Ka CH3COOH = 10-5 )
A. 10-1 M
B. 10-2 M
C. 10-3 M
D. 2 × 10-4 M
E. 3 × 10-5 M
(5) Soal Ujian Nasional Tahun 2008
pH larutan yang mengandung 6 gram CH3COOH (Mr = 60) dan 0,1 mol CH3COONa (Ka =1,0×10-5) adalah...
A. 1
B. 5
C. 7
D. 9
E. 12
(8) Soal Ujian Nasional Tahun 2011
Perhatikan data pengujian pH beberapa sampel air limbah berikut!
Air limbah yang tercemar asam adalah...
A. P dan Q
B. Q dan T
C. R dan S
D. S dan T
E. T dan R
Konsep pH Larutan
(1) Soal Ebtanas Tahun 2001
Asam lemah HA, pHnya = 3. Ka : HA = 1 × 10-5 Konsentrasi HA adalah....
A. 0,1 M
B. 0,01 M
C. 0,001 M
D. 0,0001 M
E. 0,00001 M
(3) Soal Ebtanas Tahun 2003
Besarnya konsentrasi H+ dari CH 3COOH 0,1 M adalah....(Ka CH3COOH = 10-5 )
A. 10-1 M
B. 10-2 M
C. 10-3 M
D. 2 × 10-4 M
E. 3 × 10-5 M
(5) Soal Ujian Nasional Tahun 2008
pH larutan yang mengandung 6 gram CH3COOH (Mr = 60) dan 0,1 mol CH3COONa (Ka =1,0×10-5) adalah...
A. 1
B. 5
C. 7
D. 9
E. 12
(8) Soal Ujian Nasional Tahun 2011
Perhatikan data pengujian pH beberapa sampel air limbah berikut!
| Jenis Air Limbah | pH |
| P Q R S T |
8 5,5 7,6 9,4 4,7 |
Air limbah yang tercemar asam adalah...
A. P dan Q
B. Q dan T
C. R dan S
D. S dan T
E. T dan R
Read more: http://kimiastudycenter.com/bank-soal-un/19-bank-soal-un-konsep-ph-larutan#ixzz2OtfwX7rm
bahas uan
Soal Pembahasan UN Kimia 2012 No. 1-5
- Category: UN Kimia
- Written by kimiastudycenter
Berikut ini disajikan soal dan pembahasan UN Kimia untuk tahun 2012 paket A59 nomor 1 - 5.
Soal No. 1
Perhatikan tabel sistem periodik berikut!

Konfigurasi elektron unsur Q yang paling sesuai adalah....
A. 1s2 2s2 2p6 3s2 3p6
B. 1s2 2s2 2p6 3s2 3p4
C. 1s2 2s2 2p6 3s2 3p5
D. 1s2 2s2 2p6 3s2 3p6 4s2
E. 1s2 2s2 2p6 3s2 3p4 4s2 3d2
Pembahasan
Dari data pada gambar terlihat unsur Q berada pada periode 3 dan golongan VIA.

Jumlah kulit pada periode 3 adalah 3.
Elektron valensi pada golongan VI A adalah 6
Konfigurasi elektron yang cocok adalah sebagai berikut:
1s2 2s2 2p6 3s2 3p4
(3 kulit, 6 elektron valensi)
Informasi berikut ini digunakan untuk mengerjakan soal nomor 2 dan 3.
Soal No. 2
Nomor atom dari unsur X adalah....
A. 17
B. 18
C. 21
D. 26
E. 30
Pembahasan
Urutan tingkat energi orbital pada atom berelektron banyak adalah sebagai berikut:

Pengisian atau penataan elektron dalam atom mengikuti urutan di atas, dengan maksimum jumlah elektron pada masing-masing subkulit:
Subkulit s (1 orbital) → maksimum 2 elektron
Subkulit p (3 orbital) → maksimum 6 elektron
Subkulit d (5 orbital) → maksimum 10 elektron
Subkulit f (7 orbital) → maksimum 14 elektron
1s2 2s2 2p6 3s2 3p6 4s2 dan seterusnya.
Ar memiliki nomor atom 18 sehingga konfigurasi elektron untuk atom X adalah:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
|___________________|
18 elektron
Sehingga nomor atom X adalah 18 + 2 + 1 = 21
Soal No. 3
Unsur Y dalam sisitem periodik terletak pada golongan dan periode berturut-turut....
A. IIIA, 3
B. IIIB, 4
C. VA, 3
D. VIIA, 3
E. VIIB, 4
Pembahasan
Ne memiliki nomor atom 10, sehingga konfigurasi elektron untuk Y adalah
1s2 2s2 2p6 3s2 3p5
|___________________|
↓
3 kulit, 7 3lektron valensi
Periode : 3
Golongan : VIIA
Soal No. 4
Senyawa yang tersusun dari dua buah unsur 6X dan 17Y apabila berikatan akan memiliki bentuk molekul dan kepolaran berturut-turut adalah....
A. tetrahedral dan polar
B. bentuk V dan nonpolar
C. tetrahedral dan nonpolar
D. bentuk V dan nonpolar
E. trigonal bipiramida dan polar
Pembahasan
Konfigurasi elektron masing-masing unsur adalah:
6X = 1s2 2s2 2p2 → 2 elektron valensi
17Y = 1s2 2s2 2p6 3s2 3p5 → 7 elektron valensi
Ikatan yang terjadi adalah XY4 seperti gambar berikut:

Bentuk molekul yang terjadi adalah tetrahedral nonpolar (bentuk molekulnya simetris, untuk molekul polar, bentuk molekulnya tidak simetris)
Soal No. 5
Berikut ini data sifat fisik dari dua zat yang tak dikenal.
Berdasarkan data tersebut, jenis ikatan yang terdapat dalam senyawa Y dan Z berturut-turut adalah....
A. ion dan kovalen polar
B. ion dan ion
C. kovalen nonpolar dan ion
D. ion dan kovalen nonpolar
E. kovalen polar dan kovalen nonpolar
Pembahasan
Ciri-ciri ikatan kovalen polar, ikatan kovalen nonpolar dan ikatan ion:
Dari data Y berikatan kovalen nonpolar
-titik lelehnya rendah
-titik menghantar listrik
Dari data X berikatan ion
-titik lelehnya tinggi
-menghantarkan listrik
Soal No. 1
Perhatikan tabel sistem periodik berikut!

Konfigurasi elektron unsur Q yang paling sesuai adalah....
A. 1s2 2s2 2p6 3s2 3p6
B. 1s2 2s2 2p6 3s2 3p4
C. 1s2 2s2 2p6 3s2 3p5
D. 1s2 2s2 2p6 3s2 3p6 4s2
E. 1s2 2s2 2p6 3s2 3p4 4s2 3d2
Pembahasan
Dari data pada gambar terlihat unsur Q berada pada periode 3 dan golongan VIA.

Jumlah kulit pada periode 3 adalah 3.
Elektron valensi pada golongan VI A adalah 6
Konfigurasi elektron yang cocok adalah sebagai berikut:
1s2 2s2 2p6 3s2 3p4
(3 kulit, 6 elektron valensi)
Informasi berikut ini digunakan untuk mengerjakan soal nomor 2 dan 3.
Dua buah unsur mempunyai diagram orbital sebagai berikut:  dan  |
Soal No. 2
Nomor atom dari unsur X adalah....
A. 17
B. 18
C. 21
D. 26
E. 30
Pembahasan
Urutan tingkat energi orbital pada atom berelektron banyak adalah sebagai berikut:

Pengisian atau penataan elektron dalam atom mengikuti urutan di atas, dengan maksimum jumlah elektron pada masing-masing subkulit:
Subkulit s (1 orbital) → maksimum 2 elektron
Subkulit p (3 orbital) → maksimum 6 elektron
Subkulit d (5 orbital) → maksimum 10 elektron
Subkulit f (7 orbital) → maksimum 14 elektron
1s2 2s2 2p6 3s2 3p6 4s2 dan seterusnya.
Ar memiliki nomor atom 18 sehingga konfigurasi elektron untuk atom X adalah:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
|___________________|
18 elektron
Sehingga nomor atom X adalah 18 + 2 + 1 = 21
Soal No. 3
Unsur Y dalam sisitem periodik terletak pada golongan dan periode berturut-turut....
A. IIIA, 3
B. IIIB, 4
C. VA, 3
D. VIIA, 3
E. VIIB, 4
Pembahasan
Ne memiliki nomor atom 10, sehingga konfigurasi elektron untuk Y adalah
1s2 2s2 2p6 3s2 3p5
|___________________|
↓
3 kulit, 7 3lektron valensi
Periode : 3
Golongan : VIIA
Soal No. 4
Senyawa yang tersusun dari dua buah unsur 6X dan 17Y apabila berikatan akan memiliki bentuk molekul dan kepolaran berturut-turut adalah....
A. tetrahedral dan polar
B. bentuk V dan nonpolar
C. tetrahedral dan nonpolar
D. bentuk V dan nonpolar
E. trigonal bipiramida dan polar
Pembahasan
Konfigurasi elektron masing-masing unsur adalah:
6X = 1s2 2s2 2p2 → 2 elektron valensi
17Y = 1s2 2s2 2p6 3s2 3p5 → 7 elektron valensi
Ikatan yang terjadi adalah XY4 seperti gambar berikut:

Bentuk molekul yang terjadi adalah tetrahedral nonpolar (bentuk molekulnya simetris, untuk molekul polar, bentuk molekulnya tidak simetris)
Soal No. 5
Berikut ini data sifat fisik dari dua zat yang tak dikenal.
| Senyawa | Titik leleh (°C) | Daya Hantar Listrik Larutan |
| Y | 32 | Tidak Menghantarkan |
| Z | 804 | Menghantarkan |
Berdasarkan data tersebut, jenis ikatan yang terdapat dalam senyawa Y dan Z berturut-turut adalah....
A. ion dan kovalen polar
B. ion dan ion
C. kovalen nonpolar dan ion
D. ion dan kovalen nonpolar
E. kovalen polar dan kovalen nonpolar
Pembahasan
Ciri-ciri ikatan kovalen polar, ikatan kovalen nonpolar dan ikatan ion:
| Ikatan | Ciri-ciri |
| Kovalen polar | -titik leleh rendah -bentuk larutannya dapat menghantarkan listrik -bentuk lelehannya tidak dapat menghantar listrik |
| Kovalen nonpolar | -titik leleh rendah -bentuk larutannya tidak dapat menghantarkan listrik -bentuk lelehannya tidak dapat menghantarkan listrik |
| Ion | -titik lelehnya tinggi -bentuk larutannya dapat menghantarkan listrik -bentuk lelehannya dapat menghantarkan listrik |
Dari data Y berikatan kovalen nonpolar
-titik lelehnya rendah
-titik menghantar listrik
Dari data X berikatan ion
-titik lelehnya tinggi
-menghantarkan listrik
Read more: http://kimiastudycenter.com/un-kimia-sma/20-soal-pembahasan-un-kimia-2012-no-1-5#ixzz2OtffEMzj
uan atom
Bank Soal UN Struktur Atom
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Kimia Study Center - Kumpulan contoh soal ujian nasional kimia tahun 2002 - 2011 tentang struktur Atom.
Struktur Atom
(1) Soal Ebtanas Tahun 2001
Pasangan unsur - unsur berikut ini yang memiliki elektron valensi sama yaitu...
A. 3Li dan 13Al
B. 11Na dan 19K
C. 12Mg dan 30Zn
D. 5B dan 21Sc
E. 7N dan 17Cl
(2) Soal Ebtanas Tahun 2002
Unsur klor dengan lambang 3517Cl mengandung....
A. 17 n, 18 p
B. 17 n, 35 p
C. 18 n, 17 p
D. 18 n, 35 p
E. 35 n, 17 p
(3) Soal Ebtanas Tahun 2003
Jika diketahui nuklida 2311Na, maka jumlah elektron, proton dan neutron adalah....
A. 23 proton, 12 elektron, 11 neutron
B. 11 proton, 12 elektron, 23 neutron
C. 11 proton, 11 elektron, 12 neutron
D. 11 proton, 12 elektron, 11 neutron
E. 12 proton, 11 elektron, 11 neutron
(4) Soal Ebtanas Tahun 2003
Konfigurasi elektron yang benar untuk 24Cr adalah...
A. 1s2 2s2 3p2 3s2 3p6 4s2 3d4
B. 1s2 2s2 3p2 3s6 3p6 3d4 4s2
C. 1s2 2s2 3p2 3s2 3p6 4s2 4p4
D. 1s2 2s2 3p2 3s2 3p6 4s1 3d5
E. 1s2 2s2 3p2 3s2 3p6 3d2 4f6
(5) Soal Ebtanas Tahun 2003
Bilangan kuantum elektron terakhir dari unsur X dengan nomor atom 11 adalah....
A. n = 4, l = 0, m = -1, s = - 1/2
B. n = 4, l = 1, m = 0, s = + 1/2
C. n = 3, l = 0, m = 0, s = + 1/2
D. n = 3, l = 1, m = 0, s = - 1/2
E. n = 2, l = 0, m = 0, s = + 1/2
(6) Soal UN Kimia Tahun 2004
Konfigurasi elektron dari unsur dengan nomor atom 24 adalah...
A. (Ar) 3d4 4s2
B. (Ar) 3d5 4s1
C. (Ar) 3d3 4s2 4p1
D. (Ar) 3d3 4s1 4p2
E. (Ar) 3d4 4p2
(7) Soal UN Kimia Tahun 2008
Dua buah unsur memiliki notasi 2713X dan 35,517Y
Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah....
(Nomor atom Ar = 18, Kr = 36, Ne = 10)

(8) Soal UN Kimia Tahun 2009
Tiga buah unsur dengan notasi sebagai berikut :
2311P, 2412Q, 35,517R
Konfigurasi elektron unsur P adalah .... (Nomor atom Ne = 10, Ar = 18)
A. [Ne] 3s1
B. [Ne] 4s1
C. [Ar] 3s1
D. [Ar] 4s1
E. [Ar] 4s2 3d3
(9) Soal UN Kimia Tahun 2010
Diagram orbital 2 buah unsur sebagai berikut:

Nomor atom unsur X adalah....
A. 6
B. 16
C. 17
D. 24
E. 25
(10) Soal UN Kimia Tahun 2011
Konfigurasi elektron X2− dari suatu ion unsur 3216X adalah....
A. 1s22s22p63s23p2
B. 1s22s22p63s23p4
C. 1s22s22p63s23p6
D. 1s22s22p63s23p63d2
E. 1s22s22p63s23p23d2
Struktur Atom
(1) Soal Ebtanas Tahun 2001
Pasangan unsur - unsur berikut ini yang memiliki elektron valensi sama yaitu...
A. 3Li dan 13Al
B. 11Na dan 19K
C. 12Mg dan 30Zn
D. 5B dan 21Sc
E. 7N dan 17Cl
(2) Soal Ebtanas Tahun 2002
Unsur klor dengan lambang 3517Cl mengandung....
A. 17 n, 18 p
B. 17 n, 35 p
C. 18 n, 17 p
D. 18 n, 35 p
E. 35 n, 17 p
(3) Soal Ebtanas Tahun 2003
Jika diketahui nuklida 2311Na, maka jumlah elektron, proton dan neutron adalah....
A. 23 proton, 12 elektron, 11 neutron
B. 11 proton, 12 elektron, 23 neutron
C. 11 proton, 11 elektron, 12 neutron
D. 11 proton, 12 elektron, 11 neutron
E. 12 proton, 11 elektron, 11 neutron
(4) Soal Ebtanas Tahun 2003
Konfigurasi elektron yang benar untuk 24Cr adalah...
A. 1s2 2s2 3p2 3s2 3p6 4s2 3d4
B. 1s2 2s2 3p2 3s6 3p6 3d4 4s2
C. 1s2 2s2 3p2 3s2 3p6 4s2 4p4
D. 1s2 2s2 3p2 3s2 3p6 4s1 3d5
E. 1s2 2s2 3p2 3s2 3p6 3d2 4f6
(5) Soal Ebtanas Tahun 2003
Bilangan kuantum elektron terakhir dari unsur X dengan nomor atom 11 adalah....
A. n = 4, l = 0, m = -1, s = - 1/2
B. n = 4, l = 1, m = 0, s = + 1/2
C. n = 3, l = 0, m = 0, s = + 1/2
D. n = 3, l = 1, m = 0, s = - 1/2
E. n = 2, l = 0, m = 0, s = + 1/2
(6) Soal UN Kimia Tahun 2004
Konfigurasi elektron dari unsur dengan nomor atom 24 adalah...
A. (Ar) 3d4 4s2
B. (Ar) 3d5 4s1
C. (Ar) 3d3 4s2 4p1
D. (Ar) 3d3 4s1 4p2
E. (Ar) 3d4 4p2
(7) Soal UN Kimia Tahun 2008
Dua buah unsur memiliki notasi 2713X dan 35,517Y
Diagram orbital yang paling tepat untuk elektron terakhir dari unsur X adalah....
(Nomor atom Ar = 18, Kr = 36, Ne = 10)

(8) Soal UN Kimia Tahun 2009
Tiga buah unsur dengan notasi sebagai berikut :
2311P, 2412Q, 35,517R
Konfigurasi elektron unsur P adalah .... (Nomor atom Ne = 10, Ar = 18)
A. [Ne] 3s1
B. [Ne] 4s1
C. [Ar] 3s1
D. [Ar] 4s1
E. [Ar] 4s2 3d3
(9) Soal UN Kimia Tahun 2010
Diagram orbital 2 buah unsur sebagai berikut:

Nomor atom unsur X adalah....
A. 6
B. 16
C. 17
D. 24
E. 25
(10) Soal UN Kimia Tahun 2011
Konfigurasi elektron X2− dari suatu ion unsur 3216X adalah....
A. 1s22s22p63s23p2
B. 1s22s22p63s23p4
C. 1s22s22p63s23p6
D. 1s22s22p63s23p63d2
E. 1s22s22p63s23p23d2
Read more: http://kimiastudycenter.com/bank-soal-un/3-bank-soal-un-struktur-atom#ixzz2OteRoauM
uan ikatan
Bank Soal UN Ikatan Kimia
- Category: Bank Soal UN Kimia SMA
- Written by kimiastudycenter
Kimia Study Center - Kumpulan contoh soal ujian nasional kimia tahun 2002 - 2011 tentang ikatan kimia.
Ikatan Kimia
(1) Soal Ebtanas Tahun 2001
Senyawa dengan rumus molekul N2O, NO, NO2 berturut-turut mempunyai nama....
A. Nitrogen (IV) oksida, Nitrogen (II) oksida, Nitrogen (I) oksida
B. Nitrogen (II) oksida, Nitrogen (I) oksida, Nitrogen (IV) oksida
C. Nitrogen (II) oksida, Nitrogen (IV) oksida, Nitrogen (I) oksida
D. Nitrogen (I) oksida, Nitrogen (II) oksida, Nitrogen (IV) oksida
E. Nitrogen (I) oksida, Nitrogen (IV) oksida, Nitrogen (II) oksida
(2) Soal Ebtanas Tahun 2001
Rumus struktur Lewis asam nitrat adalah seperti disamping ini.

Ikatan kovalen koordinasi ditunjukkan oleh anak panah nomor....
A. 1
B. 2
C. 3
D. 4
E. 5
(3) Soal Ebtanas Tahun 2001
Diberikan pasangan kelompok senyawa berikut :
1. H2O dengan HCl
2. NH3 dengan HBr
3. NH3 dengan H2S
4. HF dengan H2O
5. NH3 dengan HF
Kelompok senyawa yang mempunyai ikatan hidrogen adalah...
A. 1 dan 2
B. 2 dan 3
C. 3 dan 4
D. 4 dan 5
E. 5 dan 1
(4) Soal Ebtanas Tahun 2002
Nomor atom unsur A, B, C, D dan E berturut-turut 6, 8, 9, 16, 19. Pasangan unsur yang dapat membentuk ikatan ion adalah pasangan antara unsur....
A. A dan C
B. C dan E
C. B dan B
D. D dan C
E. E dan B
(5) Soal Ebtanas Tahun 2003
Pasangan senyawa berikut yang mempunyai ikatan hidrogen adalah...
A. HCl dengan NaOH
B. H2O dengan H2S
C. KOH dengan H3PO4
D. HF dengan NH3
E. CH3COOH dengan H2SO4
(6) Soal Ebtanas Tahun 2003
Diantara senyawa berikut ini yang merupakan senyawa berikatan kovalen adalah....
A. NaCl, KI, Mg(OH)2
B. ZnSO4, HgO, CH3COOH
C. Cl2, CaO, O3
D. H2O, HCl, LiOH
E. H3PO4, CH3OH, CO2
(7) Soal Ebtanas Tahun 2004
Empat unsur A, B, C, D masing-masing mempunyai nomor atom 16, 17, 18, 19. Pasangan yang dapat membentuk ikatan ion adalah...
A. A dan B
B. A dan C
C. B dan D
D. B dan C
E. C dan D
(8) Soal UN Kimia Tahun 2008
Dua buah unsur memiliki notasi 2713X dan 35,517Y
Bila kedua unsur tersebut berikatan, maka rumus senyawa yang dihasilkan adalah....
A. XY2
B. XY3
C. X2Y
D. X3Y
E. X2Y3
(9) Soal UN Kimia Tahun 2008
Perhatikan data hasil percobaan berikut ini :
Berdasarkan data tersebut, maka dapat disimpulkan bahwa jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah ...
A. ionik dan kovalen non polar
B. kovalen polar dan ionik
C. kovalen non polar dan ionik
D. kovalen koordinasi dan logam
E. hidrogen dan kovalen
(10) Soal UN Kimia Tahun 2009
Unsur R dan unsur 19K dapat membentuk senyawa dengan rumus dan jenis ikatan berturut-turut...
A. R2K, ion
B. K2R, ion
C. KR2, kovalen
D. RK2, kovalen
E. KR, ion
(11) Soal UN Kimia Tahun 2009
Perhatikan data beberapa senyawa berikut :
Berdasarkan data maka jenis ikatan yang terdapat pada senyawa Y dan Z adalah...
A. ionik dan kovalen polar
B. ionik dan kovalen non polar
C. kovalen polar dan ionik
D. kovalen non polar dan ionik
E. kovalen non polar dan kovalen polar
(12) Soal UN Kimia Tahun 2010
Tabel berikut menunjukkan sifat-sifat senyawa Q dan R.

Dari data tersebut, ikatan yang terdapat dalam senyawa Q dan R berturut-turut adalah....
A. kovalen polar dan ion
B. kovalen non polar dan ion
C. kovalen non polar dan kovalen polar
D. kovalen koordinasi dan ion
E. kovalen non polar dan hidrogen
(13) Soal UN Kimia Tahun 2011
Senyawa M mempunyai sifat sebagai berikut:
1. mudah larut dalam air;
2. dapat menghantar listrik dalam fase cair; dan
3. titik didihnya dan titik lelehnya tinggi.
Jenis ikatan dalam senyawa M tersebut adalah....
A. kovalen polar
B. kovalen non polar
C. hidrogen
D. logam
E. ion
Ikatan Kimia
(1) Soal Ebtanas Tahun 2001
Senyawa dengan rumus molekul N2O, NO, NO2 berturut-turut mempunyai nama....
A. Nitrogen (IV) oksida, Nitrogen (II) oksida, Nitrogen (I) oksida
B. Nitrogen (II) oksida, Nitrogen (I) oksida, Nitrogen (IV) oksida
C. Nitrogen (II) oksida, Nitrogen (IV) oksida, Nitrogen (I) oksida
D. Nitrogen (I) oksida, Nitrogen (II) oksida, Nitrogen (IV) oksida
E. Nitrogen (I) oksida, Nitrogen (IV) oksida, Nitrogen (II) oksida
(2) Soal Ebtanas Tahun 2001
Rumus struktur Lewis asam nitrat adalah seperti disamping ini.

Ikatan kovalen koordinasi ditunjukkan oleh anak panah nomor....
A. 1
B. 2
C. 3
D. 4
E. 5
(3) Soal Ebtanas Tahun 2001
Diberikan pasangan kelompok senyawa berikut :
1. H2O dengan HCl
2. NH3 dengan HBr
3. NH3 dengan H2S
4. HF dengan H2O
5. NH3 dengan HF
Kelompok senyawa yang mempunyai ikatan hidrogen adalah...
A. 1 dan 2
B. 2 dan 3
C. 3 dan 4
D. 4 dan 5
E. 5 dan 1
(4) Soal Ebtanas Tahun 2002
Nomor atom unsur A, B, C, D dan E berturut-turut 6, 8, 9, 16, 19. Pasangan unsur yang dapat membentuk ikatan ion adalah pasangan antara unsur....
A. A dan C
B. C dan E
C. B dan B
D. D dan C
E. E dan B
(5) Soal Ebtanas Tahun 2003
Pasangan senyawa berikut yang mempunyai ikatan hidrogen adalah...
A. HCl dengan NaOH
B. H2O dengan H2S
C. KOH dengan H3PO4
D. HF dengan NH3
E. CH3COOH dengan H2SO4
(6) Soal Ebtanas Tahun 2003
Diantara senyawa berikut ini yang merupakan senyawa berikatan kovalen adalah....
A. NaCl, KI, Mg(OH)2
B. ZnSO4, HgO, CH3COOH
C. Cl2, CaO, O3
D. H2O, HCl, LiOH
E. H3PO4, CH3OH, CO2
(7) Soal Ebtanas Tahun 2004
Empat unsur A, B, C, D masing-masing mempunyai nomor atom 16, 17, 18, 19. Pasangan yang dapat membentuk ikatan ion adalah...
A. A dan B
B. A dan C
C. B dan D
D. B dan C
E. C dan D
(8) Soal UN Kimia Tahun 2008
Dua buah unsur memiliki notasi 2713X dan 35,517Y
Bila kedua unsur tersebut berikatan, maka rumus senyawa yang dihasilkan adalah....
A. XY2
B. XY3
C. X2Y
D. X3Y
E. X2Y3
(9) Soal UN Kimia Tahun 2008
Perhatikan data hasil percobaan berikut ini :
| No. | Sifat Fisik | Zat A | Zat B |
| 1 | Wujud zat | Padat | Padat |
| 2 | Kelarutan dalam air | Larut | Tidak larut |
| 3 | Daya hantar listrik larutan | Konduktor | Isolator |
| 4 | Titik leleh dan titik didih | Tinggi | Rendah |
Berdasarkan data tersebut, maka dapat disimpulkan bahwa jenis ikatan yang terdapat pada zat A dan zat B berturut-turut adalah ...
A. ionik dan kovalen non polar
B. kovalen polar dan ionik
C. kovalen non polar dan ionik
D. kovalen koordinasi dan logam
E. hidrogen dan kovalen
(10) Soal UN Kimia Tahun 2009
Unsur R dan unsur 19K dapat membentuk senyawa dengan rumus dan jenis ikatan berturut-turut...
A. R2K, ion
B. K2R, ion
C. KR2, kovalen
D. RK2, kovalen
E. KR, ion
(11) Soal UN Kimia Tahun 2009
Perhatikan data beberapa senyawa berikut :
| Simbol Senyawa | Titik leleh (°C) | Daya Hantar Listrik Larutannya |
| Y | 870 | Menghantarkan |
| X | −25 | Tidak Menghantarkan |
Berdasarkan data maka jenis ikatan yang terdapat pada senyawa Y dan Z adalah...
A. ionik dan kovalen polar
B. ionik dan kovalen non polar
C. kovalen polar dan ionik
D. kovalen non polar dan ionik
E. kovalen non polar dan kovalen polar
(12) Soal UN Kimia Tahun 2010
Tabel berikut menunjukkan sifat-sifat senyawa Q dan R.

Dari data tersebut, ikatan yang terdapat dalam senyawa Q dan R berturut-turut adalah....
A. kovalen polar dan ion
B. kovalen non polar dan ion
C. kovalen non polar dan kovalen polar
D. kovalen koordinasi dan ion
E. kovalen non polar dan hidrogen
(13) Soal UN Kimia Tahun 2011
Senyawa M mempunyai sifat sebagai berikut:
1. mudah larut dalam air;
2. dapat menghantar listrik dalam fase cair; dan
3. titik didihnya dan titik lelehnya tinggi.
Jenis ikatan dalam senyawa M tersebut adalah....
A. kovalen polar
B. kovalen non polar
C. hidrogen
D. logam
E. ion
Read more: http://kimiastudycenter.com/bank-soal-un/4-bank-soal-un-ikatan-kimia#ixzz2OteCJEm4
Ksp 4
KELARUTAN
DAN HASILKALI KELARUTAN
Kelas : XI-IPA
Sem : 1
Oleh
http://file-education.blogspot.com
Standar
Kompetensi
Memahami sifat-sifat larutan
asam-basa, metode pengukuran, dan terapannya.
Kompetensi Dasar
1.
Memprediksi terbentuknya endapan dari suatu reaksi berdasarkan
prinsip kelarutan dan hasil kali
kelarutan.
Indikator
1.
Menjelaskan
pengertian larutan tak jenuh, jenuh dan lewat jenuh
2.
Menjelaskan
kesetimbangan dalam larutan jenuh atau larutan garam yang sukar larut
3.
Menghubungkan
tetapan hasil kali kelarutan dengan tingkat kelarutan
4.
Menuliskan
persamaan Ksp berbagai zat elektrolit yang sukarlarut dalam air
5.
Menghitung
kelarutan suatu elektrolit yang sukar larut berdasarkan data harga Ksp atau
sebaliknya
6.
Menentukan pH larutan
dari harga Ksp-nya
7.
Menjelaskan
pengaruh penambahan ion senama dalam larutan
8.
Memperkirakan
terbentuknya endapan berdasarkan harga Ksp
9.
Menyimpulkan
kelarutan suatu garam
URAIAN
MATERI
1. Kelarutan
Ø Kelarutan adalah kemampuan suatu zat untuk melarut dalam
sejumlah pelarut. atau dapat dikatakan kelarutan menyatakan banyaknya zat
terlarut dalam tiap satu liter larutan pada suhu tertentu.
Ø Faktor-faktor yang mempengaruhi kelarutan
·
Suhu
Kenaikan suhu akan memutuskan ikatan pada kisi kristal
sehingga zat sukar larut menjadi larut sebagai akibat dari pergeseran
kesetimbangan
·
Tekanan
·
Adanya ion sejenis
Adanya ion sejenis akan memperkecil kelarutan karena
konsentrasi ion menjadi lebih besar sehingga kesetimbangan bergeser ke arah
kiri atau pereaksi (zat padat)
2.
Hasil Kali Kelarutan
Misal garam sukar
larut : AgCl.
Dalam larutan
terjadi kesetimbangan menurut reaksi :
AgCl(s) Ag+ (aq) + Cl-(aq)
Dalam keadaaan
kesetimbangan maka berlaku :
Ksp : tetapan hasil
kali kelarutan
Misal kelarutan AgCl = s mol/litert
Maka
AgCl(s)
Ag+ (aq) + Cl-(aq)
Kelarutan s s s
Ksp AgCl =
[Ag+] [Cl-]
Ksp AgCl =
s s
Ksp AgCl =
s2
Kelarutan (s) =
Untuk garam Ag2S jika kelarutannya : s
kesetimbangan kelarutan :
Ag2S(s) 2
Ag+ (aq) + S2-(aq)
Kelarutan s 2
s s
Ksp Ag2S = [Ag+]2 [Cl-]
Ksp Ag2S = (2s)2 s
Ksp Ag2S = 4 s2 s
Ksp Ag2S = 4 s3
s3 =
Untuk garam sukar larut. Ca3(PO4)2
Misal kelarutannya = s mol/liter
Reaksi ionisasi :
Ca3(PO4)2(s) 3 Ca2+(aq) + 2 PO43-(aq)
Kelarutan s 3 s 2 s
Ksp Ca3(PO4)2 = [Ca2+]3 [PO43-]2
Ksp Ca3(PO4)2 = (3 s)3 (2 s)2
Ksp Ca3(PO4)2 = 27 s3 4 s2
Ksp Ca3(PO4)2 = 108 s5
s5 =
Contoh 1
Diketahui Ksp Ag2CrO4 = 3,2 x 10-11
Hitunglah kelarutan Ag2CrO4 dalam air.
Penyelesaian
Misalnya kelarutan Ag2CrO4 = s mol/liter
Reaksi ionisasi :
Ag2CrO4 (s) 2 Ag+(aq) + CrO42-(aq)
Kelarutan s mol/lt
2 s mol/lt s mol/lt
Ksp Ag2CrO4 = [Ag+]2 [CrO42-]
=
(2 s ) 2 s = 4
s3
=
4 s3
mol/liter
Contoh 2
Diketahui kelarutan Mg(OH)2 ( Mr = 58) dalam air
pada suhu 25⁰C = 58 mgram per liter. Berapa Ksp Mg(OH)2?
Penyelesaian
Kelarutan Mg(OH)2 = 58 mgram = 0,058
gram
Mol Mg(OH)2 =
Kelarutan dalam mol/liter
(s) = 0,001 mol/lt. = 10-3 mol/lt
Reaksi : Mg(OH)2(s) Mg2+(aq) + 2 OH-(aq)
Kelarutan s s 2 s
Ksp Mg(OH)2 = [Mg2+] [OH-]2
= s (2 s) 2
=
4 s 3
Ksp Mg(OH)2 = 4
(10-3) 3
=
4 x 10-9
3.
Pengendapan
Hasil kali kelarutan yang terhitung merupakan hasil
kali kelarutan pada larutan jenuh artinya terjadi kesetimbangan antara zat
terlarut dengan endapannya.
Garam sukar larut :
AxBy (s) x Ay+ (aq) + y Bx- (aq)
Ksp AxBy = [Ay+]x [Bx-]y
[Ay+]x [Bx-]y = QC ( hasil kali konsentrasi)
Jika ;
QC = Ksp (larutan tepat jenuh)
QC < Ksp (larutan belum jenuh)
QC > Ksp (larutan lewat jenuh, terjadi pengendapan)
Contoh 1
Apa yang terjadi jika 100 ml larutan NaCl 0,01 M
ditambahkan ke dalam 100 ml larutan AgNO3 0,001, Diketahui Ksp AgCl =
1,44 x 10-9
Penyelesaian
Mol NaCl = V x M = 100 x 0,01 = 1 mmol
Mol AgNO3 = V x M = 100 x 0,001 = 0,1 mmol
Volume campiuran = 100 + 100 = 200 ml
Konsentrasi [Ag+] = [AgNO3] =
Konsentrasi [Cl-] = [NaCl] =
AgCl(s) Ag+ (aq) + Cl-(aq)
[Ag+] [Cl-] = (5 x 10-4) ( 5 x 10-3)
=
25 x 10-7
QC = 2,5 x 10-8
[Ag+] [Cl-] > Ksp AgCl
1,44 x 10-9
QC > Ksp (maka
akan terjadi pengendapan AgCl)
Contoh 2
Diketahui
Ksp Ca(OH)2 = 5 x 10-7.
Berapakah pH larutan jenuh Ca(OH) 2 ?
Penyelesaian :
Misal
kelarutan Ca(OH)2 = s
Reaksi : Ca(OH)2(s) Ca2+(aq) + 2 OH-(aq)
Kelarutan :
s s 2 s
Ksp Ca(OH)2 =
[Ca2+]2 [OH- ]2
=
s2 ( 2 s)2
Ksp Ca(OH)2 = 4 s3
mol/liter
Dari persamaan reaksi [OH-] = 2 s
[OH-] = 2 (5 x 10-3) = 10 x– 10-3 = 10-2
pOH = - log
[OH-]
=
- log (10-2) = -
(-2 x log 10) = 2 x 1 = 2
pH + pOH = 14
pH = 14 – pOH
pH = 14 – 2 = 12
4.
Pengaruh ion senama terhadap kelarutan
Suatu senyawa sukar larut AgCl.
Dalam larutan jenuhnya endapan AgCl ada dalam
kesetimbangan dengan ion-ionnya. :
AgCl(s) Ag+ (aq) + Cl-(aq)
Jika dalam sistem itu suda ada ion sejenis misalnya
ion Ag+, maka
kelarutan AgCl akan terhambat, sehingga kelarutan AgCl makin kecil.
Hal ini sesuai dengan azas Le Chatelier, adanya ion sejenis menambah konsentrasi ion
tersebut sehingga kesetimbangan akan bergeser ke arah pembentukan endapan AgCl.
Contoh 1
Jika Ksp AgCl = 1
x 10-12
Hitunglah
kelarutan AgCl dalam :
a.
air murni
b.
larutan NaCl
0,001M
c.
larutan NaCl 0,01
M
Penyelesaian
Misal kelarutan
AgCl adalah s mol/liter
Reaksi : AgCl(s) Ag+ (aq) + Cl-(aq)
Kelarutan : s s s
a.
kelarutan AgCl dalam
air murni
Ksp = [Ag+] x [ C-l]
Kelarutan AgCl (s) =
=
mol/liter
b.
Kelarutan AgCl
dalam NaCl 0,001 M
NaCl akan mengalami ionisasi :
NaCl(s) Na+ (aq) +
Cl-(aq)
0,001M 0,001M 0,001M
AgCl akan mengalami
ionisasi :
AgCl(s) Ag+ (aq) +
Cl-(aq)
Kelarutan : s s s
Konsntrasi ion Cl- dalam larutan = s + 0,001 M
Karena s sangat kecil maka diabaikan sehingga
[Cl- ] dalam larutan = 0,001 M = 10-3 M
[Ag] = s M
Ksp = [Ag+] x [ Cl- ]
1 x 10-12 = s x 10-3
Kelarutan AgCl (s) =
mol/liter
c.
kelarutan AgCl
dalam
NaCl akan mengalami ionisasi :
NaCl(s) Na+ (aq) +
Cl-(aq)
0,01M 0,01M 0,01M
AgCl akan
mengalami ionisasi :
AgCl(s) Ag+ (aq) +
Cl-(aq)
Kelarutan : s s s
Konsntrasi ion Cl- dalam larutan = s + 0,01 M
Karena s sangat kecil maka diabaikan sehingga
[Cl- ] dalam larutan = 0,01 M = 10-2 M
[Ag] = s mol/liter
Ksp = [Ag+] x [ Cl- ]
1 x 10-12 = s x 10-2
Kelarutan AgCl (s) =
mol/liter
Berdasarkan perhitungan di atas maka kelarutan AgCl dalam
air lebih besar dari pada dalam NaCl 0,001M.
Simpulan
Semakin besar konsentrasi ion sejenis semakin kecil
kelarutan garam tersebut atau adanya ion sejenis akan memperkelcil kelarutan
garam sukar larut.
:
SOAL LATIHAN
1.
Diketahui tabel hasil kali kelarutan garam perak sebagai
berikut :
Senyawa
|
Ksp
|
AgCl
|
2
x 10-10
|
AgBr
|
5
x 10-13
|
Ag2CO3
|
8
x 10-12
|
Ag2CrO4
|
6
x 10-13
|
Ag3PO4
|
1,8
x 10-18
|
Berdasarkan
data di atas garam perak yang paling mudah larut adalah ….
a.
AgCl
b.
AgBr
c.
Ag2CO3
d.
Ag2CrO4
e.
Ag3PO4 Ebtanas 1989
2.
Hasil kali kelarutan AgCl dalam air adalah 1,2 x 10-10, Mr AgCl =
143,5. maka kelarutan AgCl dalam air adalah…
a.
143,5 x 1,2 x 10-10 gram/liter
b.
143,5 x 1,2 x 10-10 mol/liter
c.
143,5
x
gram/liter
d.
143,5
x
mol/liter
e.
gram/liter
3.
Jika pada 25ºC Ksp AgCl = 1,96 x 10-10, Ar Ag = 108 Cl = 35,5. Kelarutan
perak klorida yang dinyatakan dalam gram per liter larutan pada suhu 25ºC
adalah ….
a.
2,296 x 10-4
b.
2,009 x 10-4
c.
1,720 x 10-4
d.
1,435 x 10-4
e.
2,090 x 10-5 Ebtanas 1990
4.
Diketahu harga hasil kali kelarutan (Ksp) beberapa
senyawa :
AgCl = 10-6 Ag2CrO4
= 10-12
Ag2S = 10-49 Ag2CO3 = 10-11
AgI = 10-16
Di
antara senyawa-senyawa tersebut yang paling sukar larut adalah ….
a.
AgCl
b.
Ag2CO3
c.
Ag2S
d.
AgI
e.
Ag2CrO4 Ebtanas
1991
5.
Pada suhu tertentu kelarutan PbCl2 dalam air = 2,5 x 10-2 M, maka hasil kali kelarutan (Ksp) PbCl2 adalah…
a.
6,25 x 10-6
b.
6,25
x 10-5
c.
6,25
x 10-4
d.
7,25
x 10-4
e.
7,50
x 10-4 Ebtanas
1992
6.
Larutan
jenuh senyawa hidroksida suatu logam M(OH)3 mempunyai pH = 9. Maka harga Ksp M(OH)3
adalah…..
a.
1,0
x 10-10
b.
3,0
x 10-20
c.
3,3
x 10-21
d.
3,0
x 10-36
e.
3,3
x 10-37 Ebtanas
1994
7.
Jika Ksp CaCO3 = 4,9 x 10-9 maka kelarutan garam tersebut dalam larutan Na2CO3 0,01 M adalah...
a.
7,0 x 10-5 mol/L
b.
7,0 x 10-3 mol/L
c.
7,0 x 10-7 mol/L
d.
4,9 x 10-7 mol/L
e.
4,9 x 10-11 mol/L
8.
Kelarutan CaF2 dalam air murni adalah 2 x 10-4 mol/L. Jika garam ini dilarutkan dalam larutan
CaCl2 0,1M maka
kelarutananya
menjadi....
a.
2,0 x 10-3 mol/L
b.
2,0 x 10-5 mol/L
c.
3,2 x 10-10 mol/L
d.
8,0 x 10-11 mol/L
e.
3,2 x 10-12 mol/L
9.
Jika Ksp Mg(OH)2 = 3,2 x 10-11 maka larutan jenuh Mg(OH)2 mempunyai pH ....
a.
10
+ log 4
b.
10
– log 4
c.
10
+ log 2
d.
10
– log 2
e.
4
– log 4
10.
Jika Ksp Ag2CO3 = 1,0 x
10-14 maka larutan jenuh Ag2CO3 dalam AgCl2 0,1 M adalah ...
a. 5,0
x 10-13 mol/L
b. 1,0
x 10-12 mol/L
c. 2,0
x 10-12 mol/L
d. 5,0
x 10-9 mol/L
e. 1,0
x 10-8 mol/L UN
2008
11.
Berikut nilai Ksp
beberapa senyawa
Ksp CaSO4 = 2,4 x 10-6
Ksp PbSO4 = 1,7 x 10-8
Ksp SrSO4 = 2,5 x 10-7
Ksp BaSO4 = 1,1 x 10-10
Ke dalam
4 tabung berisi masing-masing 100 mL larutan yang mengandung ion Ca2+ , Sr2+, Ba2+ dan Pb2+ dengan konsentrasi 1 x 10-4 M kemudian dicampurkan dengan larutan Na2SO4 0,001 M. Maka campuran yang menghasilkan garam
sulfat beruapa endapan adalah....
a.
CaSO4 dan SrSO4
b.
SrSO4 dan BaSO4
c.
BaSO4 dan PbSO4
d.
CaSO4 dan BaSO4
Daftar Pustaka
Arsyad M, Natsir, 2001, Kamus
Kimia;Arti dan Penjelasan istilah, Jakarta, Gramedia Pustaka
Depdiknas, 2004, Kompetensi Dasar
Kimia untu SMA/MA, Jakarta, BNSP
Depdiknas, 2006, Standar
Kompetensi dan Kompetensi Dasar SMA/MA, Jakarta, BNSP
Keenan, Charles W, et al. 2003. Kimia
untuk Universitas,Edisi ke-6, Jilid 2 dan 2, Jakrta, Erlanngga.
Petrucci, Ralph H, 1999, Kimia
Dasar 2, Jakarta, Erlangga.
Parning,dkk. 2007. Kimia 2. Jakarta,
Yudhistira
Purba, Michael.2006. Kimia Untuk
SMA Kelas XII. Jakrta. Erlangga
Sutresna, Nana, 1994.Kimiauntuk
SMU. Bandung, Ganeça Exact.
Suyanto,dkk. 2007. Kimia untuk
SMA/MA Kelas XI, Jakarta, Grasindo
Subscribe to:
Comments (Atom)












