Reaksi Redoks dan Elektrokimia
Pengertian
Reaksi kimia dapat digolongkan menjadi berbagai macam reaksi. Salah satu diantaranya adalah reaksi yang berkaitan dengan perubahan bilangan oksidasi dari atom-atom sebelum dan sesudah reaksi. Dari tinjauan bilangan oksidasi reaksi dapat dibedakan menjadi 2 jenis reaksi yaitu :- Golongan reaksi dimana atom-atom yang terlibat tidak mengalami perubahan bilangan oksidasi sebelum dan sesudah reaksi. Reaksi dimana atom-atom yang terlibat tidak mengalami perubahan bilangan oksidasi disebut reaksi bukan reduksi-oksidasi yang lazim disebut reaksi bukan redoks.
- Golongan reaksi dimana diantara atom-atom yang terlibat ada yang mengalami perubahan bilangan oksidasi. Sebelum dan sesudah reaksi bilangan oksidasi atom-atom yang terlibat tidak sama (berubah). Reaksi ini disebut reaksi reduksi-oksidasi (reaksi redoks)
- A. PENGERTIAN REAKSI REDOKS
CONTOH : REAKSI REDUKSI
Cu2+(aq) + 2e ® Cu (s) Ag+(aq) + e ® Ag(s)
CONTOH : REAKSI OKSIDASI
Zn(s) ® Zn2+(aq)+ 2e Al(s) ® Al3+(aq) + 3e
Aturan-aturan penentuan bilangan oksidasi :
- Atom-atom dalam unsur memiliki bilangan oksidasi nol
- Atom H dalam senyawa memiliki bilangan oksidasi +1
- Dalam hidrida logam (misal NaH, BaH2, AlH3) bilangan oksidasi H = -1
- Atom O dalam senyawa memiliki
- Dalam senyawa F2O, bilangan oksidasi O = +2
- Dalam peroksida (misal H2O2, Na2O2, BaO2) bilangan oksidasi O= -1
- Atom logam dalam senyawa memiliki bilangan oksidasi positif
- Jumlah bilangan oksidasi atom-atom dalam senyawa = Nol
- Jumlah bilangan oksidasi atom-atom dalam ion = muatan ion
- Jika dua atom berikatan, bilangan oksidasi negatif selalu dimiliki atom yang keelektronegatifannya lebih besar
- Oksidasi adalah peristiwa pelepasan elektron atau penambahan (kenaikan) bilangan oksidasi
- Reduksi adalah peristiwa penangkapan elektron atau pengurangan (penurunan) bilangan oksidasi
- Reduktor (pereduksi) adalah zat yang mengalami oksidasi atau zat yang melepaskan elektron, atau zat yang bilangan oksidasinya naik
- Oksidator adalah zat yang mengalami reduksi atau zat yang menangkap elektron atau zat yang bilangan oksidasinya turun
- Redoks adalah reaksi yang terdiri dari peristiwa reduksi dan oksidasi atau reaksi perubahan bilangan oksidasi
- Reaksi disproporsionasi (autoredoks) adalah reaksi redoks dimana hanya satu jenis atom yang mengalami reduksi dan oksidasi atau reaksi redoks dimana hanya satu jenis atom yang bilangan oksidasinya berubah
- Mol elektron adalah selisih bilangan oksidasi
1.METODE BILANGAN OKSIDASI
Langkah-langkah penyetaraan reaksi :
- Menentukan unsur yang mengalami oksidasi dan reduksi berdasarkan perubahan bilangan oksidasi tiap unsur
- Menyetarakan jumlah unsur yang mengalami redoks dengan menambahkan koefisien yang sesuai
- Menentukan besarnya kenaikan atau penurunan bilangan oksidasi dari unsur-unsur yang mengalami perubahan bilangan oksidasi
- Meneyetarakan perubahan bilangan oksidasi tersebut dengan memberikan koefisien yang sesuai
- Menyetarakan jumlah atom H dan O serta unsur-unsur yang lain

2 .METODE SETENGAH REAKSI (ION ELEKTRON)
Langkah-langkah penyetaraan reaksi:
- Menuliskan zat-zat yang mengalami reaksi redoks saja
- Memisahkan reaksi menjadi 2, setengah reaksi reduksi dan setengah reaksi oksidasi
- Menyetarakan atom-atom yang mengalami redoks, kecuali atom hydrogen (H) dan oksigen (O)
- Menyetarakan atom oksigen (O) dengan menambahkan molekul H2O ke ruas yang kekurangan oksigen
- Menyetarakan atom Hidrogen (H) dengan menambahkan ion H+ ke ruas yang kekurangan atom H
- Menyetarakan muatan dengan menambahkan elektron ke ruas yang memiliki muatan lebih positif
- Menyamakan jumlah elektron pada kedua persamaan setengah reaksi reduksi dan oksidasi
- Menyatukan kedua persamaan setengah reaksi menjadi reaksi redoks yang utuh
- Mengembalikan ke bentuk reaksi awal


PENGERTIAN SEL ELKTROKIMIA
Transfer elektron pada reaksi redoks dalam larutan berlangsung melalui kontak langsung antara partikel-partikel berupa atom , molekul atau ion yang saling serah terima elektron. Pembahasan transfer elektron melalui sirkuit luar sebagai gejala listrik, dan reaksi redoks yang seperti ini akan dipelajari pada elektrokimia.
Sel elektrokimia merupakan suatu sel atau tempat terjadinya aliran elektron yang disebabkan oleh perubahan energi kimia menjadi energi listrik atau sebaliknya. Sel ini dikelompokkan menjadi dua macam yaitu :
1. Sel Volta
2. Sel Elektrolisis
Sel Volta melibatkan perubahan energi kimia menjadi energi listrik sedangkan sel elektrolisis melibatkan perubahan energi listrik menjadi energi kimia. Bagaimanakah proses terjadinya perubahan energi tersebut?
SEL VOLTA
Sel Volta (sel galvani) memanfaatkan reaksi spontan (∆G < 0)
untuk membangkitkan energi listrik, selisih energi reaktan (tinggi)
dengan produk (rendah) diubah menjadi energi listrik. Sistem reaksi
melakukan kerja terhadap lingkungan
Sel Elektrolisa memanfaatkan energi listrik untuk menjalankan
reaksi non spontan (∆G > 0) lingkungan melakukan kerja terhadap
sistem
Kedua tipe sel menggunakan elektroda, yaitu zat yang menghantarkan
listrik antara sel dan lingkungan dan dicelupkan dalam elektrolit
(campuran ion) yang terlibat dalam reaksi atau yang membawa muatan.
KOMPONEN SEL VOLTA
Rangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) danALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik
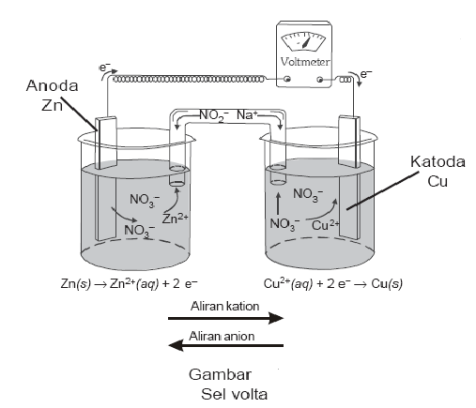
Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
Rangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) danALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik

Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
ELEKTRODA
Elektroda terbagi menjadi dua jenis yaitu anoda dan katoda
Setengah reaksi oksidasi terjadi di anoda. Elektron diberikan oleh
senyawa teroksidasi (zat pereduksi) dan meninggalkan sel melalui anoda
Setengah reaksi reduksi terjadi di katoda. Elektron diambil oleh
senyawa tereduksi (zat pengoksidasi) dan masuk sel melalui katoda.
Setengah sel oksidasi: anoda berupa batang logam Zn dicelupkan dalam ZnSO4
Setengah sel reduksi: katoda berupa batang logam Cu dicelupkan dalam CuSO4
Terbentuk muatan relatif pada kedua elektroda dimana anoda bermuatan negatif dan katoda bermuatan positif
Kedua sel juga dihubungkan oleh jembatan garam yaitu tabung
berbentuk U terbalik berisi pasta elektrolit yang tidak bereaksi dengan
sel redoks gunanya untuk menyeimbangkan muatan ion (kation dan anion)
Dimungkinkan menggunakan elektroda inaktif yang tidak ikut bereaksi dalam sel volta ini misalnya grafit dan platinum.
NOTASI SEL VOLTA
•Sel Volta dinotasikan dengan cara yang telah disepakati (untuk sel Zn/Cu2+)
Zn(s)|Zn2+(aq)║Cu2+(aq)|Cu(s)
Bagian anoda (setengah sel oksidasi) dituliskan disebelah kiri bagian katoda
Garis lurus menunjukkan batas fasa yaitu adanya fasa yang berbeda (aqueous vs solid) jika fasanya sama maka digunakan tanda koma
Untuk elektroda yang tidak bereaksi ditulis dalam notasi diujung kiri dan ujung kanan.
POTENSIAL SEL
Sel volta menjadikan perubahan energi bebas reaksi spontan menjadi energi listrik
Energi listrik ini berbanding lurus dengan beda potensial antara
kedua elektroda (voltase) atau disebut juga potensial sel (Esel) atau
gaya electromotive (emf)
Untuk proses spontan Esel > 0, semakin positif Esel semakin banyak kerja yang bisa dilakukan oleh sel
Satuan yang dgunakan 1 V = 1 J/C
Potensial sel sangat dipengaruhi oleh suhu dan konsentrasi, oleh
karena itu potensial sel standar diukur pada keadaan standar (298 K, 1
atm untuk gas, 1 M untuk larutan dan padatan murni untuk solid).
POTENSIAL SEL STANDAR
Potensial elektroda standar adalah potensial yang terkait dengan setengah reaksi yang ada (wadah elektroda)
Menurut kesepakatan potensial elektroda standar selalu ditulis dalam setengah reaksi reduksi
Bentuk teroksidasi + ne à bentuk tereduksi E 1/2 sel
Potensial elektroda standar seperti halnya besaran termodinamika dapat dibalik dengan mengubah tandanya
E sel = E katoda – E anoda
Ilmuwan telah menyepakati untuk memilih setengah reaksi rujukan dengan nilai 0 untuk reaksi:
2H+(aq, 1 M) + 2e à H2(g, 1 atm) Eorujukan = 0H2(g, 1 atm) à 2H+(aq, 1 M) + 2e –Eorujukan = 0
Dengan nilai rujukan ini kita bisa menyusun sel volta yang
menggunakan elektroda hidrogen standar sebagai salah satu elektrodanya
dan mengukur potensial sel dengan alat ukur, kemudian kita dapat
menentukan potensial elektroda standar banyak zat secara luas.
Semua nilai adalah relatif terhadap elektroda hidrogen standar (referensi)
2H+ (aq, 1 M) + 2e Û H2 (g, 1 atm)
Menurut konvensi semua setengah reaksi ditulis sebagai reaksi
reduksi artinya semua reaktan pengoksidasi dan semua produk pereduksi
Nilai Eo yang diberikan adalah setengah reaksi tertulis, semakin
positif nilainya semakin besar kecenderungan reaksi tersebut terjadi
Nilai Eo memiliki nilai yang sama tetapi berbeda tanda jika reaksinya kita balik
Berdasarkan tabel semakin keatas semakin oksidator dan semakin kebawah semakin reduktor.
REAKSI REDOKS SPONTAN
Setiap reaksi redoks adalah jumlah dari kedua setengah reaksi, sehingga akan ada reduktor dan oksidator ditiap-tiap sisi reaksi
Berdasarkan tabel maka reaksi spontan (Eosel> 0) akan terjadi
antara oksidator (sisi reaktan) dan reduktor (sisi produk) yang terletak
dibawahnya
Misal Cu2+ (kiri) dan Zn (kanan) bereaksi spontan dan Zn terletak dibawah Cu2+
Logam yang dapat menggantikan H2 dari asam. Ambil salah satu logam,
tuliskan reaksi oksidasinya lalu jumlah untuk memperoleh Eosel jika
positif maka H2 akan terlepas
Logam yang tidak dapat menggantikan H2, dengan langkah yang sama, namun jika hasilnya Eosel < 0, maka reaksi tidak spontan
Logam yang dapat menggantikan H2 dari air, logam yang terletak dibawah reduksi air
Logam yang dapat menggantikan logam lain dari larutannya, yaitu
logam yang terletak dibagian bawah tabel dapat mereduksi logam yang
terletak dibagian atas tabel.
Pengaruh Konsentrasi terhadap Potensial Sel
Sejauh ini potensial sel standar diukur dari potensial setengah sel
juga pada keadaan standar sementara kebanyakan sel volta tidak
beroperasi pada keadaan standarnya
Berdasarkan persamaan yang telah diketahui:
∆G = ∆Go + RT ln Q sedangkan∆G = -nFEsel juga ∆Go = -nFEosel sehingga
-nFEsel = -nFEosel + RT ln Q
Esel = Eosel – (RT/nF) ln Q
Aplikasi Persamaan Nernst
Saat Q < 1 sehingga [reaktan] > [produk] maka Esel > Eosel
Saat Q = 1 sehingga [reaktan] = [produk] maka Esel = Eosel
Saat Q > 1 sehingga [reaktan] < [produk] maka Esel < Eosel
Jika kita memasukkan nilai R dan T pada 298
Esel = Eosel – (0,0592 V/n) log Q (pada 25oC)SEL ELEKTROLISIS
Dalam tulisan ini, kita akan mempelajari tentang reaksi-reaksi sel elektrolisis (aspek kualitatif). Kemudian kita akan menghitung massa endapan logam dan volume gas yang dihasilkan dari reaksi elektrolisis (aspek kuantitatif). Kita juga akan mempelajari pengaruh besarnya arus listrik terhadap kuantitas produk elektrolisis yang dihasilkan. Sel Elektrolisis adalah
sel yang menggunakan arus listrik untuk menghasilkan reaksi redoks yang
diinginkan dan digunakan secara luas di dalam masyarakat kita. Baterai
aki yang dapat diisi ulang merupakan salah satu contoh aplikasi sel
elektrolisis dalam kehidupan sehari-hari (lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel Volta). Baterai aki yang sedang diisi kembali (recharge) mengubah energi listrik yang diberikan menjadi produk berupa bahan kimia yang diinginkan. Air, H2O,
dapat diuraikan dengan menggunakan listrik dalam sel elektrolisis.
Proses ini akan mengurai air menjadi unsur-unsur pembentuknya. Reaksi
yang terjadi adalah sebagai berikut : 2 H2O(l) ——> 2 H2(g) + O2(g)
Sel Elektrolisis adalah
sel yang menggunakan arus listrik untuk menghasilkan reaksi redoks yang
diinginkan dan digunakan secara luas di dalam masyarakat kita. Baterai
aki yang dapat diisi ulang merupakan salah satu contoh aplikasi sel
elektrolisis dalam kehidupan sehari-hari (lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel Volta). Baterai aki yang sedang diisi kembali (recharge) mengubah energi listrik yang diberikan menjadi produk berupa bahan kimia yang diinginkan. Air, H2O,
dapat diuraikan dengan menggunakan listrik dalam sel elektrolisis.
Proses ini akan mengurai air menjadi unsur-unsur pembentuknya. Reaksi
yang terjadi adalah sebagai berikut : 2 H2O(l) ——> 2 H2(g) + O2(g)Rangkaian sel elektrolisis hampir menyerupai sel volta. Yang membedakan sel elektrolisisdari sel volta adalah, pada sel elektrolisis, komponen voltmeter diganti dengan sumber arus (umumnya baterai). Larutan atau lelehan yang ingin dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin dielektrolisis. Elektroda yang digunakan umumnya merupakan elektroda inert, seperti Grafit (C), Platina (Pt), dan Emas (Au). Elektroda berperan sebagai tempat berlangsungnya reaksi. Reaksireduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung di anoda. Kutub negatif sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub positif sumber arus tentunya mengarah pada anoda. Akibatnya, katoda bermuatan negatif dan menarik kation-kation yang akan tereduksi menjadi endapan logam. Sebaliknya,anoda bermuatan positif dan menarik anion-anion yang akan teroksidasi menjadi gas. Terlihat jelas bahwa tujuan elektrolisis adalah untuk mendapatkan endapan logam di katoda dan gas di anoda.

Ada dua tipe elektrolisis, yaitu elektrolisis lelehan (leburan) dan elektrolisis larutan. Pada proses elektrolisis lelehan, kation pasti tereduksi di katoda dan anion pasti teroksidasi di anoda. Sebagai contoh, berikut ini adalah reaksi elektrolisis lelehan garam NaCl (yang dikenal dengan istilah sel Downs) :
Katoda (-) : 2 Na+(l) + 2 e– ——> 2 Na(s) ……………….. (1)
Anoda (+) : 2 Cl–(l) Cl2(g) + 2 e– ……………….. (2)
Reaksi sel : 2 Na+(l) + 2 Cl–(l) ——> 2 Na(s) + Cl2(g) ……………….. [(1) + (2)]


Reaksi elektrolisis lelehan garam NaCl menghasilkan endapan logam natrium di katoda dan gelembung gas Cl2 di anoda. Bagaimana halnya jika lelehan garam NaCl diganti denganlarutan garam NaCl? Apakah proses yang terjadi masih sama? Untuk mempelajari reaksielektrolisis larutan garam NaCl, kita mengingat kembali Deret Volta (lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel Volta).
Pada katoda, terjadi persaingan antara air dengan ion Na+. Berdasarkan Tabel Potensial Standar Reduksi, air memiliki E°red yang lebih besar dibandingkan ion Na+. Ini berarti, air lebih mudah tereduksi dibandingkan ion Na+. Oleh sebab itu, spesi yang bereaksi di katodaadalah air. Sementara, berdasarkan Tabel Potensial Standar Reduksi, nilai E°red ion Cl– dan air hampir sama. Oleh karena oksidasi air memerlukan potensial tambahan (overvoltage), makaoksidasi ion Cl– lebih mudah dibandingkan oksidasi air. Oleh sebab itu, spesi yang bereaksi di anoda adalah ion Cl–. Dengan demikian, reaksi yang terjadi pada elektrolisis larutan garam NaCl adalah sebagai berikut :
Katoda (-) : 2 H2O(l) + 2 e– ——> H2(g) + 2 OH–(aq) ………… (1)
Anoda (+) : 2 Cl–(aq) ——> Cl2(g) + 2 e– ……………….. (2)
Reaksi sel : 2 H2O(l) + 2 Cl–(aq) ——> H2(g) + Cl2(g) + 2 OH–(aq) ……………………. [(1) + (2)]

Reaksi elektrolisis larutan garam NaCl menghasilkan gelembung gas H2 dan ion OH‑ (basa) di katoda serta gelembung gas Cl2 di anoda. Terbentuknya ion OH– pada katoda dapat dibuktikan dengan perubahan warna larutan dari bening menjadi merah muda setelah diberi sejumlah indikator fenolftalein (pp). Dengan demikian, terlihat bahwa produk elektrolisis lelehan umumnya berbeda dengan produk elektrolisis larutan.

Selanjutnya kita mencoba mempelajari elektrolisis larutan Na2SO4. Pada katoda, terjadi persaingan antara air dan ion Na+. Berdasarakan nilai E°red, maka air yang akan tereduksi dikatoda. Di lain sisi, terjadi persaingan antara ion SO42- dengan air di anoda. Oleh karena bilangan oksidasi S pada SO4-2 telah mencapai keadaan maksimumnya, yaitu +6, maka spesi SO42- tidak dapat mengalami oksidasi. Akibatnya, spesi air yang akan teroksidasi dianoda. Reaksi yang terjadi adalah sebagai berikut :
Katoda (-) : 4 H2O(l) + 4 e– ——> 2 H2(g) + 4 OH–(aq) ……….. (1)
Anoda (+) : 2 H2O(l) ——> O2(g) + 4 H+(aq) + 4 e– ……………….. (2)
Reaksi sel : 6 H2O(l) ——> 2 H2(g) + O2(g) + 4 H+(aq) + 4 OH–(aq) …………………….. [(1) + (2)] 6 H2O(l) ——> 2 H2(g) + O2(g) + 4 H2O(l) …………………. [(1) + (2)]
2 H2O(l) ——> 2 H2(g) + O2(g) …………………….. [(1) + (2)]

Dengan demikian, baik ion Na+ maupun SO42-, tidak bereaksi. Yang terjadi justru adalah peristiwa elektrolisis air menjadi unsur-unsur pembentuknya. Hal yang serupa juga ditemukan pada proses elektrolisis larutan Mg(NO3)2 dan K2SO4.
Bagaimana halnya jika elektrolisis lelehan maupun larutan menggunakan elektroda yang tidak inert, seperti Ni, Fe, dan Zn? Ternyata, elektroda yang tidak inert hanya dapat bereaksi di anoda, sehingga produk yang dihasilkan di anoda adalah ion elektroda yang larut (sebab logam yang tidak inert mudah teroksidasi). Sementara, jenis elektroda tidak mempengaruhi produk yang dihasilkan di katoda. Sebagai contoh, berikut adalah proses elektrolisis larutan garam NaCl dengan menggunakan elektroda Cu :
Katoda (-) : 2 H2O(l) + 2 e– ——> H2(g) + 2 OH–(aq) …………………….. (1)
Anoda (+) : Cu(s) ——> Cu2+(aq) + 2 e– …………………….. (2)
Reaksi sel : Cu(s) + 2 H2O(l) ——> Cu2+(aq) + H2(g) + 2 OH–(aq) …………………….. [(1) + (2)]
Dari pembahasan di atas, kita dapat menarik beberapa kesimpulan yang berkaitan dengan reaksi elektrolisis :
- Baik elektrolisis lelehan maupun larutan, elektroda inert tidak akan bereaksi; elektroda tidak inert hanya dapat bereaksi di anoda
- Pada elektrolisis lelehan, kation pasti bereaksi di katoda dan anion pasti bereaksi di anoda
- Pada elektrolisis larutan, bila larutan mengandung ion alkali, alkali tanah, ion aluminium, maupun ion mangan (II), maka air yang mengalami reduksi di katoda
- Pada elektrolisis larutan, bila larutan mengandung ion sulfat, nitrat, dan ion sisa asam oksi, maka air yang mengalami oksidasi di anoda
 Salah satu aplikasi sel elektrolisis adalah pada proses yang disebut penyepuhan. Dalam proses penyepuhan,
logam yang lebih mahal dilapiskan (diendapkan sebagai lapisan tipis)
pada permukaan logam yang lebih murah dengan cara elektrolisis. Baterai
umumnya digunakan sebagai sumber listrik selama proses penyepuhanberlangsung. Logam yang ingin disepuh berfungsi sebagai katoda dan lempeng perak (logam pelapis) yang merupakan logam penyepuh berfungsi sebagai anoda.
Larutan elektrolit yang digunakan harus mengandung spesi ion logam yang
sama dengan logam penyepuh (dalam hal ini, ion perak). Pada proses
elektrolisis, lempeng perak di anoda akan teroksidasi dan larut menjadi
ion perak. Ion perak tersebut kemudian akan diendapkan sebagai lapisan
tipis pada permukaan katoda. Metode ini relatif mudah dan tanpa biaya
yang mahal, sehingga banyak digunakan pada industri perabot rumah tangga
dan peralatan dapur.
Salah satu aplikasi sel elektrolisis adalah pada proses yang disebut penyepuhan. Dalam proses penyepuhan,
logam yang lebih mahal dilapiskan (diendapkan sebagai lapisan tipis)
pada permukaan logam yang lebih murah dengan cara elektrolisis. Baterai
umumnya digunakan sebagai sumber listrik selama proses penyepuhanberlangsung. Logam yang ingin disepuh berfungsi sebagai katoda dan lempeng perak (logam pelapis) yang merupakan logam penyepuh berfungsi sebagai anoda.
Larutan elektrolit yang digunakan harus mengandung spesi ion logam yang
sama dengan logam penyepuh (dalam hal ini, ion perak). Pada proses
elektrolisis, lempeng perak di anoda akan teroksidasi dan larut menjadi
ion perak. Ion perak tersebut kemudian akan diendapkan sebagai lapisan
tipis pada permukaan katoda. Metode ini relatif mudah dan tanpa biaya
yang mahal, sehingga banyak digunakan pada industri perabot rumah tangga
dan peralatan dapur.Setelah kita mempelajari aspek kualitatif reaksi elektrolisis, kini kita akan melanjutkan dengan aspek kuantitatif sel elektrolisis. Seperti yang telah disebutkan di awal, tujuan utama elektrolisis adalah untuk mengendapkan logam dan mengumpulkan gas dari larutan yang dielektrolisis. Kita dapat menentukan kuantitas produk yang terbentuk melalui konsep mol dan stoikiometri.
Satuan yang sering ditemukan dalam aspek kuantitatif sel elektrolisis adalah Faraday (F). Faraday didefinisikan sebagai muatan (dalam Coulomb) mol elektron. Satu Faraday equivalen dengan satu mol elektron. Demikian halnya, setengah Faraday equivalen dengan setengah mol elektron. Sebagaimana yang telah kita ketahui, setiap satu mol partikel mengandung 6,02 x 1023partikel. Sementara setiap elektron mengemban muatan sebesar 1,6 x 10-19 C. Dengan demikian :
1 Faraday = 1 mol elektron = 6,02 x 1023 partikel elektron x 1,6 x 10-19 C/partikel elektron
1 Faraday = 96320 C (sering dibulatkan menjadi 96500 C untuk mempermudah perhitungan)
Hubungan antara Faraday dan Coulomb dapat dinyatakan dalam persamaan berikut :
Faraday = Coulomb / 96500
Coulomb = Faraday x 96500
Coulomb adalah satuan muatan listrik. Coulomb dapat diperoleh melalui perkalian arus listrik (Ampere) dengan waktu (detik). Persamaan yang menunjukkan hubungan Coulomb, Ampere, dan detik adalah sebagai berikut :
Coulomb = Ampere x Detik
Q = I x t
Dengan demikian, hubungan antara Faraday, Ampere, dan detik adalah sebagai berikut :
Faraday = (Ampere x Detik) / 96500
Faraday = (I x t) / 96500
Dengan mengetahui besarnya Faraday pada reaksi elektrolisis, maka mol elektron yang dibutuhkan pada reaksi elektrolisis dapat ditentukan. Selanjutnya, dengan memanfaatkan koefisien reaksi pada masing-masing setengah reaksi di katoda dan anoda, kuantitas produk elektrolisis dapat ditemukan.
Hukum Faraday I :

Hukum Faraday II :

Berikut ini adalah beberapa contoh soal aspek kuantitatif sel elektrolisis :
1. Pada elektrolisis larutan AgNO3 dengan elektroda inert dihasilkan gas oksigen sebanyak 5,6 L pada STP. Berapakah jumlah listrik dalam Coulomb yang dialirkan pada proses tersebut?
Penyelesaian :
Reaksi elektrolisis larutan AgNO3 dengan elektroda inert adalah sebagai berikut :
Katoda (-) : Ag+ + e– ——> Ag
Anoda (+) : 2 H2O(l) ——> O2(g) + 4 H+(aq) + 4 e–
Gas O2 terbentuk di anoda. Mol gas O2 yang terbentuk sama dengan 5,6 L / 22,4 L = ¼ mol O2
Berdasarkan persamaan reaksi di anoda, untuk menghasilkan ¼ mol gas O2, maka jumlah mol elektron yang terlibat adalah sebesar 4 x ¼ = 1 mol elektron.
1 mol elektron = 1 Faraday = 96500 C
Jadi, jumlah listrik yang terlibat adalah sebesar 96500 C
2. Unsur Fluor dapat diperoleh dengan cara elektrolisis lelehan NaF. Berapakah waktu yang diperlukan untuk mendapatkan 15 L gas fluorin ( 1 mol gas mengandung 25 L gas) dengan arus sebesar 10 Ampere?
Penyeleasian :
Reaksi elektrolisis lelehan NaF adalah sebagai berikut :
K (-) : Na+(l) + e– ——> Na(s)
A (-) : 2 F–(l) ——> F2(g) + 2 e–
Gas F2 terbentuk di anoda. Mol gas F2 yang terbentuk adalah sebesar 15 L / 25 L = 0,6 mol F2
Berdasarkan persamaan reaksi di anoda, untuk menghasilkan 0,6 mol gas F2, akan melibatkan mol elektron sebanyak 2 x 0,6 = 1,2 mol elektron
1,2 mol elektron = 1,2 Faraday
Waktu yang diperlukan dapat dihitung melalui persamaan berikut :
Faraday = (Ampere x Detik) / 96500
1,2 = (10 x t) / 96500
t = 11850 detik = 3,22 jam
Jadi, diperlukan waktu selama 3,22 jam untuk menghasilkan 15 L gas fluorin
3. Arus sebesar 0,452 A dilewatkan pada sel elektrolisis yang mengandung lelehan CaCl2 selama 1,5 jam. Berapakah jumlah produk yang dihasilkan pada masing-masing elektroda?
Penyelesaian :
Reaksi elektrolisis lelehan CaCl2 adalah sebagai berikut :
K (-) : Ca2+(l) + 2 e– ——> Ca(s)
A (+) : 2 Cl–(l) ——> Cl2(g) + 2 e–
Mol elektron yang terlibat dalam reaksi ini dapat dihitung dengan persamaan berikut :
Faraday = (Ampere x Detik) / 96500
Faraday = (0,452 x 1,5 x 3600) / 96500 mol elektron
Berdasarkan persamaan reaksi di katoda, mol Ca yang dihasilkan adalah setengah dari mol elektron yang terlibat. Dengan demikian, massa Ca yang dihasilkan adalah :
Massa Ca = mol Ca x Ar Ca
Massa Ca = ½ x (0,452 x 1,5 x 3600) / 96500 x 40 = 0,506 gram Ca
Berdasarkan persamaan reaksi di anoda, mol gas Cl2 yang dihasilkan adalah setengah dari mol elektron yang terlibat. Dengan demikian, volume gas Cl2 (STP) yang dihasilkan adalah :
Volume gas Cl2 = mol Cl2 x 22,4 L
Volume gas Cl2 = ½ x (0,452 x 1,5 x 3600) / 96500 x 22.4 L = 0,283 L gas Cl2
Jadi, produk yang dihasilkan di katoda adalah 0,506 gram endapan Ca dan produk yang dihasilkan di anoda adalah 0,283 L gas Cl2 (STP)
4. Dalam sebuah percobaan elektrolisis, digunakan dua sel yang dirangkaikan secara seri. Masing-masing sel menerima arus listrik yang sama. Sel pertama berisi larutan AgNO3, sedangkan sel kedua berisi larutan XCl3. Jika setelah elektrolisis selesai, diperoleh 1,44 gram logam Ag pada sel pertama dan 0,12 gram logam X pada sel kedua, tentukanlah massa molar (Ar) logam X tersebut!
Penyelesaian :
Reaksi elektrolisis larutan AgNO3 :
K (-) : Ag+(aq) + e– ——> Ag(s)
A (+) : 2 H2O(l) ——> O2(g) + 4 H+(aq) + 4 e–
Logam Ag yang dihasilkan sebanyak 1,44 gram; dengan demikian, mol logam Ag yang dihasilkan sebesar 1,44 / 108 mol Ag
Berdasarkan persamaan reaksi di katoda, mol elektron yang dibutuhkan untuk menghasilkan logam Ag sama dengan mol logam Ag (koefisien reaksinya sama)
Sehingga, mol elektron yang digunakan dalam proses elektrolisis ini adalah sebesar 1,44 / 108 mol elektron
Reaksi elektrolisis larutan XCl3 :
K (-) : X3+(aq) + 3 e– ——> X(s)
A (+) : 2 Cl–(l) ——> Cl2(g) + 2 e–
Arus yang sama dialirkan pada sel kedua, sehingga, mol elektron yang digunakan dalam proses elektrolisis ini sama seperti sebelumya, yaitu sebesar 1,44 / 108 mol elektron
Berdasarkan persamaan reaksi di katoda, mol logam X yang dihasilkan sama dengan 1 / 3 kali mol elektron, yaitu sebesar 1 / 3 x 1,44 / 108 mol X
Massa logam X = 0,12 gram; dengan demikian, massa molar (Ar) logam X adalah sebagai berikut:
mol = massa / Ar
Ar = massa / mol
Ar = 0,12 / (1 / 3 x 1,44 / 108) = 27
Jadi, Ar dari logam X adalah 27
Materi juga dapat di lihat disini






No comments:
Post a Comment