KONFIGURASI ELEKTRON BERDASARKAN KONSEP BILANGAN KUANTUM
13 08 2010
Konfigurasi elektron menggambarkan penataan/susunan elektron dalam atom.
Dalam menentukan konfigurasi elektron suatu atom, ada 3 aturan yang
harus dipakai, yaitu : Aturan Aufbau, Aturan Pauli, dan Aturan Hund.
1. Aturan Aufbau
Pengisian orbital dimulai dari tingkat energi yang rendah ke tingkat energi yang tinggi.
Elektron mempunyai kecenderungan akan menempati dulu subkulit yang
energinya rendah. Besarnya tingkat energi dari suatu subkulit dapat
diketahui dari bilangan kuantum utama (n) dan bilangan kuantum azimuth (
l ) dari orbital tersebut. Orbital dengan harga (n + l) lebih besar
mempunyai tingkat energi yang lebih besar. Jika harga (n + l) sama, maka
orbital yang harga n-nya lebih besar mempunyai tingkat energi yang
lebih besar. Urutan energi dari yang paling rendah ke yang paling tinggi
sebagaimana digaram yang dibuat oleh Mnemonik Moeler adalah sebagai berikut:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d ….
2. Aturan Pauli (Eksklusi Pauli)
Aturan ini dikemukakan oleh Wolfgang Pauli pada tahun 1926. Yang menyatakan “Tidak boleh terdapat dua elektron dalam satu atom dengan empat bilangan kuantum yang sama”.
Orbital yang sama akan mempunyai bilangan kuantum n, l, m, yang sama
tetapi yang membedakan hanya bilangan kuantum spin (s). Dengan demikian,
setiap orbital hanya dapat berisi 2 elektron dengan spin (arah putar)
yang berlawanan. Jadi, satu orbital dapat ditempati maksimum oleh dua
elektron, karena jika elektron ketiga dimasukkan maka akan memiliki spin
yang sama dengan salah satu elektron sebelumnya.
Contoh :
Pada orbital 1s, akan ditempati oleh 2 elektron, yaitu :
Elektron Pertama à n=1, l=0, m=0, s= +½
Elektron Kedua à n=1, l=0, m=0, s= – ½
(Hal ini membuktikan bahwa walaupun kedua elektron mempunyai n,l dan m yang sama tetapi mempunyai spin yang berbeda)
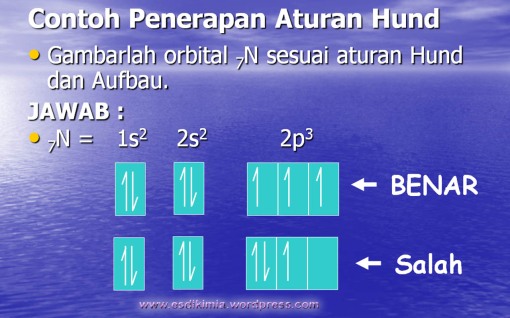
3. Aturan Hund
Aturan ini dikemukakan oleh Friedrick Hund Tahun 1930. yang menyatakan “elektron-elektron dalam orbital-orbital suatu subkulit cenderung untuk tidak berpasangan”.
Elektron-elektron baru berpasangan apabila pada subkulit itu sudah tidak ada lagi orbital kosong.
Untuk menyatakan distribusi
elektron-elektron pada orbital-orbital dalam suatu subkulit, konfigurasi
elektron dituliskan dalam bentuk diagram orbital.
Suatu orbital digambarkan dalam bentuk
kotak, sedangkan elektron yang menghuni orbital digambarkan dengan dua
anak panah yang berlawanan arah. Jika orn=bital hanya mengandung satu
elektron, maka anak panah yang ditulis mengarah ke atas.
Dalam menerapkan aturan hund, maka kita
harus menuliskan arah panah ke atas terlebih dahulu pada semua kotak,
baru kemudian diikuti dengan arah panah ke bawah jika masihterdapat
elektron sisanya.









No comments:
Post a Comment