BEBERAPA OKSIDATOR DALAM LABORATORIUM (ION PERMANGANANAT, ION KROMAT DAN ION KROMAT)
Dalam
laboratorium terdapat beberapa zat yang dapat digunakan sebagai
oksidator. Oksidator yaitu zat yang dapat menyebabkan zat lain mengalami
oksidasi sehingga dirinya sendiri akan mengalami reduksi. Umumnya
unsur-unsur nonlogam merupakan oksidator yang baik karena memiliki
keelektronegatifan tinggi sehingga mudah menangkap atau menarik elektron
kearah dirinya. Walaupun demikian tidak selalu digunakan unsur dalam
semua reaksi kimia.
Dalam
laboratorium terutama reaksi redoks yang dilangsungkan dalam bentuk
larutan yang biasa digunakan sebagai oksidator adalah ion permangananat
(MnO4-), ion kromat (CrO42-), ion kromat (Cr2O72-).
Ketiga zat tersebut merupakan oksidator yang kuat dan mudah melepas
oksigen sehingga penanganannya perlu berhati-hati. Zat-zat ini harus
disimpan ditempat tersendiri dan tidak boleh berada di dekat zat-zat
organik karena dapat menyebabkan kebakaran.
Bila mengenai
anggota segera bilas dengan air yang mengalir. Bila mengenai mata segera
rendam mata dalam air, hal ini dapat dilakukan dengan cara membuka mata
dalam aquades yang disimpan dalam baskom atau ember besar. Setelah itu
segera di bawa ke dokter atau memberi obat tetes mata. Bila sampai
tertelan segera minum air sebanyak-banyaknya untuk mengencerkan zat
kimia yang tertelan lalu segera di bawa ke dokter. Oleh sebab itu, dalam
melakukan praktikum jangan pernah mengambil semua larutan dengan cara
menyedot.
ION PERMANGANANAT (MnO4-)
Ion permanganat
berwarna ungu demikian pula larutan yang mengandung ion permanganat.
Warna tersebut merupakan ciri khas dari ion permanganat. Biasanya dalam
laboratorium ion permanganat diperoleh dari garam kalium permanganat
(KMnO4). KMnO4 merupakan suatu kristal berwarna hitam keunguan.
Gambar Kristal kalium permanganat dan larutan kalium permanganat
Bila terkena cahaya atau dipanaskan pada suhu 230°C, kalium permanganat akan terurai sesuai reaksi berikut.
2 KMnO4 → K2MnO4 + MnO2 + O2
Bilangan oksidasi mangan dalam KMnO4 adalah +7. Ketika terjadi reaksi kimia bilangan oksidasi mangan turun atau mengalami reduksi. Reaksi reduksi mangan dalam KMnO4 bergantung pada keasaman larutan. Dalam suasana larutan asam kuat mangan direduksi menjadi Mn2+ dan warna larutan memudar (hampir tidak berwarna). Setengah reaksi reduksi ion permanganat dalam suasana asam.
8H+ + MnO4- + 5e → Mn2+ + 4H2O
Dalam suasana netral atau sedikit basa ion MnO4- direduksi menjadi MnO2
yang tidak larut dalam larutan atau membentuk endapan. Oleh sebab itu
dalam melakukan titrasi pada suasana basa atau suasana alkalis, larutan
yang mengandung ion MnO4- tidak disarankan karena endapan MnO2
yang terbentuk dapat mengaburkan titik akhir titrasi. Setengah reaksi
reduksi ion permanganat dalam suasana netral atau alkalis.
2H2O + MnO4- + 3e → MnO2 + 4OH-
Untuk membuat
suasana asamsebaiknya dipakai asam sulfat, karena asam ini tidak
menghasilkan reaksi samping. Sebaliknya jika dipakai asam klorida dapat
terjadi kemungkinan teroksidasinya ion klorida menjadi gas klor dan
reaksi ini mengakibatkan dipakainya larutan permanganat dalam jumlah
berlebih. Meskipun untuk beberapa reaksi dengan arsen(III) oksida,
antimon(II) dan hidrogen peroksida, karena pemakaian asam sulfat justru
akan menghasilkan beberapa tambahan kesulitan.
Kalium pemanganat adalah oksidator kuat, oleh karena itu jika berada dalam HCl akan mengoksidasi ion Cl-
yang menyebabkan terbentuknya gas klor dan kestabilan ion ini juga
terbatas. Biasanya digunakan pada medium asam 0,1 N. Namun, beberapa zat
memerlukan pemanasan atau katalis untuk mempercepat reaksi. Seandainya
banyak reaksi itu tidak lambat, akan dijumpai lebih banyak kesulitan
dalam menggunakan reagen ini.
Reaksi reduksi
ion permanganat juga dapat berlangsung dalam suasana netral dan basa
kuat, Perekasi kalium permanganat tidak merupakan pereaksi baku primer.
Sangat sukar untuk mendapatkan pereaksi dalam keadaan murni, bebas dari
mangan(IV) oksida (mangan dioksida). Lagi pula air dipakai sebagai
pelarut sangat mungkin masih mengandung zat pengotor lain yang dapat
mereduksi permanganat menjadi mangan dioksida.
Timbulnya
mangan dioksida justru akan mempercepat reaksi reduksi permanganat.
Demikian juga adanya ion mangan(II) dalam larutan akan mempercepat
reduksi permanganat menjadi mangan dioksida, reaksi tersebut berlangsung
sangat cepat dalam suasana netral. Dengan adanya alasan-alasan tersebut
maka pembuatan larutan baku permanganat dilakukan sebagai berikut.
Larutkan sejumlah(gram) pereaksi dalam air kemudian didihkan selama satu
jam diatas penangas air. Selanjutnya disaring lewat penyaring yang
bebas dari zat pereduksi.
Wadah
bertutupkan sumbat kaca yang dipakai untuk menyimpan larutan, harus
benar-benar bebas dari zat pengotor seperti lemak atau zat pengotor
lain. Untuk keperluan ini biasanya wadah tersebut dicuci bersih memakai
campuran larutan kalium dikromat dan asam sulfat pekat, diikuti
pembilasan dengan aquades. Larutan ini sebaiknya disimpan ditempat
gelap, terhindar dari cahaya, karena itu sebaiknya dipakai botol
berdinding gelap.
Reaksi asam sulfat pekat dengan KMnO3 membentuk Mn2O7.
Reaksi ini berlangsung sangat eksotermsis dan dapat meledak. Demikian
juga dengan asam klorida membentuk gas glor yang sangat beracun. Reaksi
antara asam nitrat dengan alkena akan memutuskan ikatan rangkap dua dan
diperoleh suatu asam karboksilat.
CH3(CH2)17CH=CH2 + 2KMnO4 + 3H2SO4 → CH3(CH2)17COOH + CO2 + 4H2O + K2SO4 + 2MnSO4
KMnO4 juga dapat mengoksidasi aldehida menjadi asam karboksilat. Misalnya mengoksidasi n-heptanal menjadi asam heptanoat.
5C6H13CHO + 2KMnO4 + 3 H2SO4 → 5C6H13COOH + 3H2O + K2SO4 + 2MnSO4
Selain itu KMnO4 juga dapat mengoksidasi gugus metil yang terikat pada cincin benzena. Misalnya mengoksidasi toluena menjadi asam benzoat.
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 14H2O + 2K2SO4 + 6MnSO4
ION KROMAT (CrO42-) DAN DIKROMAT (Cr2O42-)
Dalam
laboratorium pasti dijumpai garam yang mengandung ion kromat dan
dikromat. Garam yang sering dijumpai yaitu kaliium dan natrium kromat
atau dikromat dengan rumus kimia Na2CrO7 (natrium kromat), K2CrO7 (kalium kromat) dan Na2Cr2O7 (natrium dikromat), K2Cr2O7 (kalium dikromat).
Gambar Empat larutan kromium. Dari kiri: larutan yang berwarna kuning adalah kalium dikromat (K2Cr2O7, orange) dan natrium kromat (Na2CrO4), hijau adalah kromium(III) klorida (CrCl3), ungu adalah kromium(III) nitrat (Cr(NO3)3).
Gambar Kristal beberapa senyawa kromium. Dari kiri ke kanan : Natrium kromat tetrahidrat (Na2CrO4·4H2O), kalium dikromat (K2Cr2O7), amonium dikromat ((NH4)2Cr2O3), kromium trioksida (CrO3), kromium oksida (Cr2O3)
Baik ion kromat
maupun dikromat mengandung kromium dengan bilangan oksidasi +6 yang
merupakaan keadaan oksidasi tertinggi dari krom dalam senyawaaannya.
oleh sebab itu dalam reaksi kimia ion kromat dan dikromat akan mengalami
reaksi reduksi. Reaksi reduksi ion kromat dan dikromat bergantung pada
keasaman larutan.
Warna kuning
merupakan ciri khas adanya ion kromat dalam larutan sedangkan warna
merah merupakan ciri khas adanya ion dikromat. Larutan yang mengandung
ion kromat yang berwarna kuning bila diasamakan, akan diperoleh larutan
yang berwarna merah jingga karena ion CrO42- berubah menjadi Cr2O72-.
2CrO42- + 2H+ → Cr2O72- + H2O
Sebaliknya jika larutan yang mengandung ion dikromat dibasakan maka ion Cr2O72- berubah menjadi ion CrO42-.
Cr2O72- + 2OH- → 2CrO42- + H2O
Oleh sebab itu, jika reaksi berlangsung dalam suasana asam yang bertindak sebagai oksidator adalah Cr2O72- dan sebaliknya bila reaksi dilangsungkan dalam suasana basa yang bertindak sebagai oksidator adalah CrO42-.
Dalam reaksi
kimia bila ion kromat dan dikromat bertindak sebagai oksidator (ketika
direaksikan dengan suatu reduktor) bilangan oksidasi kromium turun
menjadi +3 dan produk yang diperoleh bergantung pada keadaan keasaman
larutan.
Dalam larutan asam ion kromium direduksi menjadi ion Cr3+, dalam larutan sedikit basa produk reduksinya adalah Cr(OH)3 yang tidak larut dan dalam larutan sangat basa ion kromat direduksi menjadi ion kromit (CrO2-). Persamaan reaksi yang terjadi sebagai berikut.
Larutan asam
6e + 14H+ + Cr2O7 → 2Cr3+ + 7H2O
Larutan sedikit basa
3e + 4H2O + CrO42- → Cr(OH)3 + 5OH-
Larutan sangat basa
3e + 2H2O + CrO42- → CrO2- + 4OH-
Baik Na2CrO7 (natrium kromat), K2CrO7 (kalium kromat), Na2Cr2O7 (natrium dikromat) mapun K2CrO7 (kalium dikromat) bersifat higoskopis sehingga dapat membentuk tetra-, heksa-, dan dekahidrat.
Natrium kromat (Na2CrO4)
digunakan sebagai inhibitor korosi dalam industri minyak bumi, sebagai
reagen pencelupan dalam industri tekstil, sebagai pengawet kayu. Dengan
memanfaatkan isotop Cr-51 dengan waktu paruh 27,8 hari, larutan natrium
kromat (VI) digunakan dalam obat-obatan untuk penentuan volume sirkulasi
sel darah merah, waktu kelangsungan hidup sel dan evaluasi kehilangan
darah.
Campuran kalium
dikromat dengan asam nitrat 35% diperoleh suatu larutan yang disebut
larutan Schwerter’s yang digunakan untuk menguji keberadaan berbagai
logam terutama perak. Perak murni mengubah larutan menjadi merah terang,
perak sterling (paduan 92,5% perak dengan logam lain biasanya tembaga
atau emas) mengubah larutan menjadi merah gelap, larutan menjadi
berwarna coklat bila kandungan tembaga tinggi bahkan menjadi hijau.
SUMBER
James E. Brady. Kimia universitas asas dan struktur edisi keliama jilid 1.
Vogel Analisis Anorganik Kualitatif Makro Dan Semimikro (terjemahan Setiono & Pudjaatmaka) Edisi kelima.
Underwood, A. L
& R. A Day, Jr. 1999. Analisis Kimia Kuantitatif (terjemahan A.
Hadyana Pudjaatmaka) Edisi kelima. Jakarta: Penerbit Erlangga.
Devy
Agustyaningsih. 2010. Penetapan Kadar Kalium Permanganat Menggunakan
Fotometer Sederhana Berbasis LED dan CdS Fotosel Detektor. Skripsi
Universitas Negeri Malang Fakultas Matematika dan Ilmu Pengetahuan Alam
Program Studi Kimia.
Sumber internet
Wikipedia.org
uncp.edu/home/mcclurem/ptable/chromium/cr.htm
NITROGEN, ASAM NITRAT DAN PREPARASI NITROGEN DALAM LABORATORIUM
Posted by pada 7 Januari 2012
NITROGEN
Nitrogen adalah
unsur nonlogam dalam tabel periodik terletak pada golongan VA atau
golongan 15 dan memiliki lambang N dengan nomor atom 7. Pada suhu kamar
berupa gas tidak berwarna, tidak berbau, tanpa rasa dan berupa unsur
diatomik (N2). Nitrogen yang telah dicairkan juga tidak berwarna dan tidak berbau.
Gambar Rumus Molekul nitrogen dan nitrogen cait
Nitrogen sangat
sulit bereaksi dengan unsur atau senyawa lainnya sehingga disebut juga
dengan nama zat lemas. Nitrogen merupakan gas yang paling banyak di
atmosfer sekitar 78%. Selain di atmosfer, nitrogen juga terdapat di
planet mars (3%).
Ikatan kimia
antara dua atom dalam molekul nitrogen adalah ikatan terkuat antara dua
atom dari unsur yang sama. Hal ini membuat gas N2 sangat
stabil dan inert. Dalam jaringan tubuh makluk hidup, sebagian mengandung
nitrogen, misalnya dalam protein dan asam nukleat menjadi salah satu
komponen pembentuk DNA dan RNA.
Terdapat 2 isotop nitrogen yang stabil yaitu: 14N dan 15N. Isotop yang paling banyak adalah 14N (99.634%), yang dihasilkan dalam bintang-bintang dan yang selebihnya adalah 15N.
Dalam industri
nitrogen diperoleh dari pencairan udara dengan memberi tekanan yang
cukup tinggi, kemudian dilanjutkan dengan destilasi fraksional atau
destilasi fraksinasi.
Ketika nitrogen dipanaskan, dapat bereaksi secara langsung dengan magnesium, lithium dan kalsium.
6 Li + N2 → 2 Li3N
3Mg + N2 → Mg3N2
Ketika dicampur dengan oksigen dan dikenakan bunga api listrik, membentuk oksida nitrat (NO) kemudian menjadi dioksida (NO2). Bila dipanaskan di bawah tekanan dengan hidrogen dan adanya katalis yang cocok akan terbentuk amonia (proses Haber).
Senyawa
nitrogen yang banyak dimanfaatkan dalam dunia industri maupun dalam
laboratorium yaitu asam nitrat dan amonia (paling banyak dalam
industri). Amonia, NH3 merupakan hidrida nitrogen yang
beracun dan merupakan bahan dasar paling penting untuk kimia nitrogen
dan merupakan salah satu bahan kimia yang paling banyak diproduksi di
dunia. Amonia digunakan sebagai bahan dasar pupuk nitrogen seperti urea
dan bahan peledak.
PREPARASI NITROGEN DALAM LABORATORIUM
Di
laboratorium, nitrogen dipersiapkan dengan memanaskan campuran amonium
klorida dan natrium nitrit dan sedikit air. Jika amonium nitrit
dipanaskan akan terurai menghasilkan gas nitrogen. Namun, reaksi ini
sangat cepat dan mungkin eksplosif.
Untuk keamanan,
campukan amonium klorida dan natrium nitrit dengan perbandingan massa
4:5, kemudian dipanaskan dengan sedikit air. Keberadaan air mencegah
amonium klorida mensublimasi ketika dipanaskan. Awalnya, dua zat
mengalami penguraian ganda untuk membentuk natrium klorida dan amonium
nitrit.
Amonium nitrit yang terbentuk kemudian terurai menjadi gas nitrogen dan air.
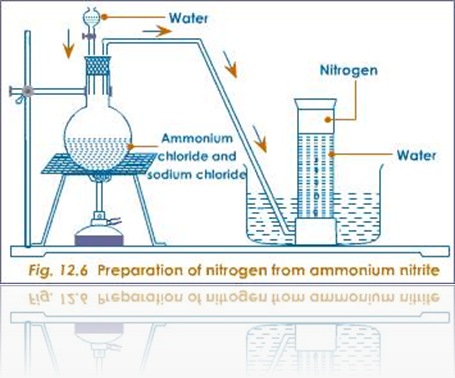
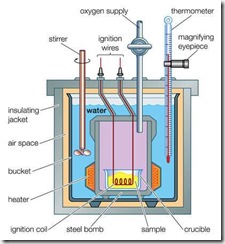
Gas nitrogen
yang terbentuk kemudia dialirkan melalui air seperti pada gambar. Dengan
cara ini maka uap air akan tertinggal sedangkan gas nitrogen terus ke
atas karena kelarutannya yang rendah dalam air.
ASAM NITRAT
Asam nitrat adalah asam kuat yang bersifat korosif dan beracun dan terurai menjadi ion H+ dan ion NO3- dalam air, persamaan reaksinya.
Asam nitrat biasa memiliki konsentrasi 68%. Larutan HNO3
dengan konsentrasi diatas 86% disebut sebagai asam nitrat berasap. Asam
nitrat murni merupakan suatu cairan tidak berwarna yang dapat berubah
menjadi merah kekuningan karena adanya oksida nitrogen terlarut dan
berwarna merah pada suhu tinggi. HNO3 menjadi padatan putih berwarna pada suhu dibawah -41°C dan mendidih pada 83°C.
Asam nitrat
merupakan oksidator yang kuat sehingga penanganannya harus berhati-hati.
Bila mengenai anggota tubuh segera dicuci dengan air yang mengalir.
Gambar Asam nitrat murni yang berwarna kekuningan karena adanya oksida nitrogen terlarut dan asam nitrat 70% yang tidak berwarna
Air Raja
Campuran antara asam klorida pekat dan asam nitrat pekat dengan perbandingan 3:1 (misalnya 3 mL HCl dengan 1 mL HNO3 atau 3L HCl dengan 1 L HNO3) disebut aqua regia atau air raja
karena dapat melarutkan logam mulia seperti emas dan platina. Aqua
regia sangat tidak stabil, oleh sebab itu aqua regia baru dibuat ketika
akan digunakan.
Sifa-sifat asam nitrat
Asam nitrat
merupakan oksidator yang kuat yang mudah melepaskan oksigen sehingga
penyimpanannya harus ditempat tersendiri dan hindari bahan-bahan organik
yang umumnya mudah terbakar. Dalam reaksi kimia bila konsentrasi
tinggi, HNO3 tereduksi menjadi NO2 sedangkan pada konsentrasi rendah tereduksi menjadi NO.
Pemanasan HNO3 akan terurai menghasilkan NO2.
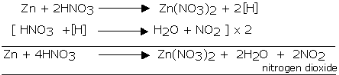
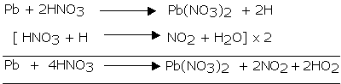
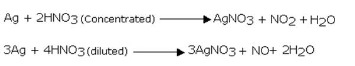
Reaksi asam nitrat dengan nonlogam dan logam
Menjadi agen
oksidasi yang kuat, asam nitrat bereaksi hebat dengan banyak non-logam,
logam, senyawa dan reaksi mungkin berlangsung eksplosif. Kecuali emas
dan platina, HNO3 hampir bereaksi dengan semua unsur logam.
Produk yang
terbentuk tergantung pada sifat logam (kereaktifan logam), konsentrasi
asam dan suhu. Reaksinya dengan logam yang kurang reaktif hasil
reduksinya berupa gas NO sedangkan bila digunakan HNO3 pekat hasil reduksinya gas NO2. Beberapa contoh reaksi asam nitrat sebagai berikut.
Reaksi karbon dengan asam nitrat
C + 4HNO3 → CO2 + 4NO2 + 2H2O
3C + 4HNO3 → 3 CO2 + 4NO + 2H2O
Reaksi belerang dan iod dengan asam nitrat
S(s) + 2HNO3(aq) → H2SO4(aq) + 2NO(g) (HNO3 pekat dingin)
3I2(s) + 10HNO3(aq) → HIO3(aq) + 2H2O(l) + 10NO(g) (HNO3 pekat panas)
Reaksi seng dengan asam nitrat
Reaksi magnesium dengan asam nitrat
Reaksi timbal dengan asam nitrat
Reaksi perak dengan asam nitrat
Trinitro Toluena (TNT)
Campuran asam
nitrat pekat dan asam sulfat pekat bila direaksikan dengan toluena akan
diperoleh suatu senyawa yang disebut trinitro Toluena (TNT). Trinitro
toluena merupakan suatu senyawa yang sangat ekplosif.
Sumber :
Tutorvista.com
Wikipedia.org
webelements.com
OKSIGEN MOLEKULER SEBAGAI ZAT PENGOKSIDASI
Posted by pada 13 Oktober 2011
Oleh
Laurensius E. seran. Seran_emel@rocketmail.com
wanibesak.wordpress.com
Universitas Negeri Malang. Jln. Surabaya no.45
Oksigen dan Jenis-Jenis Oksida
Oksigen memiliki dua alotrop yakni oksigen (O2) dan ozon (O3).
Alotrop yaitu perilaku yang berbeda yang ditunjukan oleh suatu zat yang
atom penyusunnya, atom unsur yang sama namun ada perbedaan jumlah dan
perbedaan cara terikatanya atom-atom penyusun. Dalam laboratorium ozon
dihasilkan dengan memberi muatan listrik pada oksigen murni. Tidak
seperti molekul-molekul lain, ozon walaupun disusun oleh atom yang sama
tetapi bersifat polar. Molekul lain seperti O2, H2 dan P4
bersifat nonpolar karena molekulnya bersifat nonpolar. Ozon melindungi
permukaan bumi dari sengatan sinar matahari namun kini telah disadari
bahwa lapisan ozon telah menipis akibat akibat aktivis pelepasan zat-zat
yang berbahaya bagi lapisan ozon makin meningkat.
Salah satu zat
pengoksidasi yang paling lazim dan ampuh di laboratorium, industri dan
dalam kehidupan kita sehari-hari adalah molekul oksigen, O2. Dioksigen (O2),
adalah gas tak berwarna dan tak berbau menempati 21% udara. Karena atom
oksigen juga komponen utama air dan batuan, oksigen adalah unsur yang
paling melimpah di kerak bumi.
Bergabungnya oksigen dengan suatu zat melalui reaksi kimia sering disebut sebagai oksidasi.
Meskipun pandangan ini telah ditinggalkan namun dalam reaksi yang
melibatkan oksigen zat yang mengalami oksidasi mudah ditentukan.
Penarikan oksigen dari suatu zat disebut reduksi. Suatu zat yang tersusun dari oksigen dengan unsur tertentu disebut oksida. Oksida terbagi menjadi
1. Oksida logam
2. Oksida nonlogam
3. Oksida amfoter
4. Oksida netral
5. Superoksida
Reaksi Oksigen dengan Logam
Pembentukan
oksida logam terjadi dengan cara reaksi langsung antara logam dengan
oksigen membentuk oksida logam yang sering disebut korosi. Oksida logam disebut juga oksida basa karena reaksinya dengan air memberikan larutan yang bersifat basa (pH > 7).
Memang dalam
bentuk korosi pembentukan oksida merupakan sesuatu yang merepotkan dan
sumber pemborosan ekonomis dalam masyarakat. Besi bereaksi dengan
oksigen dengan hadirnya uap air membentuk karat, yakni suatu oksida besi
yang kristalnya mengandung molekul air dalam kuantitas tertentu.
2Fe(s) + 2/2O2(g) + xH2O(g) → Fe2O3.xH2O(s)
Aluminium
merupakanlogam logam lain yang biasanya banyak dikenal juga membentuk
oksida oleh reaksi langsung dengan oksigen dalam udara.
2Al(s) + 2/2O2(g) → Al2O3(s)
Aluminium lebih mudah bereaksi dengan oksigen dibanding besi.namun berbeda dengan besi.
Pada aluminium oksida aluminium yang terbentuk melekat kuat pada
permukaan logam sehingga dengan efektif melindungi logam itu dari
serangan oksigen selanjutnya. Karena hal inilah aluminium disunakan
sebagai logam bangunan.
Reaksi antar
besi dan aluminium dengan besi termasuk lambat. Namun kadang-kadang
reaksi antara logam dengan oksigen dapat cepat berlangsung dan
membebaskan sejumlah besar kalor dan cahaya. Reaksi dengan oksigen
seperti ini biasanya disebut pembakaran. Contohnya adalah pembakaran magnesium.
2Mg(s) + O2(g) → 2MgO(s)
Meskipun korosi
besi berlansung lambat, besi dapat dibuat bereaksi dengan cepat dengan
cara menaikan suhu dan meningkatkan konsentrasi O2. Misalnya
pemotongan baja dengan nyala asetilena dilaksanakan mula-mula memanasi
baja itu ke suhu tinggi dengan nyala oksigen-asetilena.
Setelah logam itu sangat panas, aliran gas asetilena dimatikan dan baja
panas tersebut disembur terus menggunakan aliran oksigen murni. Dalam
proses ini dibebaskan sejumlah besar kalor yang dapat melelhkan baja dan
debu serta bunga api akan meletik ke mana-mana.
Reaksi Oksigen Dengan Unsur Nonlogam
Oksigen juga
bereaksi dengan unsur-unsur nologam membentuk oksida nanlogam yang
berikatan secara kovalen. Oksida nonlogam sering disebut sebagai oksida
basa karena reaksinya dengan air menyebabkan larutan menjadi asam (pH
< 7).
Contoh yang pasti anda kenal adalah reaksi O2 dengan karbon dalam bentuk briket arang atau batubara. Dengan kehadiran O2
yang berlebih produk yang diperoleh adalah karbondioksida, namun jika
pasokan oksigen terbatas akan terbentuk sejumlah karbonmonooksida.
C(s) + O2(g) → CO2(g)
C(s) + O2(g) → 2CO(g)
Karbonmonoksida sendiri mampu bereaksi dengan oksigen membentuk CO2
2CO(g) + O2(g) → 2CO2(g)
Reaksi ini
sangat eksotermis (DH = -284kJ per mol) dan CO digunakan dalam industri
sebagai bahan bakar karena dapat dibuat dengan mudah dari batu bara dan
mudah dikirim lewat pipa. Karbondioksida padat disebut juga es kering yang biasa digunakan untuk memberi efek asap.
Dua unsur
nonlogam yang mudah bereaksi dengan oksigern yaitu belerang dan fosfor.
Belerang terbakar di udara dengan nyala biru dan menghasilkan gas
belerang dioksida yakni sebuah gas rangsang yang menyesakkan.
S(s) + O2(g) → SO2(g)
Fosfor terdiri dari dua alotrop yaitu fosfor merah dan fosfor putih. Kedua terbakar dioksigen menghasilkan P4O10. Namun perlu diperhatikan karena fosfor putih bereaksi secara spontan dengan oksigen.
P4(s) + O2(g) → P4O10(s)
Tidak semua
unsur nonlogam dapat bereaksi dengan logam. Misalnya nitrogen. Hal
inilah yang menyebabkan campuran antara nitrogen dan oksigen di atmosfer
stabil.
Usaha untuk menyalakan campuran N2 dan O2
tidak berhasil karena reaksi keduanya berlansung secara endoterm. Namun
jika udara dipanasi pada suhu sangat tinggi misalnya dalam mesin mobil,
dihasilkan sejumlah kecil NO. Bila dibebaskan ke atmosfer lewat kanlpot
senyawa ini mengawali rantai reaksi akhirnya menghasilkan asap kabut.
Oksida Amfoter
Oksida yang terbentuk dari unsur-unsur amfoter (B, Si, As, Sb, Te, Po) disebut oksid a amfoter.
Disebut amfoter karena dapat berlaku sebagai asam dan juga dapat
berlaku sebagai basa tergantung pada kondisi atau larutn yang
direaksikan dengannya.
Dalam asam yang
lebih kuat oksida amfoter bertindak sebagai basa, begitu sebaliknya
bereaksi dengan zat yang lebih basa oksida amfoter bertindak sebagai
asam.
Oksida Netral atau Oksida Indeferen
Oksida netral merupakan oksida yang tidak bersifat asam dan basa ketika dilarutkan dalam air, contohnya CO, N2O dan MnO2.
Peroksida
Peroksida yaitu
kelompok senyawa yang kelebihan oksigen atau kelompok senyawa yang
mengandung ikatan oksigen-oksigen dalam struktur molekulnya.
Contohnya : hidrogen peroksida (H2O2) yang biasa digunakan sebagai zat pemutih dan desinfektan karena hasil reaksinya berupa H2O dan oksigen. H2O2
murni merupakan suatu cairan biru pucat yang lebih kental daripada air,
tidak stabil dengan titik beku -0,46°C. Dalam laboratorium hidrogen
peroksida diperoleh dari reaksi antara barium peroksida dengan asam
sulfat encer dingin.
BaO2(s) + H2SO4(aq) → BaSO4(s) + H2O2(aq)
Superoksida
Superoksida
sama hal seperti peroksida yakni memiliki ikatan oksigen-oksigen. Namun
pada superoksida, terjadi kelebihan oksigen lebih dari satu sedangkan
pada superoksida hanya terjadi kelebihan 1 atom oksigen.
Oskida-oksida alkali langsung diperoleh dari reaksi antara logam unsur
dengan oksigen pada suhu dan tekanan tertentu. Salah satu contoh
superoksida yaitu K2O.
K2O
biasanya digunakan untuk memulihkan orang-orang yang keracunan gas.
Selain itu digunakan pula dalam kapal selam, untuk menghilangkan gas
karbondioksida dan uap air yang dihasilkan dari pernapasan para awak
kapal. Reaksi yang terjaid antara KO2 dengan uap air dan karbondioksida sebagai berikut.
K2O (s) + 2H2O(g) → 4KOH(s) + 3O2(g)
KOH(s) + CO2(g) → KHCO3(s)
Dari reaksi inilah gas oksigen yang dihirup akan segera digantikan oleh O2 yang dihasilkan dari reaksi antara K2O dengan uap air.
Reaksi Oksigen dengan Senyawa Organik
Senyawa organik umumnya dianggap sebagai senyawa karbon. Walaupun demikian beberapa senyawa seperti CO2 dan CaCO3 walaupun mengandung atom karbon dalam molekulnya tetap dianggap sebagai senyawa anorganik.
Senyawa organik yang paling sederhana disebut hidrokarbon. Yakni senyawa yang tersusun hanya dari karbon dan hidrogen.hidrokarbon sederhana adalah metana, CH4, yang merupakan komponen utama gas alam. Hidrokarbon juga merupakan penyusun bensin, minyak tanah, solar dan lilin.
Metana dan
hidrokarbon yang lain mudah terbakar di udara. Jika tersedia cukup
oksigen produk pembakaran adalah karbondioksida dan uap air.
CH4(g) + O2(g) → CO2(g) + 2H2O(g)
Jika oksigen yang tersedia dalam jumlah sedikit produk pembakaran berupa karbonmonoksida dan uap air.
2CH4(g) + O2(g) →2CO(g) + H2O(g)
Jika oksigen
yang tersedia sedikit sekali hanya hidrogen yang membentuk uap air dan
karbonnya berupanyala berjegala yang mengandung unsur karbon.
CH4(g) + O2(g) → C(s) + 2H2O(g)
Ini dia website menyetarakan reaksi kimia
Posted by pada 23 Juni 2011
Dalam ilmu
kimia, sebagian besar reaksi kimia yang terjadi sangat sulit untuk
disetarakan dalam waktu singkat terutama yang melibat 3 atau lebih
reaktan dan produk yang dihasilkan berupa campuran beberapa macam
senyawa.
Untuk
mempermudah menetarakan reaksi kimia berikut salah satu website yang
dapat dimanfaatkan untuk menyetarakan reaksi kimia yang terjadi. Syarat
mutlak harus dipenuhi yaitu reaksi kimia yang terjadi harus ditulis dengan benar.
Langkah-langkah menggunakan website tersebut sebagai berikut:
2. Tulislah persamaan reaksi yang pada kolom Enter Chemical Equation. Misalnya menyetarakan reaksi kimia berikut:
SO2 + KMnO4 + H2O = MnSO4 + K2SO4 + H2SO4
3. Setelah reaksi ditulis dengan benar, klik tabs Balance Chemical Equation, sehingga diperoleh reaksi yang telah setara seperti ditunjukan pada gambar.
Gampang kan..???? selamat mencoba dan berkreasi…!!!!
PUISI = MENGAPA KAU HANCURKAN BUMI KITA DENGAN NUKLIRMU?
Posted by pada 14 Juni 2011
Bumiku…!!
Bumimu…!!
Bumi Kita…!!
Mengapa kau hancurkan semuanya dengan nuklirMu..??
Apakah semuanya tidak berarti bagimu..??
Walaupun demikian setidaknya masih berarti bagi orang lain..!!
Lihatlah jerit tangis bocah tak berbaju :
![clip_image002[6] clip_image002[6]](http://wanibesak.files.wordpress.com/2011/06/clip_image0026_thumb.jpg?w=143&h=184)
yang telah kehilangan Ayahnya..!!
yang telah kehilangan Ibunya..!!
yang telah hilang harapannya..!!
yang telah hilang kasih sayang seorang ibu..!!
Apakah kau tak bosan mendengar semua itu..??
Apakah kau tak bosan melihat semua itu..??
Apakah kau tak merasakan kesedihan mereka yang telah kehilangan segalanya..??
Apakah kau tak bosan mendengar jerit tangis mereka yang menggelegar bagaikan halilintar..??
Apakah kau tak mendengar jeritan dunia yang terus mencari dan mencari apa yang dinamakan “kasih sayang”..??
Apakah ini yang ini yang dinamakan hidup : menggunakan kekuatan dan kehebatan ilmu pengetahuan untuk menindas dan menghancurkan sesama..??
Bumimu…!!
Bumi Kita…!!
Mengapa kau hancurkan semuanya dengan nuklirMu..??
Apakah semuanya tidak berarti bagimu..??
Walaupun demikian setidaknya masih berarti bagi orang lain..!!
Lihatlah jerit tangis bocah tak berbaju :
![clip_image002[6] clip_image002[6]](http://wanibesak.files.wordpress.com/2011/06/clip_image0026_thumb.jpg?w=143&h=184)
yang telah kehilangan Ayahnya..!!
yang telah kehilangan Ibunya..!!
yang telah hilang harapannya..!!
yang telah hilang kasih sayang seorang ibu..!!
Apakah kau tak bosan mendengar semua itu..??
Apakah kau tak bosan melihat semua itu..??
Apakah kau tak merasakan kesedihan mereka yang telah kehilangan segalanya..??
Apakah kau tak bosan mendengar jerit tangis mereka yang menggelegar bagaikan halilintar..??
Apakah kau tak mendengar jeritan dunia yang terus mencari dan mencari apa yang dinamakan “kasih sayang”..??
Apakah ini yang ini yang dinamakan hidup : menggunakan kekuatan dan kehebatan ilmu pengetahuan untuk menindas dan menghancurkan sesama..??
Benarkah 1 + 1 = 2
Posted by pada 9 Juni 2011
Kita semua tahu 1 + 1 pasti sama dengan dua. Benarkah demikian?
Ternyata hal ini tidak berlaku untuk untuk campuran dua zat cair yang
berbeda. Untuk membuktikan hal ini lakukanlah hal beriku:
-
Siapkan gelas ukur 100 mL kemudian masukan 50 mL air
-
Pada gelas ukur yang lain masukan 50 mL air juga.
-
Masukan atau tambahkan 50 mL air dari langkah 2 pada gelas ukur nomor satu.
-
Amati! Dari pengamatan tentu kita akan memperoleh 100 mL air.
-
Percobaan
selanjutnya gantilah 50 mL air pada langkah 2 dengan alkohol. Amati
setelah alkohol dimasukan atau ditambahkan ke dalam air. apakah tepat
100 mL?. Dari pengamatan tentu tidak mencapai 100 mL. Mengapa demikian?
Beberapa Alat Kimia dalam Laboratorium beserta Fungsinya
Posted by pada 31 Mei 2011
pH dan pOH (Derajat Keasaman dan kebasaan)
Posted by pada 21 April 2011
pH dan pOH larutan asam dan basa serta cara penentuan pH dan pOH larutan asam dan basa silakan unduh di sini…!!!!
Amankah, Mengkonsumsi makanan kalengan yang dipanaskan pada kemasannya?
Posted by pada 7 Januari 2011
Seiring dengan perkembangan teknologi, makin banyak makanan siap saji
yang ditawarkan. Selain diberi bahan pengawet makanan-makanan ini
dikemas begitu rapi agar tidak terkontaminasi oleh zat-zat yang tidak
diinginkan. Salah satunya melalui pengalengan. Bahan-bahan yang
digunakan pada pengalengan terbuat dari besi atau yang di lapisi timah
ataupun menggunakan aluminium. Besi atau seng (kebanyakan menggunakan
seng) yang dilapisi timah dilakukan secara elektrolisis yang disebut tin
plating.
Gambar Salah bahan makanan yang kemasannya menggunakan timah
Timah merupakan salah satu logam yang tahan karat. Oleh sebab itu,
diduga sangat aman dijadikan sebagai kemasan bahan-bahan makanan. Namun
dalam kehidupan sehari-hari sering terjadi kekeliruan pada tahap
penyajiannya. Salah satu kekeliruan yang sangat fatal yaitu memanaskan
makanan yang akan dikonsumsi langsung pada kemasannya. Hal ini sebaiknya
dihindari. Mengapa demikian?.
Seperti yang telah disinggung bahan yang digunakan pada kemasan tersebut
dapat terbuat dari timah dan timah tersebut langsung berhubungan dengan
bahan makanan yang akan dikonsumsi. Oleh sebab itu ketika dilakukan
pemanasan, timah pada kemasan tersebut akan terurai menjadi ion-ion
timah kemudian langsung masuk ke dalam makanan yang akan dikonsumsi
tersebut. Akibatnya timah yang telah menjadi ion-ion timah masuk bersama
makanan yang dikonsumsi.
Walaupun tidak begitu banyak namun jika hal ini dilakukan terus menerus
tentu akan sangat berbahaya bagi kesehatan. Selain itu, ion-ion timah
yang telah larut dalam bahan makanan dapat pula bereaksi dengan
senyawa-senyawa lain yang ada dalam bahan makanan menghasilkan senyawa
baru yang bersifat toksit (racun). Sehingga kita sering mendengar
keracunan bahan makanan dan sebagian besar adalah makanan dalam bentuk
kalengan.
Lain halnya jika kemasannya terbuat dari aluminium. Jika kemasan
tersebut terbuat dari aluminium maka sangat aman bagi kesehatan, karena
aluminium yang telah dijadikan aluminium oksida (Al2O3) sangat tahan terhadap pemanasan.
Namun keracunan bahan makanan dapat pula disebabkan oleh bahan-bahan
pengotor yang ada selama pengolahan yang masuk tanpa disengaja ataupun
disebabkan telah habis massa pakainya.
hukum I dan II Faraday
Posted by pada 7 Januari 2011
Hukum I Faraday (1831 1832): massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan jumlah listrik yang digunakan (Q).
G=Q
Jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus (i) dengan waktu (t)
Q = i . t (coulomb)
Jadi persamaan di atas dapat dituliskan sebagai berikut:
G = it
Contoh
arus 1 amper yang dialirkan selama 1 menit (60 detik) ke dalam larutan CuSO4 mengendapkan 0,4 gram tembaga dikatode, maka:
a). Arus 2 amper dalam 1 menit (120 coulomb) akan mengendapkan 0,8 g Cu
b). Arus 1 amper dalam 2 menit (120 coulomb) akan mengendapkan 0,8 g Cu
c). Arus 2 amper dalam 2 menit (240 copulomb) akan mengendapkan 1,6 g Cu
Hukum II Faraday : “massa zat yang dibebaskan pada elektrolisis (G) berbanding lurus dengan massa ekivalen zat itu (ME)”.
G = ME
Massa ekivalen dari unsur-unsur logam sama dengan massa atom relatif (Ar) di bagi dengan perubahan bilangan oksidasinya (pbo)
ME= Ar/pbo
Contoh
Contoh pada elektrolisis larutan CuSO4 terjadi reduksi ion Cu2+ menjadi Cu
Cu2+(aq) + 2e –––→ Cu(s)
Oleh karena tembaga mengalami perubahan bilangan oksidasi sebesar 2, maka massa ekivalen
Cu = ArCu/2
= 63,5/2 = 31,75
Apabila listrik
yang sama banyak dialirkan kedalam dua atau lebih sel elektrolisis yang
berbeda, maka perbandingan massa zat-zat yang dibebaskan sama dengan
perbandingan massa ekivalennya.
Contoh
Misalkan arus i amper dialirkan selama t detik ke dalam larutan CuSO4
dan larutan AgNO3 yang di hubungkan seri.(pada hubungan seri jumlah
listrik yang memasuki kedua sel adalah sama). Listrik akan mengendapkan
Cu dan Ag pada katoda masing-masing sel. Sesuai dengan hukum faraday II,
perbandingan massa Cu dengan Ag yang di endapkan sama dengan
pebandingan massa ekivalennya.
GCu : Gag = ME Cu : MEAg
Misalkan massa Cu yang diendapkan 10 g maka massa perak dapat dihitung sebagai berikut:
GCu : Gag = ME Cu : MEAg
= 34,05 g
Penggabungan hukumfaraday I dan II menghasilkan persamaan sebagai berikut:
G = k . i . t . ME
Faraday menemukan harga faktor pembanding k = 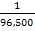 jadi, persamaan diatas dapat dinyatakan sebagai berikut:
jadi, persamaan diatas dapat dinyatakan sebagai berikut:
Dengan
G = massa zat yang dibebaskan (dalam gram)
i = kuat arus (dalam amper)
t = waktu (dalam detik)
ME = massa ekivalen
Contoh soal
Hitunglah massa tembaga yang dapat dibebaskan oleh arus 10 amper yang
dialirkan selama 965 detik ke dalam larutan CuSO4 (Cu = 63,5)
Jawab:
Cu di endapkan di katoda menurut persamaan berikut ini:
Cu2+(aq) + 2e –––→ Cu (s)















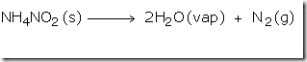






























No comments:
Post a Comment