Larutan disebut juga campuran yang homogen.
Disebut campuran karena susunannya dapat berubah-ubah dan disebut
homogen susunannya begitu seragam sehingga batas antara zat-zat yang
melarut dan pelarut tidak dapat dibedakan bahkan dengan mikroskop optis
sekalipun. Campuran-campuran homogen dari gas, emas dan perunggu dapat
dikatakan pula sebagai larutan. Tetapi istilah larutan biasanya
digunakan untuk fasa cair.
Zat-zat yang memiliki fasa padat dan gas lazimnya disebut sebagai zat terlarut (solute) sedangkan yang berfasa cair dikatakan sebagai pelarut. Suatu zat dikatakan sebagai pelarut apabila memiliki jumlah yang lebih banyak dibandingkan jumlah zat terlarut. Dalam kondisi tertentu misalnya campuran antara alkohol dan air dengan perbandingan 50:50. Dari campuran tersebut sedikit meragukan untuk menentukan mana yang bertindak sebagai pelarut dan mana yang bertimdak sebagai zat terlarutnya. Dari campuran yang demikian air dan alkohol dapat dikatakan sebagai pelarut dan dapat pula dikatakan sebagai zat terlarut. Lain halnya dalam pembuatan sirup. Dalam pembuatan sirup jumlah gula lebih banyak dari jumlah air tetapi air tetap dikatakan sebagai pelarut karena dapat mempertahankan keadaan fisiknya sedangkan gula atau sukrosa disebut sebagai zat terlarut.
Untuk menyatakan jumlah atau banyak zat terlarut dalam suatu larutan digunakan istilah konsentrasi. Terdapat beberapa metode yang digunakan untuk menyatakan konsentrasi zat terlarut di dalam larutan.
1. Persen massa
Contoh
a. Berapa % gula dalam larutan yang dibuat dengan melarutkan 10 g gula dalam 70 g air.
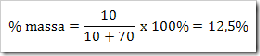
b. Berapa gram gula yang terdapat dalam 500 gram larutan 12% massa gula.

2. Persen volume
Konsentrasi suatu larutan dari dua cairan
dinyatakan sebagai presentasi volume. Hal ini bisanya dijumpai pada
konsentrasi minuman beralkohol. Misalnya vodka yang mengandung 15 persen
alkohol artinya didalam 100 mL vodka terdapat 15 mL alkohol.
Misalnya menentukan % volume alkohol dari suatu campuran. 40 mL alkohol dicampur 50 mL aseton maka:
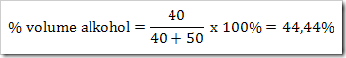
3. ppm dan ppb
Untuk larutan yang sangat sangat encer untuk menyatakan konsentrasi digunakan satuan parts per million atau bagian perjuta (ppm), dan parts per billion atau bagian per milliar (ppb).
larutan dengan konsentrasi 1 bpj artinya mengandung 1 gram zat
terlarut didalam tiap 1 juta gram larutan atau 1 mg zat terlarut dalam
tiap 1 kg larutan.
Karena larutan yang sangat encer memiliki massa jenis = 1 g/mL, maka 1
bpj diartikan sebagai 1 miligram zat terlarut dalam 1 liter larutan.
4. Molalitas
Kemolalan menyatakan jumlah mol zat terlarut dalam 1 Kg pelarut.
Dengan, Mr = massa molar, P = berat pelarut (gram)
Contoh
1) Berapa molal larutan NaCl jika diketahui persen massa NaCl = 10%
Jawab
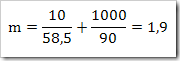
2) Berapa molalitas larutan yang dibuat dengan melarutkan 3 g urea (CO(NH)2)2) di dalam 500 g air? (Mr urea = 60)
Jawab
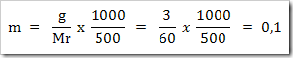
5. Molaritas (M)
Molaritas menyatakan jumlah mol zat terlarut dalam 1 liter larutan atau jumlah milimol zat terlarut dalam 1 mL larutan.
Larutan 0,50M artinya 0,50 mol zat dalam satu liter larutan atau 0,50 milimol zat dalam 1 mL larutan.
Contoh
Jika di dalam suatu botol pereaksi terdapat terdapat 250 mL larutan NaOH (Mr = 40) yang konsentrasinya 0,4M. maka
a. Berapa jumlah mol NaOH yang terkandung di dalam larutan tersebut
b. Berapa gram NaOH yang terlarut di dalam larutan tersebut
Jawab
a. Volume larutan = 250 mL = 0,25 L
Mol NaOH yang terlarut = 0,25 L x 0,4 mol/L = 0,10 mol
b. Gram NaOH yang terlarut dalam larutan = mol NaOH x Mr NaOH
= 0,1 mol x 40 g/mol = 4 g
Hubungan molaritas larutan dengan % massa
Didalam laboratorium tersedia larutan asam format (CHO2H) 4,6%. (Ar H = 1, C = 12 dan O = 16) dengan massa jenis 1,01 g/mL. Tentukan konsentrasi larutan tersebut…
Jawab
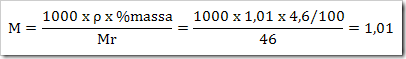
Atau
v Massa larutan = 1000 mL x 1,01 g/mL = 1010 g
v Massa zat terlarut = % massa x massa larutan = 4,6/100 x 1010 g = 46,46 g
v Mol CHO2H yang larut dalam 1 liter larutan = 46,46 g/46 g/mol = 1,01 mol
6. Fraksi mol (X)
Fraksi mol menyatakan jumlah mol zat terlarut atau jumlah mol pelarut dalam jumlah mol total larutan.
Contoh
1) Dalam suatu larutan 16% massa naftalena dalam benzena, tentukan fraksi mol masing-masing zat, jika diketahui Mr naftalena = 128 dan Mr benzena = 78?
Misalkan larutan total = 100 g
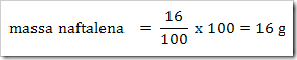
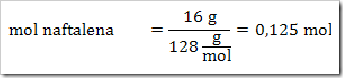
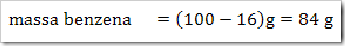
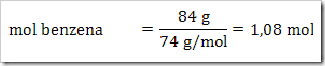
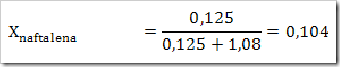
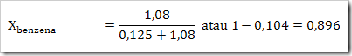
Hubungan Fraksi Mol, Kemolalan dan Kemolaran
Konstrasi larutan dapat dikonfersikan dari satuan ke satuan yang lain.misalnya suatu larutan 40% NaNO3 dengan massa jenis 1,36 g/mL. Hitunglah fraksi mol, kemolalan dan kemolaran dari NaNO3? (Mr = 85)
Jawab
Massa larutan = 1000 mL x massa jenis
= 1000 mL x 1,36 g/mL
= 1360 gram
NaNO3 yang terlarut dalam 1 liter larutan
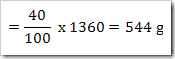
Massa molar NaNO3 = 85 g/mol
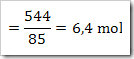
Jumlah air dalam larutan
= massa larutan – massa NaNO3
= (1360-544) gram = 816 g
= 816 / 18 = 45,33 mol
a. Fraksi mol NaNO3
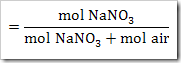

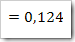
Fraksi mol H2O
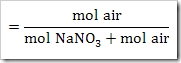

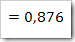
b. Kemolalan
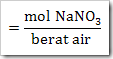
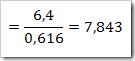
c. Kemolaran

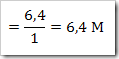
Zat-zat yang memiliki fasa padat dan gas lazimnya disebut sebagai zat terlarut (solute) sedangkan yang berfasa cair dikatakan sebagai pelarut. Suatu zat dikatakan sebagai pelarut apabila memiliki jumlah yang lebih banyak dibandingkan jumlah zat terlarut. Dalam kondisi tertentu misalnya campuran antara alkohol dan air dengan perbandingan 50:50. Dari campuran tersebut sedikit meragukan untuk menentukan mana yang bertindak sebagai pelarut dan mana yang bertimdak sebagai zat terlarutnya. Dari campuran yang demikian air dan alkohol dapat dikatakan sebagai pelarut dan dapat pula dikatakan sebagai zat terlarut. Lain halnya dalam pembuatan sirup. Dalam pembuatan sirup jumlah gula lebih banyak dari jumlah air tetapi air tetap dikatakan sebagai pelarut karena dapat mempertahankan keadaan fisiknya sedangkan gula atau sukrosa disebut sebagai zat terlarut.
Untuk menyatakan jumlah atau banyak zat terlarut dalam suatu larutan digunakan istilah konsentrasi. Terdapat beberapa metode yang digunakan untuk menyatakan konsentrasi zat terlarut di dalam larutan.
1. Persen massa
 |
Contoh
a. Berapa % gula dalam larutan yang dibuat dengan melarutkan 10 g gula dalam 70 g air.
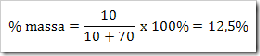
b. Berapa gram gula yang terdapat dalam 500 gram larutan 12% massa gula.

2. Persen volume
 |
Misalnya menentukan % volume alkohol dari suatu campuran. 40 mL alkohol dicampur 50 mL aseton maka:
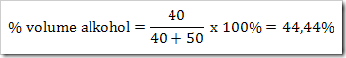
3. ppm dan ppb
Untuk larutan yang sangat sangat encer untuk menyatakan konsentrasi digunakan satuan parts per million atau bagian perjuta (ppm), dan parts per billion atau bagian per milliar (ppb).
 |
 |
 |
4. Molalitas
Kemolalan menyatakan jumlah mol zat terlarut dalam 1 Kg pelarut.
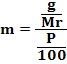 |
Contoh
1) Berapa molal larutan NaCl jika diketahui persen massa NaCl = 10%
Jawab
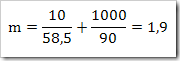
2) Berapa molalitas larutan yang dibuat dengan melarutkan 3 g urea (CO(NH)2)2) di dalam 500 g air? (Mr urea = 60)
Jawab
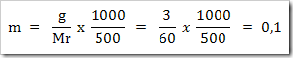
5. Molaritas (M)
Molaritas menyatakan jumlah mol zat terlarut dalam 1 liter larutan atau jumlah milimol zat terlarut dalam 1 mL larutan.
 |
Larutan 0,50M artinya 0,50 mol zat dalam satu liter larutan atau 0,50 milimol zat dalam 1 mL larutan.
 |
| 1L = 1 dm3 = 1000 mL = 1000 cm3 1 mol = 1000 mmol |
Contoh
Jika di dalam suatu botol pereaksi terdapat terdapat 250 mL larutan NaOH (Mr = 40) yang konsentrasinya 0,4M. maka
a. Berapa jumlah mol NaOH yang terkandung di dalam larutan tersebut
b. Berapa gram NaOH yang terlarut di dalam larutan tersebut
Jawab
a. Volume larutan = 250 mL = 0,25 L
Mol NaOH yang terlarut = 0,25 L x 0,4 mol/L = 0,10 mol
b. Gram NaOH yang terlarut dalam larutan = mol NaOH x Mr NaOH
= 0,1 mol x 40 g/mol = 4 g
Hubungan molaritas larutan dengan % massa
 |
 |
Didalam laboratorium tersedia larutan asam format (CHO2H) 4,6%. (Ar H = 1, C = 12 dan O = 16) dengan massa jenis 1,01 g/mL. Tentukan konsentrasi larutan tersebut…
Jawab
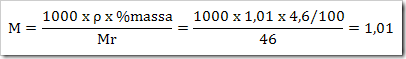
Atau
v Massa larutan = 1000 mL x 1,01 g/mL = 1010 g
v Massa zat terlarut = % massa x massa larutan = 4,6/100 x 1010 g = 46,46 g
v Mol CHO2H yang larut dalam 1 liter larutan = 46,46 g/46 g/mol = 1,01 mol
6. Fraksi mol (X)
Fraksi mol menyatakan jumlah mol zat terlarut atau jumlah mol pelarut dalam jumlah mol total larutan.
 |
 |
Contoh
1) Dalam suatu larutan 16% massa naftalena dalam benzena, tentukan fraksi mol masing-masing zat, jika diketahui Mr naftalena = 128 dan Mr benzena = 78?
Misalkan larutan total = 100 g
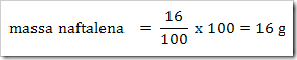
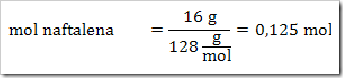
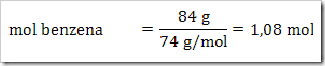
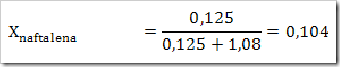
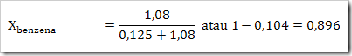
Hubungan Fraksi Mol, Kemolalan dan Kemolaran
Konstrasi larutan dapat dikonfersikan dari satuan ke satuan yang lain.misalnya suatu larutan 40% NaNO3 dengan massa jenis 1,36 g/mL. Hitunglah fraksi mol, kemolalan dan kemolaran dari NaNO3? (Mr = 85)
Jawab
Massa larutan = 1000 mL x massa jenis
= 1000 mL x 1,36 g/mL
= 1360 gram
NaNO3 yang terlarut dalam 1 liter larutan
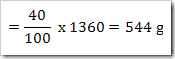
Massa molar NaNO3 = 85 g/mol
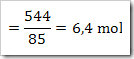
Jumlah air dalam larutan
= massa larutan – massa NaNO3
= (1360-544) gram = 816 g
= 816 / 18 = 45,33 mol
a. Fraksi mol NaNO3
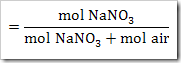

Fraksi mol H2O
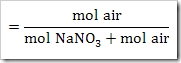

b. Kemolalan
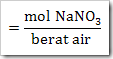
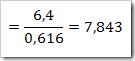
c. Kemolaran









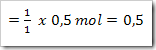
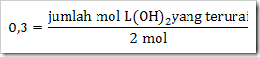
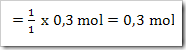




gan nanya soal dong,
ReplyDeletesuatu larutan aseton dlm air, mengandung 8,6mg aseton dalam 21,4 liter larutan. jika kecepatan (gr/ml) 0,997 gr/cm. hitunglah konsentrasi aston dalam satuan
a ppm
b ppb