Persamaan awal mengenai perilaku gas tidaklah mudah diterangkan seperti yang kita harapkan bila diingat bahwa Torricelli dan Boyle bekerja dalam abad 17, sedangkan teori atom mengenai atom baru dikemukakan pada awal abad 18. Terdapat saran yang fantastis seperti keterangan menenai kerja barometer yang didasarkan pada kekuatan yang terbatas dari funiculus (Latin : tali kecil) yang tidak tampak, yang melekatkan diri antara puncak barometer dan permukaan merkurium.
Boyle sendiri bekerja tekun
dengan dugaan menarik bahwa partikel-partikel gas mungkin mirip tepi
wool domba yang lenting dan kusut. Sifat gas yang membangkitkan rasa
ingin tahu yakni memuai mengisi secara seragam semua ruangan yang
tersedia, merangsang argumen yang menghidupkan kembali dilema Yunani
kuno.
Adakah materi bersifat sinambung atau kah berpartikel-partikel, artinya
apakah terus-menerus dapat dibelah ataukah terdiri dari atom-atom dan
kehampaan?
Dari berbagai ciri-ciri gas para ilmuwan kuno membangun suatu gambaran teoritis yang masuk akal mengenai bangun dasar dari suatu gas. Berikut beberapa pengamatan eksperimen yang dibuat seabad yang lalu, disandingkan dengan gagasan yang didukung oleh masing-masing.
Butir-butir teoritis yang
dijelaskan di atas menyusun teori partikel dari gas-gas atau teori
kinetik molekul gas. Teori ini dapat diringkas sebagai berikut.
Dari berbagai ciri-ciri gas para ilmuwan kuno membangun suatu gambaran teoritis yang masuk akal mengenai bangun dasar dari suatu gas. Berikut beberapa pengamatan eksperimen yang dibuat seabad yang lalu, disandingkan dengan gagasan yang didukung oleh masing-masing.
| Fakta | Teori |
| Contoh gas dengan massa berapa saja akan mengisi wadah yang tertutup. Jika wadah tersebut berpori, gas akan bocor keluar lewat lubang yang tak terlihat dengan mikroskop. | Gas terbuat dari partikel-partikel subpartikel, yang disebut molekul, yang selalu bergerak dengan cepat dan acak. Sebuah molekul bergerak lurus sampai bertabrakn dengan molekul lain atau dinding wadah. Karena kecil, molekul dapat bergerak melewati pori-pori halus dan meninggalkan wadah. |
| Zat dengan massa tertentu, dalam bentuk gas akan bervolume jauh lebih besar daripada dalam keadaan cair. | Pada tekanan dan temperatur yang biasa, molekul-molekul gas berjarak jauh satu sama lain. |
| Dalam suatu wadah tertutup suatu gas melakukan tekanan (gaya persatuan luas) yang seragam pada tiap bagian dinding wadah | Tekanan gas adalah jumlah gaya-gaya pada dinding akibat tabrakan acak oleh bermilyar-liyar molekul yang terus bergerak secara acak. |
| Bila tekanan pada suatu gas ditidakan gas tersbut akan memuai. | Molekul-molekul bergerak dengan arah yang acak dan tarik menarik antar sesamanya kecil. Jika lebih banyak ruang yang tersedia maka molekul-molekul ini akan berjarak lebih besar satu dengan yang lain. |
| Volume kuantitas gas tertentu dapat dikurangi dengan memampatkannya. | Molekul-molekul gas dapat dipaksa berdekatan satu dengan yang lain dengan manmbah tekanan. |
| Dalam suatu wadah tetrtutup gas melalkukan gaya tertentu. Selam volume tetap sama dan tidak ada kalor yang dilepaskan atau diterima, tekanan akan tetap sampai kapanpun. | Tabrakan antar molekul bersifat elastis (lenting sempurna) artinya tidak terjadi perubahan netto energi kinetik. Jika energi kinetik terbuang, temperatur dan tekanan akan berkurang. |
| Dalam suatu wadah tertutup dengan volume tertentu suatu gas melalukan tekanan tertentu selama temperatur tidak berubah. Jika gas itu dipanasi, tekanan akan meningkat. Jika gas di dinginkan tekanan akan berkurang. | Jika temperatur bertambah, molekul bergerak lebih cepat dan menabrak dinding lebih kuat dan lebih sering. Energi kinetik molekul-molekul berbanding lurus dengan temperatur mutlak. |
| Jika gas cukup dimampatkan dan barangkali didinginkan pada waktu bersamaan, maka gas tersebut akan mencair. | Molekul-molekul gas, sebanarnya tarik menarik satu dengan yang lai, cukup untuk mengikat satu dengan yang lain sebagai suatu cairan pada kondisi yang sesuai. |
| Suatu benda yang bergerak misolnya bola golf atau palu, mempunyai sejumlah energi kinetik tertentu, yang bergantung pada : massa dan kecepatan benda itu. Dalam persamaan E.K = ½ mv2 | Fakta bahwa E.K = ½ mv2 Berlaku untuk semua benda bergerak, merupakan alasan kuat untuk yakin bahwa rumus tersebut berlaku untuk molekul-molekul gas yang terus bergerak. |
| Eksperimen menunjukan bahwa gas yang lebih rapat berdifusi lebih lambat daripada gas yang kurang rapat pada temperatur yang sama. | Pada temperatur yang sama. Molekul-molekul yang berat bergerak lebih lambat daripada molekul-molekul ringan, energi kinetik rata-rata mereka sama. |
-
Gas terdiri dari molekul yang berjarak jauh satu dengan yang lain dalam ruangan yang tanpa molekul-molekul ini akan hampa.
-
Molekul bergerak kian kemari dengan kecepatan tinggi, dengan lintasan lurus tetapi arahnya acak.
-
Molekul-molekul saling bertabrakan, tetapi tabrakan ini bersifat lenting sempurna sehinga tidak kilangan energi kinetik.
-
Kecepatan rata-rata molekul
bertambah jika temperatur naik dan berkurang jika temperatur turun.
Dalam contoh suatu gas murni molekul-molekul bergerak tidak dengan
kecepatan yang sama, tetapi untuk suatu gas pada temperatur tertentu,
kecepatan rata-rata dalam semua contoh akan sama, tak bergantung pada
tekanan.
-
Pada temperatur tertentu,
molekul gas A dan B mempunyai energi kinetik rata-rata yang sama.
Membesarnya massa m, ditambah dengan menurunnya kecepatan rata-rata, v.
Artinya suatu temperatur tertentu K.E = ½ mA.vA2 = ½ mB vB2. Jika mA lebih besar daripada mB, maka vA harus lebih kecil daripada vB.
LARUTAN ELEKTROLIT DAN NONELEKTROLIT
Posted by pada 18 Juni 2011
Selain dari
ikatannya, terdapat cara lain untuk mengelompokan senyawa yakni
didasarkan pada daya hantar listrik. Jika suatu senyawa dilarutkan dalam
air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit.
Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CO(NH2)2) merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
Cara pengujian
suatu senyawa termasuk elektrolit atau nonelektrolit dapat dilakukan
dengan meghubungkan baterai dan lampu bohlam atau amperemeter kemudian
ujung kabel dihubungkan pada dua buah elektroda. Satu sebagai anoda (+),
satu sebagai katoda (-).
Setelah semua
terhubung pengujian dapat dilakukan dengan mencelupkan kedua elektroda
ke dalam larutan yang akan diuji dan perhatikan agar kedua elektrode
tidak bersentuhan.
Ketika elektroda dicelupkan, jika lampu bohlam menyala dan atau
terbentuk gelembung udara pada kedua elektroda maka senyawa atau zat
tersebut termasuk golongan senyawa elektrolit.
Begitu pula
sebaliknya, ketika elektroda dicelupkan lampu bohlam tidak menyala dan
atau tidak terbentuk gelembung udara pada kedua elektroda, maka senyawa
atau zat tersebut termasuk golongan senyawa nonelektrolit.
Gambar Rangkaian Alat pengujian larutan
Mengapa Larutan Menghantarkan Arus Listrik
Larutan
elektrolit dapat menghantarkanarus listrik sedangkan larutan
nonelektrolit tidak menghantarkan arus listrik, telah dijelaskan oleh
seorang ahli kimia swedia Svante August Arrhenius (1859-1927).
Didasarkan pada teori ionisasi Arhenius, larutan elektrolit dapat
menghantarkan arus listrik karena di dalam larutan terkandung atom-atom
atau kumpulan atom yang bermuatan listrik yang bergerak bebas. Atom atau
kumpulan atom yang bermuatan listrik disebut ion.
Perubahan suatu senyawa menjadi ion-ion dalam suatu larutan disebut proses ionisasi. Proses
ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion,
umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun
terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan
dalam air dapat ditulis dalam dua persamaan:
Ketika diberi
beda potensial, Ion yang bermuatan negatif bergerak menuju anoda (+)
sedangkan ion yang bermuatan positif bergerak menuju katoda (-) karena
adanya perbedaan muatan. Aliran ion inilah yang menyebabkan larutan
elektrolit dapat menghantarkan arus listrik.
Senyawa seperti
glukosa, etanol, gula tebu dan larutan urea dalam bentuk padatan,
lelehan maupun larutan tidak dapat menghantarkan arus listrik karena
tidak mengalami ionisasi atau tetap dalam bentuk molekul.
Sumber Ion Dalam Larutan Elektrolit
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu senyawa ionik dan senyawa kovalen polar.
Senyawa Ionik
Senyawa ionik
tersusun atas ion-ion sekalipun dalam dalam bentuk padat atau kering.
Misalnya NaCl dan NaOH. NaCl tersusun dari ion Na+ dan ion Cl¯ sedangkan NaOH tersusun dari ion Na+ dan ion OH–.
Senyawa-senyawa
ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena
ion-ion yang terikata dengan kuat, sehingga tidak ion-ion tersebut
tidak mengalami mobilisasi ketika diberi beda potensial.
Namun apabila
senyawa ionik dilarutkan dalam pelarut polar misalnya air, maka senyawa
ionik adalah suatu elektrolit. Hal ini disebabkan ion-ion yang awalnya
terikat kuat pada kisi terlepas kemudian segera masuk dan menyebar
dengan air sebagai medium untuk bergerak.
Perlu diketahui
bahwa semua senyawa ionik yang yang dapat larut dalam pelarut polar
seperti air dan lelehan senyawa ionik merupakan suatu elektrolit. Tetapi
lelehan senyawa ionik memiliki daya hantar listrik yang lebih baik
dibanding larutannya.
Hal ini
disebabkan susunan ion-ion dalam lelehan senyawa ionik lebih rapat
dibanding dalam bentuk larutan, sehingga ion-ion yang ada lebih mudah
atau lebih cepat bergerak menuju anoda dan katoda ketika diberi beda
potensial.
Senyawa kovalen polar
Senyawa-senyawa
kovalen baik kovalen polar maupun nonpolar dalam keadaan murni tidak
dapat menghantarkan arus listrik. Tetapi senyawa kovalen polar dapat
menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai.
Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu
membentuk ion-ion.
Misalnya
senyawa kovalen polar mampu membentuk ion di dalam air sehingga dapat
menghantar arus listrik. Tetapi senyawa kovalen polar tidak mampu
membentuk ion di dalam benzena sehingga tidak dapat menghantarkan arus
listrik. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Elektrolit Kuat dan Elektrolit Lemah
Senyawa yang
seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion
sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat. Senyawa
yang termasuk elektrolit kuat mempunyai daya hantar listrik yang
relatif baik walaupun memiliki konsentrasi yang kecil. Sebaliknya
senyawa yang sebagian kecil terurai menjadi ion disebut elektrolit lemah.
Senyawa yang termasuk elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat). Beberapa contoh elektrolit kuat dan elektrolit lemah seperti yang tertera pada Tabel.
| Elektrolit kuat | Nama | Elektrolit lemah | Nama |
| HCl H2SO4 NaCl NaOH |
Asam klorida Asam sulfat Natrium klorida Natrium hidroksida |
CH3COOH NH3 NH4OH H2S |
Asam asetat Amonia Amonium klorida Asam sulfida |
Menggunakan rangkaian seperti pada Gambar, suatu larutan termasuk elektrolit kuat atau lemah dapat diketahui.
Larutan yang memberikan nyala bohlam terang termasuk elektrolit kuat
sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan
gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau
perubahan apa-apa ketika kedua elektroda dicelupkan, maka larutan
tersebut termasuk larutan nonelektrolit.
Misalnya HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M.
Maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang
lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat dari
lampu bohlam yang menyala lebih terang.
Menggunakan
teori Arhenius dapat disimpulkan bahwa jumlah ion yang terbentuk dari
HCl lebih banyak dibanding dua senyawa lainnya. Artinya di dalam air
sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H+ dan ion CH3COO‾ dan NH4+ dan OH‾ atau sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Elektrolit asam, basa dan Garam
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah.
Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit
kuat. Garam-garam yang sukar larut dalam air berupa elektrolit lemah
walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah
-
Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3.
-
Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2.
-
Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah
-
Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S.
-
Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2.
-
Garam-garam yang sukar larut, misalnya: AgCl, CaCrO4 dan PbI2
Derajat Ionisasi
Ketika suatu
zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni
zat tersebut larut secara sempurna, larut sebagian dan tidak larut
dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat disosiasi atau derajat ionisasi (α).
Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai
Harga α di antara 0 ≤ α ≥ 1. α ≤ 0 artinya tidak terjadi ionisasi, sedangkan α ≥ 1 artinya terjadi ionisasi secara sempurna.
Contoh soal
Bila diketahui suatu reaksi sebagai berikut
Dari reaksi di atas tentukan derajat ionisasinya, bila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H+ sebanyak 0,5 mol.
Jawab
Derajat ionisasinya adalah
Contoh soal
Suatu basa dengan rumus L(OH)2 bila dilarutkan dalam air teionisasi sesuai reaksi berikut:
Jika mula-mula L(OH)2 sebanyak 2 mol dengan derajat ionisasi sebesar 0,3. Tentukanlah
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Jawab
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Kegiatan Laboratorium
Lakukan kegiatan berikut untuk menguji daya hantar listrik beberapa zat.
Alat dan Bahan
| v Gelas kimia 100 ml v Baterai v Air suling 50 mL v Larutan HCl 1M 50 mL v Larutan asam cuka (CH3COOH) 1M 50 mL v Larutan NaOH 1M 50 mL |
v Larutan ammonia (NH3) 1 M 50 mL v Larutan gula 50 mL v Larutan NaCl 1M 50 mL v Etanol 70% 50 mL v Air leding dan air sumur 50 mL |
Beberapa hal yang perlu diperhatikan dan catat pada lembar pengamatan
1) Amati dengan seksama, apa yang terjadi pada lampu dan batang elektroda.
2) Diantara bahan yang diuji, manakah yang dapat menghantarkan arus listrik dan manakah yang tidak dapat menghantarkan listrik.
3) Jika ada yang menghantarkan arus listrik manakah yang termasuk elektrolit kuat dan manakah yang termasuk elektrolit lemah.
4) Diantara larutan elektrolit di atas, manakah yang memiliki ikatan ion dan ikatan kovalen.
FILE ARTIKEL INI SILAKAN DOWNLOAD DISINI…!!!!
ARTIKEL YANG DISARANKAN :
tata nama senyawa kimia
Posted by pada 22 Februari 2011
Tata Nama Senyawa Biner
Senyawa biner merupakan yang tersusun dari dua unsur. Unsur tersebut dapat berupa logam dengan non logam atau keduanya non logam.
Tata Nama Senyawa Biner Logam-Nonlogam
Untuk senyawa biner yang terdiri dari logam dan nonlogam yang hanya mempunyai satu bilangan oksidasi atau senyawa ionik penamaannya adalah unsur logam ditulis atau disebutkan terlebih dahulu kemudian diikuti oleh unsur non logam ditambah akhiran –ida. Beberapa contoh senyawa biner logam dan non logam dapat dilihat pada tabel
Untuk unsur logam yang mempunyai bilangan oksidasi lebih dari satu (umumnya logam transisi), penamaanya adalah menulis atau menyebut nama logam terlebih dahulu diikuti dengan angka Romawi yang diberi tanda kurung kemudian diikuti dengan nama unsur nonlogam, ditambah akhiran –ida. Metode ini dikenal dengan sistem stock
dan dapat dipakai untuk setiap senyawa biner dari logam dan nonlogam,
namun pada senyawa ionik dengan satu bilangan oksidasi jarang digunakan
bahkan tidak pernah disebutkan.
Angka romawi yang diberikan menunjukan bilangan oksidasi dari unsur logam. Oleh sebab itu, tidak lasim apabila angka romawi yang diberikan berada diantara logam dan non logam. Misalnya FeCl2 penulisan nama yang benar adalah besi(II) klorida, bukan besi (II) klorida. Beberapa contoh penamaan senyawa menggunakan sistem stock seperti yang tertera pada Tabel.
Tata Nama Senyawa Biner Nonlogam
Untuk penamaan senyawa biner yang dbentuk dari dua unsur nonlogam penamaannya adalah menyebut atau menulis unsur yang cenderung bermuatan positif (umumnya memiliki bilangan oksidasi positif) kemudian diikuti dengan unsur yang cenderung bermuatan negati (umumnya memiliki bilangan oksidasi negatif), ditambah akhiran -ida. Berikut adalah urutan penulisan atau penamaan untuk senyawaan biner dari nonlogam:
B ─ Si ─ C ─ Sb ─ As ─ P ─ N ─ H ─ Te ─ Se ─ S ─ I ─ Br ─ Cl ─ O ─ F
Unsur-unsur yang ada disebelah kiri dari suatu unsur maka ditulis atau disebut terlebih dahulu.
Senyawa biner nonlogam yang hanya membentuk satu senyawa dengan atom lain penamaan adalah menyebut atau menulis terlebih dahulu unsur yang cenderung bermuatan positif diikuti unsur yang cenderung bermuatan negatif ditambah akhiran -ida.
Contoh:
HCl : hidrogen klorida
H2S : hidrogen sulfida
Senyawa biner nonlogam yang dapat membentuk dua atau lebih senyawa dengan unsur yang sama, penamaannya menyerupai penamaan senyawa biner nonlogam, tetapi diawali dengan menyebut awalan yang menyatakan jumlah atau banyaknya setiap unsur nonlogam. Meskipun banyak unsur nonlogam menunjukkan bilangan oksidasi yang berbeda, namun dalam penulisan atau penyebutan jarang jarang disebutkan atau ditunjukkan dengan angka Romawi. Awalan Yunani dan Latin untuk satu sampai sepuluh berturut–turut adalah mono, di, tri, tetra, penta, heksa, hepta, okta, nona, dan deka. Beberapa contoh senyawa biner nonlogam yang dapat membentuk dua atau lebih senyawa dengan unsur yang sama, seperti yang tertera pada Tabel.
Tata Nama Senyawa yang terdiri dari Ion-Ion Poliatom
Tatanama berikut adalah untuk senyawa-senyawa yang terdiri dari anion dan kation poliatom. Untuk senyawa ion yang kationnya hanya mempunyai satu bilangan oksidas penamaannya adalah menyebut atau menulis nama kation terlebih dahulu sesuai nama unsurnya kemudian diikuti nama anion poliatomnya. Sedangkan untuk senyawa ion yang kationnya mempunyai bilangan oksidasi lebih dari satu, penamaannya adalah menyebut atau menulis nama kation terlebih dahulu dikuti dengan bilangan oksidasi kation yang ditunjukan dengan angka romawi yang diberi tanda kurung dan diikuti nama anion poliatomnya. Nama untuk beberapa ion yang biasanya ditemukan dapat dilihat pada Tabel bagiam bawah sedangkan beberapa contoh senyawa yang dibentuk dari ion poliatom seperti yang tertera pada Tabel.
Senyawa biner merupakan yang tersusun dari dua unsur. Unsur tersebut dapat berupa logam dengan non logam atau keduanya non logam.
Tata Nama Senyawa Biner Logam-Nonlogam
Untuk senyawa biner yang terdiri dari logam dan nonlogam yang hanya mempunyai satu bilangan oksidasi atau senyawa ionik penamaannya adalah unsur logam ditulis atau disebutkan terlebih dahulu kemudian diikuti oleh unsur non logam ditambah akhiran –ida. Beberapa contoh senyawa biner logam dan non logam dapat dilihat pada tabel
| Rumus molekul | Nama | Rumus molekul | Nama |
| NaClCaCl2
Na2O MgBr2 KBr Al2S3 |
natrium kloridakalsium klorida
natrium oksida magnesium bromida kalium bromida aluminium sulfida |
Rb2SBa3N2
SrO NaH Mg3P2 |
rubium sulfidabarium nitrida
stronsium oksida natrium hidrida magnesium fosfida |
Angka romawi yang diberikan menunjukan bilangan oksidasi dari unsur logam. Oleh sebab itu, tidak lasim apabila angka romawi yang diberikan berada diantara logam dan non logam. Misalnya FeCl2 penulisan nama yang benar adalah besi(II) klorida, bukan besi (II) klorida. Beberapa contoh penamaan senyawa menggunakan sistem stock seperti yang tertera pada Tabel.
| Rumus | Nama | Rumus | Nama |
| FeCl2FeCl3
CuCl2 CuCl Fe2O3 PbO |
besi(II) kloridabesi(III) klorida
tembaga(ll) klorida tembaga(l) klorida besi(III) oksida timbal(II) oksida |
PbO2SnCl2
SnCl4 SnO Sn2O |
timbal(IV) oksidatimah(II) klorida
timah(IV) klorida timah(II) oksida timah(I) oksida |
Untuk penamaan senyawa biner yang dbentuk dari dua unsur nonlogam penamaannya adalah menyebut atau menulis unsur yang cenderung bermuatan positif (umumnya memiliki bilangan oksidasi positif) kemudian diikuti dengan unsur yang cenderung bermuatan negati (umumnya memiliki bilangan oksidasi negatif), ditambah akhiran -ida. Berikut adalah urutan penulisan atau penamaan untuk senyawaan biner dari nonlogam:
B ─ Si ─ C ─ Sb ─ As ─ P ─ N ─ H ─ Te ─ Se ─ S ─ I ─ Br ─ Cl ─ O ─ F
Unsur-unsur yang ada disebelah kiri dari suatu unsur maka ditulis atau disebut terlebih dahulu.
Senyawa biner nonlogam yang hanya membentuk satu senyawa dengan atom lain penamaan adalah menyebut atau menulis terlebih dahulu unsur yang cenderung bermuatan positif diikuti unsur yang cenderung bermuatan negatif ditambah akhiran -ida.
Contoh:
HCl : hidrogen klorida
H2S : hidrogen sulfida
Senyawa biner nonlogam yang dapat membentuk dua atau lebih senyawa dengan unsur yang sama, penamaannya menyerupai penamaan senyawa biner nonlogam, tetapi diawali dengan menyebut awalan yang menyatakan jumlah atau banyaknya setiap unsur nonlogam. Meskipun banyak unsur nonlogam menunjukkan bilangan oksidasi yang berbeda, namun dalam penulisan atau penyebutan jarang jarang disebutkan atau ditunjukkan dengan angka Romawi. Awalan Yunani dan Latin untuk satu sampai sepuluh berturut–turut adalah mono, di, tri, tetra, penta, heksa, hepta, okta, nona, dan deka. Beberapa contoh senyawa biner nonlogam yang dapat membentuk dua atau lebih senyawa dengan unsur yang sama, seperti yang tertera pada Tabel.
| Rumus | Nama | Rumus | Nama |
| N2ON2O5
CO CS2 SO3 SO2 |
dinitrogen monoksidadinitrogen pentaoksida
karbon monoksida karbon disulfida sulfur trioksida sulfur dioksida |
CCl4PCl5
SF6 Cl2O5 Cl2O7 As4O6 |
karbon tetrakloridafosfor pentaklorida
sulfur heksaflorida dikloro pentaoksida dikloro heptoksida tetraarsenik heksosida |
Tatanama berikut adalah untuk senyawa-senyawa yang terdiri dari anion dan kation poliatom. Untuk senyawa ion yang kationnya hanya mempunyai satu bilangan oksidas penamaannya adalah menyebut atau menulis nama kation terlebih dahulu sesuai nama unsurnya kemudian diikuti nama anion poliatomnya. Sedangkan untuk senyawa ion yang kationnya mempunyai bilangan oksidasi lebih dari satu, penamaannya adalah menyebut atau menulis nama kation terlebih dahulu dikuti dengan bilangan oksidasi kation yang ditunjukan dengan angka romawi yang diberi tanda kurung dan diikuti nama anion poliatomnya. Nama untuk beberapa ion yang biasanya ditemukan dapat dilihat pada Tabel bagiam bawah sedangkan beberapa contoh senyawa yang dibentuk dari ion poliatom seperti yang tertera pada Tabel.
| Rumus | Nama | Rumus | Nama |
| Ba(NO3)2KCN
K2Cr2O7 FeSO4 |
Barium nitratKalium sianida
Lalium dikromat Besi(II) sulfat |
Fe2(SO4)3NiSO4
PbSO4 Na3PO4 |
Besi(III) sulfatNikel(II) sulfat
Tembaga(II) sulfat Natrium fosfat |
| Kation | Nama kation | Anion | Nama anion |
| Li+Na+
K+ NH4+ Ag+ Mg2+ Ca2+ Ba2+ Cd2+ Zn2+ Cu2+ Hg22+ Hg2+ Mn2+ Co2+ Ni2+ Pb2+ Sn2+ Fe2+ Fe3+ Al3+ Cr3+ |
Ion litiumion natrium
Ion kalium Ion amonium Ion magnesium Ion kalsium Ion barium Ion kadmium Ion seng Ion tembaga(II) atau ion kuprat Ion merkuri(I) atau ion merkurit Ion merkuri(II) atau ion merkurat Ion mangan(II) atau ion manganit Ion kobalt(II) atau ion kobaltit Ion nikel(II) atau ion nikelit Ion timbal(II) atau ion plumbit Ion timah(II) atau ion stanit Ion besi(II) atau ion ferit Ion besi(III) atau ion ferat Ion aluminium Ion kromium (I) atau ion kromat |
F‾Cl‾
Br‾ I‾ OH‾ CN‾ ClO‾ ClO2‾ ClO3‾ ClO4‾ CH3COO‾ MnO4‾ NO2‾ NO3‾ SCN‾ O2‾ S2‾ HSO3‾ HSO4‾ SO32‾ SO42‾ HCO3‾ CO32‾ CrO42‾ Cr2O72‾ PO43‾ AsO43‾ |
Ion fluoridaIon klorida
Ion bromida Ion iodida Ion hidroksida Ion sianida Ion hipoklorit Ion klorit Ion klorat Ion perklorat Ion asetat Ion permanganat Ion nitrit Ion nitrat Ion tiosianat Ion oksida Ion sulfida Ion hidrogen sulfit atau ion bisulfit Ion hidrogen sulfat atau ion bisulfat Ion sulfit Ion sulfat Ion hidrogen karbonat atau ion bikarbonat Ion karbonat Ion kromat Ion dikromat Ion fosfat Ion arsenat |
perbedaan senyawa ionik dan senyawa kovalen
Posted by pada 2 Desember 2010
Sebenarnya batas-batas antara senyawa ionik dan senyawa kovalen tidak
terdapat garis pemisah yang jelas. Hal ini disebabkan senyawa ionik
dapat mengandung sifat kovalen dan begitupun sebaliknya senyawa-senyawa
kovalen dapat mengandung sifat ionik.
Suatu
senyawa di anggap senyawa kovalen, bila sifat kovalennya lebih dominan,
begitu sebaliknya suatu senyawa dianggap senyawa ionik bila sifat
ioniknya lebih dominan.
Titik Didih, Titik Leleh dan Wujud
Senyawa ion pada suhu kamar sebagian besar berbentuk padat, keras tetapi
mudah patah dengan titik didih dan titik leleh relatif tinggi sekitar
800 ºC. Sedangkan senyawa kovalen pada suhu kamar dapat berupa padat, cair dan gas dengan titik didih dan titik leleh rendah sekitar 200 ºC.
Namun khusus untuk intan walaupun mememiliki ikatan kavalen namun
ikatan yang dimiliki sangat kuat sehingga titik didihnya sangat tinggi
bahkan lebih tinggi senyawa ionik.
Pada senyawa kovalen dan ionik keduanya memiliki ikatan yang kuat tetapi
pada senyawa kovalen gaya tarik antar molekulnya lemah. Sedangkan pada
senyawa ionik gaya tarik antar molekulnya sangat kuat. Oleh sebab itu
pada senyawa ionik diperlukan energi yang lebih tinggi untuk mengalahkan
gaya tersebut. Akibatnya senyawa ionik memiliki titik leleh dan titik didih yang lebih tinggi dibanding senyawa senyawa kovalen.
Kelarutan
Senyawa ionik dan senyawa kovalen polar cenderung larut dalam pelarut
polar sedangkan senyawa kovalen nonpolar cenderung larut dalam pelarut
nonpolar. Misalnya senyawa ion cenderung larut dalam air dibanding dalam
pelarut-pelarut organik seperti kloroform, dietil eter dan benzena.
Daya Hantar Listrik
Senyawa-senyawa ionik dalam bentuk padat merupakan konduktor listrik dan
panas yang buruk tetapi lelehan dan larutannya dalam pelarut polar
merupakan konduktor listrik dan panas yang baik. Sedangkan pada senyawa
kovalen baik dalam bentuk padat maupun lelehannya merupakan konduktor
listrik dan panas yang jelek.
Hal
ini disebabkan senyawa ionik pada keadaan padat gaya ikat yang
terbentuk antara ion positif dan ion negatif (kisi kristal) sangat kuat
sehingga tidak memungkinkan terjadinya mobilisasi ion-ion. Tetapi
senyawa ionik dapat menghantarkan arus listrik bila dileburkan atau
dilalarutkan dalam pelarut polar, hal ini disebabkan ion-ion yang
terikat pada kisi kristal telah terlepas sehingga ion-ion ini dapat
bebas bergerak ke segala arah. Sedangkan untuk senyawa kovalen baik
dalam bentuk padat maupun lelehan tidak dapat menghantarkan arus
listrik, karena tidak terdapat ion yang bergerak bebas.
Senyawa kovalen walaupun berupa konduktor listrik dan panas yang buruk,
tetapi senyawa kovalen polar mampu menjadi konduktor listrik baik
apabila dilarutkan dalam pelarut-pelarut tertentu. Misalnya bila HCl
yang dilarutkan dalam pelarut air dan benzena. HCl yang larut dalam air
merupakan konduktor listrik yang baik,
tetapi berupa konduktor listrik yang jelek dalam pelarut benzena. Hal
ini terjadi karena HCl di dalam air mampu membentuk ion-ion sedangkan
pada benzena HCl tidak mampu membentuk ion-ion. Ion yang terbentuk dalam
air merupakan reaksi yang terjadi antara molekul hidrogen klorida
dengan molekul air. Berikut rekasi yang terjadi:
HCl + H2O → H3O+ + Cl‾
Perlu dikatahui bahwa senyawa-senyawa yang dalam air dapat
menghantarkan arus listrik baik senyawa ionik maupun senyawa kovalen
polar, air hanya sebagai medium agar ion-ion bebas bergerak.
Air sendiri merupakan senyawa kovalen polar dan merupakan konduktor
listrik yang jelek. Daya hantar listrik air hanya dapat dideteksi dengan
peralatan yang benar-benar peka.
Ikatan Kovalen
Posted by pada 2 Desember 2010
Istilah ikatan kovalen (covalent bond) pertama kali muncul pada tahun 1939. Awalan co- berarti bersama-sama, berasosiasi dalam sebuah aksi, berkolega.
Ikatan kovalen yaitu ikatan yang terjadi karena pemakaian bersama
pasangan elektron valensi oleh atom yang berikatan. Elektron-elektron
yang terlibat dalam pembentukan ikatan kovalen tidak berpindah secara
sempurna dari atom-atom yang berikatan. Semua senyawa organik dan
beberapa senyawa seperti HCl, NH3, PCl3, PCl5, CCl4, CHCl3, CO2, , HgCl2, GeF4, SnCl4, Cl2, N2, O2 dan F2 merupakan beberapa contohn senyawa-senyawa dengan ikatan kovalen.
Ikatan kovalen terjadi akibat atom yang akan berikatan tidak mampu
melepaskan elektron, hal ini disebabkan ikatan kovalen terbentuk dari
unsur-unsur yang memiliki afinitas elektron tinggi dan perbedaan
keelektronegatifannya kecil.
Atom nonlogam cenderung untuk menerima elektron sehingga jika sesama
atom nonlogam membentuk sebuah ikatan maka ikatan yang terbentuk dapat
dilakukan dengan cara mempersekutukan elektronnya dan akhirnya terbentuk
pasangan elektron yang dapat dipakai secara bersama untuk untuk
mencapai konfigurasi gas mulia. Ikatan kovalen Berdasarkan jumlah
pasangan elektron yang digunakan untuk berikatan ikatan kovalen dapat
dibagi menjadi 3 jenis yaitu
-
Ikatan kovalen yang paling umum adalah ikatan kovalen tunggal dengan hanya satu pasang elektron yang terbagi di antara dua atom. Ia biasanya terdiri dari satu ikatan sigma. Semua ikatan yang memiliki lebih dari satu pasang elektron disebut sebagai ikatan rangkap atau ikatan ganda.
-
Ikatan yang berbagi dua pasangan elektron dinamakan ikatan kovalen rangkap dua biasanya terdiri dari satu ikatan sigma dan satu ikatan pi. Contohnya pada etilen(CH2CH2).
-
Ikatan yang berbagi tiga pasang elektron dinamakan ikatan kovalen rangkap tiga biasanya terdiri dari satu ikatan sigma dan dua ikatan pi. Contohnya pada hidrogen sianida (HCN). hidrogen sianida berbeda dengan asam sianida walaupun keduanya ditulis sebagai HCN. hidrogen sianida dapat berupa gas, cairan ataupun suatu padatan, sedngkan asam sianida artinya berada dalam larutan atau berada dalam air.
Ikatan Kovalen Tunggal
Ikatan kovalen tunggal adalah ikatan kovalen yang terjadi karena penggunaan bersama satu pasang elektron. Ikatan yang terbentuk digambarkan menggunakan satu garis lurus. Misalnya molekul pembentukan molekul H2 dan HF.
Konfigurasi elektron
1H = 1
9F = 2, 7
Pada pembentukan molekul H2 setiap atom H memiliki 1 elektron valensi. Untuk memenuhi kaidah duplet, setiap atom H yang berikatan masing-masing atom menyumbangkan 1 elektronnya.
Pada pembentukan molekul HF, atom H
memiliki 1 elektron sedangkan F memiliki 7 elektron valensi. H untuk
memenuhi kaidah duplet memerlukan 1 elektron sedangkan F untuk memenuhi
kaidah oktet memerlukan 1 elektron. Untuk memenuhi kekurangan elektron
tersebut masing-masing atom menyumbangkan 1 elektron untuk digunakan
secara bersama.
Ikatan Kovalen Rangkap Dua
Ikatan kovalen rangkap dua adalah ikatan kovalen yang terjadi karena
penggunaan bersama dua pasang elektron. Ikatan yang terbentuk
digambarkan menggunakan dua garis lurus. Misalnya molekul O2 dan CO2.
Konfigurasi elektron
8O = 2, 6
6C = 2, 4
Pada molekul O2, Atom O memiliki 6 elektron valensi, maka agar diperoleh konfigurasi elektron yang stabil tiap-tiap atom O
memerlukan tambahan 2 elektron. Untuk memenuhi kekurangan elektron
tersebut masing-masing atom O menyumbang 2 elektron sehingga terdapat 2
pasang elektron yang digunakan secara bersama.
Pada molekul CO2,
atom C sebagai atom pusat yang mengikat 2 atom O. Atom O memerlukan 2
elektron mencapai kaidah oktet sedangkan atom C memiliki 4 elektron
valensi, untuk memenuhi kaidah oktet maka atom C
memerlukan 4 elektron. Untuk mengatasi kekurangan elektron tersebut
maka setiap atom perlu menyumbangkan elektronnya untuk membentuk ikatan.
Atom C sebagai atom pusat menumbang semua elektron valensinya sedangkan
atom O masing-masing menyumbang 2 elektron.
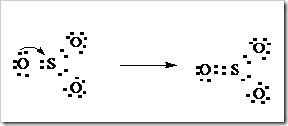
Gambar Rumus struktur Lewis oksigen dan karbondioksida
Ikatan Kovalen Rangkap Tiga
Ikatan kovalen rangkap tiga adalah ikatan kovalen yang terjadi karena
penggunaan bersama tiga pasang elektron. Ikatan yang terbentuk
digambarkan menggunakan tiga garis lurus. Misalnya pembentukan molekul
nitrogen (N2) dan molekul asetilen (C2H2).
Konfigurasi elektron
7N = 2, 5
6C = 2, 4
8O = 2, 6
Pada molekul N2
setiap atom N memiliki 5 elektron valensi, maka agar diperoleh
konfigurasi elektron yang stabil, setiap atom N memerlukan tambahan
elektron sebanyak 3. Untuk mengatasi kekurangan tersebut kedua atom N yang akan berikatan masing-masing menyumbangkan 3 buah elektron, sehingga terdapat 3 pasang elektron yang digunakan bersama.
Pada molekul etuna atau asetilen (C2H2)
terdiri dari dua atom C dan 2 atom H. Atom C mempunyai 4 elektron
valensi sedangkan atom H mempunyai 1 elektron. Setiap atom C untuk
memenuhi kaidah oktet memerlukan 4 elektron tambahan sedangkan H untuk
memenuhi kaidah duplet memerlukan 1
elektron. Untuk mengatasi hal tersebut maka setiap atom C menyumbangkan
1 elektron pada setiap atom H dan 3 elektron kepada atom C.
Gambar Struktur nitogen dan asetilena
Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi atau ikatan kovalen dativ adalah ikatan
kovalen yang terbentuk dimana elektron yang digunakan untuk membentuk
ikatan hanya berasal dari salah satu atom. Ikatan kovalen koordinasi disebut juga sebagai ikatan kovalen semipolar.
Pasangan elektron ikatan (PEI) yang menyatakan ikatan koordinasi
digambarkan dengan tanda anak panah yang arahnya dari atom donor
pasangan elektron menuju akseptor pasangan elektron.
Misalnya BF3 yang bereaksi dengan amoniak membentuk senyawa BF3.NH3. rekasi antara BF3 merupakan reaksi adisi.
Konfigurasi elektron
5B = 2, 3
9F = 2, 7
7N = 2, 5
Dari
konfigurasi elektron diketahui bahwa elektron valensi boron, fluor dan
nitrogen berturut-turut adalah 3, 7, dan 5. Pada BF3 diketahui bahwa boron sebagai atom pusat belum memenuhi kaidah oktet sedangkan atom N dalam amoniak sebagai atom pusat memenuhi kaidah oktet karena memiliki 1 pasang elektron bebas pada atom N.
Oleh sebab itu jika trifluoroboron direaksikan dengan amoniak maka akan terjadi reaksi adisi membentuk BF3.NH3 (aminatrifluoroboron). Senyawa yang terbentuk mendapat sumbangan elektron dari atom N untuk memenuhi kaidah oktet.
STOIKIOMETRI: rumus kimia, Rumus Empiris dan Rumus Molekul, persamaan reaksi, Hipotesis Avogadro
Posted by pada 31 Oktober 2010
!!!!!!!!!TULISANNYA TIDAK BEGITU RAPI HARAP MAKLUM!!!!!!!!!!!!!!!
Rumus KimiaSeperti yang telah disinggung rumus kimia merupakan salah satu ciri khas senyawa kimia. Rumus kimia suatu senyawa menyatakan lambang dan jumlah atom unsur yang menyusun suatu senyawa tanpa menyebut senyawa tersebut termasuk senyawa ionik atau kovalen. Rumus kimia sendiri terbagi menjadi rumus empiris dan rumus molekul.
Rumus molekul dan rumus empiris suatu senyawa hanya terjadi perbedaan jumlah atom, sedangkan atom unsur penyusun senyawa tetap. Namun demikian beberapa senyawa memiliki rumus molekul dan rumus empirisnya yang sama, misalnya H2O (air) dan NH3 (amoniak).
Jumlah atom dalam suatu rumus kimia menyatakan jumlah mol dari unsur terkait, jadi rumus kimia suatu senyawa merupakan perbandingan mol atom unsur penyusun senyawa tersebut. Dari perbandingan atom atau perbandingan mol ini dapat ditentukan perbandingan massa dan % massa dari unsur-unsur yang menyusun senyawa tersebut.
Untuk memperjelas hal ini perhatikan contoh berikut! misalnya vitamin C yang mengandung asam askorbat dengan rumus molekul C6H8O6, maka:
· Rumus molekul C6H8O6
· Perbandingan mol atom unsur
C : H : O = 6 : 8 : 6
· Perbandingan massa unsur
C : H : O = 6 x Ar. C : 8 x Ar.H : 6 x Ar.O
= (6 x 12) : (8 x 1) : (6 x 16)
= 72 : 8 : 96
· Jumlah perbandingan = Mr
72 + 8 + 96 = 176
· % massa masing-masing unsur
Berikut adalah rumus untuk menghitung % massa unsur dalam senyawa

Contoh soal menentukan kadar unsur dalam senyawa
Berapa persen (%) C, O, N dan H yang terdapat dalam urea, CO(NH2)2, jika diketahui Ar.C = 12, Ar.O = 16, Ar.N = 28 dan Ar.H =1?
Jawab
Langkah penyelesaian
1. Tentukan mol masing unsur-unsur dalam senyawa
Atom C = 1 mol
Atom O = 1 mol
Atom N = 2 mol
Atom H = 4 mol
2. Dari mol atom tentukan massa masing-masing unsur dalam senyawa dengan cara: kalikan dengan atom relatif (Ar) masing-masing atom
Atom C = 1 mol x 12 g/mol = 12 g
Atom O = 1 mol x 16 g/mol = 16 g
Atom N = 2 mol x 14 g/mol = 28 g
Atom H = 4 mol x 1 g/mol = 4 g
3. Jumlahkan massa semua atom yang telah diperoleh untuk memperoleh massa molekul (massa molekul relatif)
Atau dengan cara
4. Tentukan % massa masing-masing unsur dengan cara:
Massa masing-masing atom dibagi dengan massa semua atom dalam senyawa (massa molekul relatif) kemudian dikali 100%.
Dengan cara ini diperoleh:
Jika terdapat 120 Kg urea maka massa N adalah sebesar = 46, 67% x 120 Kg = 56 Kg.
Rumus Empiris dan Rumus Molekul
Rumus Empiris
Rumus empiris adalah rumus kimia yang menyatakan perbandingan terkecil jumlah atom-atom pembentuk senyawa. Misalnya senyawa etena yang memiliki rumus molekul C2H4, maka rumus empiris senyawa tersebut adalah CH2.
Dalam menentukan rumus empiris yang dicari terlebih dahulu adalah massa atau persentase massa dalam senyawa, kemudian dibagi dengan massa atom relatif (Ar) masing-masing unsur. artinya untuk menentukan rumus empiris yang perlu dicari adalah perbandingan mol dari unsur-unsur dalam senyawa tersebut.
Contoh
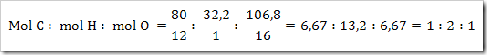
Suatu senyawa mengandugn 64,6 g natrium, 45,2 g belerang dan 90 g oksigen. Jika diketahui Ar.N = 23, Ar.S = 32, ddan Ar.O = 16. Maka tentukan rumus empiris senyawa tersebut?
Jawab
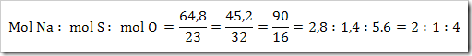
Jadi rumus empiris senyawa tersebut adalah Na2SO4.
Rumus Molekul
Rumus molekul adalah rumus kimia yang menyatakan jenis dan jumlah atom yang menyusun suatu senyawa. Misalnya: C2H4 (etena), CO(NH2)2 (urea) dan asam asetat atau asam cuka (CH3COOH). Rumus molekul dapat didefinisikan sebagai rumus kimia yang menyatakan perbandingan jumlah dan jenis atom sesungguhnya dari suatu senyawa.
Dari rumus molekul asam cuka diketahui bahwa rumus molekul tersebut tidak ditulis C2H4O2. Beberapa alasan rumus molekul asam cuka tidak ditulis demikian yaitu
1. Untuk membedakan dengan senyawa lain yang memiliki jumlah atom penyusun yang sama misalnya metil format (HCOOCH3).
2. Rumus molekul menggambarkan struktur molekul. Artinya dari rumus molekul kita dapat menunjukan atom-atom saling berikatan. Pada molekul asam cuka atom C yang pertama mengikat 3 atom H dan 1 atom C berikutnya dan atom C berikunya mengikat 2 atom O kemudian 1 atom O mengikat 1 atom H.
Contoh soal menentukan rumus molekul dari rumus empiris
200 g senyawa organik mempunyai massa molekul relatif = 180, senyawa ini terdiri dari 40% karbon, 6,6% hidrogen dan sisanya adalah oksigen. Jika diketahui Ar.C = 12, Ar.H = 1, dan Ar.O = 16. Maka tentukan rumus molekul senyawa ini?
Jawab
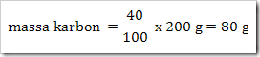
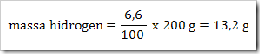
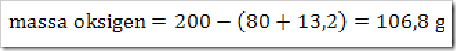
Jadi rumus empiris senyawa tersebut adalah CH2O
Dari rumus molekul yang telah diperoleh maka rumus molekul dapat ditentukan sbagai berikut
CH2O)n
(Ar C x n) + (2.Ar H x n) + (Ar.O) = Mr senyawa
12n + 2n + 16n = 180
30n = 180
n = 6
jadi rumus molekulnya adalah C6H12O6.
Menentukan Rumus Empiris dan Rumus Molekul Berdasarkan Ar dan Mr
Tentukan rumus molekul yang dimiliki senyawa dengan umus empiris CH, jika diketahui Mr senyawa tersebut adalah 78?
Jawab
Mr senyawa = (CH)n
78 = (12 + 1)n
78 = 13n
n = 6
jadi rumus molekul yang dimiliki senyawa tersebut adalah (CH)n = C6H6.
Contoh Soal
Massa molekul relatif suatu senyawa organik yang memiliki rumus empiris CH2O adalah 180, jika diketahui Ar.C= 12, Ar.H =1 Ar.O = 16, tentukan rumus molekul senyawa tersebut?
Jawab
Mr senyawa = (CH2O)n
180 = (12 + 2+ 16)n
180 = 30n
n = 6
jadi rumus molekul yang miliki senyawa tersebut adalah (CH2O)n = C6H12O6
Persamaan Reaksi
Seperti yang telah disinggung pada bab sebelumnya, bahwa perubahan kimia yang terjadi pada materi disebut juga reaksi kimia. Reaksi kimia yang terjadi dapat berlangsung secara eksoterm dan endoterm. Reaksi berlangsung secara eksoterm bila reaksi yang terjadi disertai pembebasan sejumlah energi, sedangkan kebalikan dari reaksi eksoterm disebut reaksi endoterm. Energi yang terlibat dapat berupa energi cahaya, energi panas dan energi-energi yang lainnya.
Pada reaksi kimia terdapat zat awal yang belum mengalami perubahan yang disebut reaktan atau pereaksi dan zat yang telah mengalami perubahan yang disebut produk atau zat hasil reaksi. Zat-zat yang terlibat dalam reaksi kimia dapat berupa unsur dan senyawa. Rekasi yang dimaksud disini bukan reaksi fisi atau reaksi fusi, sehingga zat-zat sebelum dan sesudah reaksi adalah zat-zat yang sama.
Reaksi kimia yang terjadi biasanya tulis dalam bentuk persamaan reaksi. Persamaan reaksi merupakan pernyataan yang mengungkapkan atau menggambarkan suatu proses kimia dengan menggunakan rumus kimia. Karena itu penulisan persamaan reaksi harus dapat menyatakan fenomena kimia yang sebenarnya, dimana zat-zat yang bereaksi dan zat-zat hasil reaksi harus tergambarkan dengan jelas. Agar lebih jelas perhatikan reaksi yang terjadi antara gas hidrogen dan gas oksigen untuk membentuk air, yang digambarkan sebagai berikut:
Keterangan:
·
· Huruf kecil dalam tanda kurung yang setelah rumus kimia (yang ditulis miring) menyatakan wujud zat. Wujud zat dinyatakan dengan singkatan yakni
§ s (solid) untuk zat berwujud padat
§ l (liquid) untuk zat berwujud cair
§ g untuk zat berwujud gas
§ aq (aqueous, baca: akues) untuk zat yang larut dalam air.
· Bilangan yang mendahului rumus kimia (2 pada H2, 1 pada O2 dan 2 pada H2O) disebut koefisien reaksi. Koefisien reaksi untuk menyetarakan jumlah atom atau jumlah molekul atau jumlah ion sebelum dan sesudah reaksi.
Pada contoh di atas dapat diketahui bahwa jumlah atom sebelum dan sesudah reaksi adalah sama, hal ini disebut persamaan setara. Berikut adalah penjumlahannya:
· Jumlah atom H di ruas kiri = jumlah atom H di ruas = 4
· Jumlah atom O di ruas kiri = jumlah atom O di ruas = 2
Untuk keperluan tertentu, persamaan reaksi dibubuhkan atribut lain. Berikut adalah beberapa atribut yang biasa ditemukan pada persaaman reaksi:
· Warna zat
· Δ ada bawah atau atas anak panah= tanda proses pemanasan
· = tanda kesetimbangan
· ΔH = harga perubahan entalpi
· E° = harga potensial elektrode
Tujuan dan Penyetaraan Persamaan Reaksi
Tujuan dari penyetaran persamaan reaksi yaitu untuk memenuhi hukum kekekalan massa atau hukum Lavoisier dan teori atom Dalton. Hukum kekealan massa berbunyi “dalam sistem tertutup massa zat sebelum dan setelah reaksi adalah tetap” dan tori atom dalton menyatakan “dalam reaksi kimia tidak ada atom yang hilang atau tercipta tetapi hanya terjadi penataan ulang”. Artinya jumlah dan jenis atom dalam reaksi kimia adalah tetap atau sama.
Agar jumlah dan jenis atom yang terdapat pada reaktan dan produk tetap maka pada persamaan reaksi masing-masing spesi yang terlibat dalam reaksi kimia diberi koefisien yang sesuai. Seperti pada contoh pembentukan H2O koefisien reaksi menyatakan jumlah atom, jumlah ion ataupun jumlah molekul, namun selain itu kofisien reaksi juga menyatakan mol zat yang terlibat dalam reaksi kimia. Misalnya contoh pembentukan air:
Koefisien yang dimiliki menyetakan 2 mol gas hidrogen bereaksi dengan 1 mol gas oksigen membentuk 2 mol air atau 2 molekul gas hidogen bereaksi dengan 1 molekul gas oksigen membentuk 2 molekul air.
Berikut adalah langkah-langkah menulis persamaan reaksi dan penyetaraannya
Misalnya logam aluminium bereaksi dengan gas O2 membentuk aluminium oksida. Tulislah persamaan reaksi dan penyetaraannya?
1) Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2) Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi yang rumus kimianya lebih kompleks).
Pada reaksi di atas spesi yang lebih kompleks adalah Al2O3 = 1
3) Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Koefisien Al2O3 = 1
Maka Al diruas kanan = 2
Al diruas kiri = 1
Agar jumlah atom Al pada kedua ruas sama maka Al pada ruas kiri diberi kofisien 2. Mka persamaan reaksinya menjadi:
Atom O
Koefisien Al2O3 = 1
Maka atom O diruas kanan = 3
Jumlah atom O diruas kiri = 2
Agar jumlah atom O pada kedua ruas sama maka atom O pada ruas kiri diberi koefisien 3/2. Persamaan reaksinya menjadi:
Agar koefisien tidak dalam bentuk pecahan koefisien pada kedua ruas dikalikan dengan satu bilangan sehingga memberikan suatu bilangan bulat. Agar diperoleh bilangan bulat maka kedua ruas dikali 2, sehingga diperoleh persamaan reaksi yang setara dengan koefisien dalam bentuk bilangan bulat:
4) Biasanya oksigen disetarakan paling terakhir jika masih terdapat unsur-unsur lain.
Contoh
Reaksi gas metana (CH4) dengan gas oksigen membentuk gas karbon dioksida dan uap air. Tulislah persamaan reaksi dan setarakan persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya disetarakan huruf sebagai kofisien sementara.
CH4 = 1, koefisien zat yang lain disetarakan dengan huruf, maka persamaan reaksinya menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Dari reaksi tersebut unsur yang beriktan langsung dengan zat telah diberi koefisien 1 adalah C dan H.
penyetaraan atom C
Atom C diruas kiri = 1
Atom C diruas kanan = b
Maka jumlah atom C diruas kanan = b = 1
Penyetaraan atom H
Jumlah atom H di ruas kiri = 4
Jumlah atom H di ruas kanan = 2c
Maka jumlah atom H di ruas kanan atau harga koefisien c = 2c = 4, c = 2
Dari penyetaraan ini maka persamaan reaksi menjadi
4. Setarakan atom O
Jumlah atom O di ruas kanan = 2 + 2 = 4
Jumlah atom O di ruas kiri = 2a
Maka jumlah atom O di ruas kiri atau harga koefisien a = 2a = 4, a = 2
Maka persamaan reaksinya menjadi:
Catatan: koefisien 1 biasanya tidak ditulis, penulisan du atas dan untuk penyetaraan reaksi selanjutnya hanya untuk memberikan gambaran mengenai tahap-tahap penyetaraan saja.
Contoh
Reaksi besi(III) oksida dengan larutan asam sulfat membentuk besi(III) sulfat dan air. Tulislah persamaan reaksi dan setarakan persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya disetarakan huruf sebagai kofisien sementara.
Koefisien Fe2(SO4)3 = 1 dan koefisien yang lain menggunakan huruf. Persamaan reaksi menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Dari reaksi tersebut unsur yang beriktan langsung dengan zat telah diberi koefisien 1 adalah Fe, S dan O. Namun O disetarakan terakhir karena unsur O terdapat di lebih dari dua zat.
Penyetaraan atom Fe
Jumlah atom Fe di ruas kiri = 2a
Jumlah atom Fe di ruas kanan = 2
Maka jumlah atom Fe diruas kiri atau harga koefisien a = 2a = 2, a = 1
Penyetaraan atom S
Jumlah atom S di ruas kiri = b
Jumlah atom S di ruas kanan = 3
Maka jumlah atom S di ruas kiri atau harga koefisien b = 3
Persamaan reaksinya menjadi:
4. Setarakan atom lainnya. Atom O disetarakan setelah semua atom setara.
Penyetaraan atom H
Jumlah atom H di ruas kiri = 6
Jumlah atom H di ruas kanan = 2c
Maka jumlah atom H di ruas kanan atau harga koefisien b = 2c = 6, c = 3
Persamaan reaksinya menjadi:
5. Setarakan atom O. Karena semua atom telah setara, maka oksigen seharusnya telah setara juga. Untuk meyakinkan jumlah atom O pada kedua ruas telah setara, maka dilakukan penjumlahan atom O pada kedua ruas.
Jumlah atom O di ruas kiri = 3 + 12 = 15
Jumlah atom O di ruas kanan = 12 + 3 = 15.
Dari penjumlahan ini, terbukti jumlah atom O pada ruas kiri dan ruas kanan telah setara. Jadi persamaan reaksi setaranya adalah sebagai beriktu:
Contoh
Reaksi antara tembaga dengan larutan asam nitrat encer menghasilkan tembaga(II) sulfat, gas nitrogen oksida dan air. Tulislah persamaan reaksi dan setarakan persamaan reaksi tersebut?
Jawab
1. Menulis rumus kimia atau lambang unsur dari reaktan dan produk dengan wujud masing-masing spesies.
2. Tetapkan koefisien salah satu spesi sama dengan 1 (biasanya spesi yang rumus kimianya lebih kompleks). Sedangkan koefisien yang lainnya disetarakan huruf sebagai kofisien sementara.
Koefisien Cu(NO3)2 = 1, dan koefisien yang lain menggunakan huruf. Persamaan reaksi menjadi:
3. Setarakan unsur yang terkait langsung dengan zat yang telah diberi koefisien 1.
Pada reaksi di atas, hanya Cu yang dapat langsung disetarakan yaitu a = 1. Untuk unsur yang lainnya walaupun terkait langsung dengan Cu(NO3)2 tetapi tidak dapat langsung disetarakan karena terdapat di lebih dari dua zat yang belum mempunyai harga korfisien. Maka untuk menyetarakannya ikuti persamaan-persamaan berikut:
· Menyetarakan atom N : b = 2 + c ……………………… (1)
· Menyetarakan atom H : b = 2d …………………………. (2)
· Menyetarakan atom O : 3b = 6 + c + d ……………… (3)
Dari persamaan-persamaan di atas nyatakan nilai c dan d dalam b, sebagai berikut:
· Dari persamaan (1), b = 2 + c berarti c = b – 2
· Dari persamaan (2), b = 2d berarti d = 0,5 b
Substitusikan nilai c cdan d ke dalam persamaan (3)
3b = 6 + c + d
3b = 6 + b – 2 + 0,5 b
1,5b = 4
b =
nilai b yang telah diperoleh di substitusikan ke persamaan (1) dan (2) untuk memperoleh nilai c dan d. Maka nilai c dan d berturut-turut adalah
Maka persamaan reaksinya menjadi:
karena masih dalam bentuk pecahan maka dikalikan 3 sehingga diperoleh koefisien dalam bentuk bilangan bulat.
Sifat persamaan reaksi
a. Jenis unsur-unsur sebelum dan sesudah reaksi selalu sama
b. Jumlah masing-masing atom sebelum dan sesudah reaksi selalu sama
c. Perbandingan koefisien reaksi menyatakan perbandingan mol. Khusus untuk yang berwujud gas perbandingan koefisien menyatakan perbandingan volume pada suhu den tekanannya sama.
Stoikiometri Reaksi
Hubungan mol dengan koefisien reaksi
Seperti yang telah dijelaskan pada bagian-sebelumnya, koefisien zat dalam suatu persamaan reaksi menyatakan jumlah mol zat itu. Oleh sebab itu jumlah mol zat atau massa zat yang terlibat dalam suatu reaksi dapat ditentukan. Aspek kuantitatif zat-zat yang terlibat dalam dalam reaksi inilah yang disebut stoikiometri reaksi. Stoikiometri reaksi ini sangat diperlukan terutama dalam merencanaakan banyaknya zat yamg akan dihasilkan dari suatu reaksi kimia dalam industri maupun dalam laboratorium.
Dengan mengeahui koefisien persamaan reaksi maka jumlah mol suatu zat dalam persamaan reaksi telah diketahui. Mol zat yang telah diketahui dapat digunakan untuk menentukan massa zat yang diperlukan dalam suatu reaksi. Karena hal tersebut koefisien reaksi disebut sebagai dasar stoikiometri reaksi.
Contoh
Logam aluminium yang dilarutkan ke dalam asam sulfat menghasilkan aluminium sulfat dan gas hidrogen, sesuai reaksi berikut:
Berapa mol mol gas hidrogen yang dihasilkan jika digunakan 0,5 mol aluminium yang dilarutkan dalam asam sulfat?
Jawab


artinya dengan melarutkan 0,5 mol aluminium menghasilkan 0,75 mol gas hidrogen.
Dari mol gas hidrogen yang telah diketahui dapat ditentukan massa hidrogen yang dihasilkan. Massa hidrogen dapat ditentukan dengan cara mengalikan mol hidrogen yang diperoleh dengan Mr.H2.
Contoh
Perhatikan reaksi berikut:
Berapa volume gas hidrogen (STP) yang terbentuk jika digunakan 5,4 gram Al? (Ar Al = 27)
Jawab
a) Setarakan reaksi kimia yang terjadi jika persamaan reaksi belum setara. Pada persamaan reaksi di atas telah setara sehingga tidak perlu disetarakan.
b) Menyatakan jumlah mol zat yang diketahui, yakni aluminium.
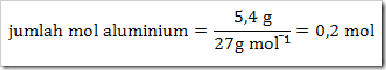
c) Menentukan jumlah mol zat yang ditanyakan yakni gas H2.


d) Menentukan volume gas H2 yang dihasilkan
V = n x Vm
= 0,3 mol x 22,4 L mol‾1 = 6,72 L.
Hipotesis Avogadro dan Hubungan Volume dengan Koefisien Reaksi
Pada tahun 1811, Ameo Avogadro mengemukakan sebuah hipotesis yang mengatakan: “pada tekanan (P) dan suhu (T) yang sama, gas-gas yang memiliki volume sama mengandung jumlah molekul (jumlah mol) yang sama pula”.
Artinya pada P dan T sama, perbandingan volume gas-gas yang terlibat dalam suatu reaksi sama dengan perbandingan jumlah mol zat yang terlibat dalam reaksi tersebut. Karena pada persamaan reaksi, koefisien menyatakan jumlah mol zat, maka volume gas yang terlibat dalam suatu reaksi sama dengan koefisien zat itu.
Hubungan antara koefisien suatu zat dengan volume dapat dirumuskan sebagai berikut:
 |
Pada suhu dan tekanan tertentu 0,5 mol gas oksigen volumenya adalah 2 liter. Hitunglah volume dari 1,5 mol gas hidrogen pada suhu dan tekanan yang sama dengan gas oksigen tersebut
Jawab
Contoh
Tentukan berapa volume gas belerang trioksida (SO3) yang dihasilkan dan berapa volume gas O2 yang dibutukan, jika direaksikan 1 liter gas belerang dioksida (SO2) dengan gas oksigen?
Jawab
Persamaan reaksi
SO2(g) + O2(g)
SO2 yang bereaksi = 1 liter

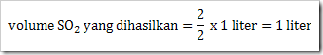
larutan elektrolit dan nonelektrolit1
Posted by pada 30 Oktober 2010
sebaiknya baca yang telah di update disni…!!!!!
Seperti yang telah disinggung pada bab sebelumnya bahwa senyawa dapat digolongkan menjadi senyawa ionik dan senyawa kovalen. Senyawa yang terbentuk dengan akibat adanya pemakain bersama elektron dinamakan senyawa kovalen sedangkan senyawa yang terbentuk karena tarikan antara dua ion yang berbeda muatan disebut senyawa ionik.
Cara lain untuk mengelompokan senyawa yaitu berdasarkan daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit. Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CONH2)2 merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
Cara pengujian suatu senyawa termasuk elektrolit atau nonelektrolit dapat dilakukan dengan meghubungkan baterai dan lampu bohlam atau amperemeter yang dapat digunakan untuk mengatakan besarnya arus listrik yang melewati rangkaian. Kemudian ujung kabel dihubungkan pada dua buah elektroda.
Setelah semua terhubung pengujian dapat dilakukan dengan mencelupkan kedua elektroda ke dalam larutan yang akan diuji. Ketika dicelupkan diperhatikan agar kedua elektrode tidak bersentuhan. Ketika elektroda dicelupkan jika lampu bohlam menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa elektrolit. Begitu pula sebaliknya apabila ketika elektroda dicelupkan lampu bohlam tidak menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa nonelektrolit.
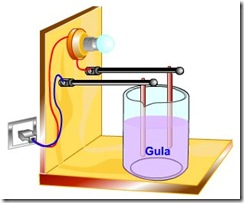
Mengapa Larutan Menghantarkan Arus Listrik
Larutan elektrolit dapat menghantarkan sedangkan larutan nonelektrolit tidak menghantarkanarus listrik, telah dijelaskan oleh seorang ahli kimia swedia Svante August Arrhenius (1859-1927). Menurut Arhenius larutan elektrolit dapat menghantarkan arus listrik karena di dalam larutan tersebut terkandung atom-atom atau kumpulan atom yang bermuatan listrik (ion) yang bergerak bebas.
Misalnya reaksi yang tejadi pada elektrolisis larutan tembaga klorida (CuCl). Ketika tembaga klorida dilarutkan dalam air tembaga klorida akan terurai menjadi ion Cu2+ dan ion 2Cl‾ yang terpisah satu sama lain dan bercampur dengan air. Ketika elektroda dicelupkan ion Cu2+ akan bergerak ke elektroda yang dihubungkan dengan kutub negatif dari baterai sedangkan Cl‾ akan bergerak ke elektroda yang dihubungkan dengan kutub positif dari baterai. Elektroda yang dihubungkan dengan kutub negatif baterai disebut katoda, oleh sebab itu katoda bermuatan negatif. Sedangkan elektroda yang bermuatan positif dan dihubungkan dengan kutub positif disebut anoda.
Dari proses elektrolisis ini pada anoda akan keluar gas klor yang berwarna kuning kehijauan sedangkan pada katoda ion Cu2+ akan direduksi menjadi Cu padat yang akan berkumpul menutupi elektroda dari katoda. Setengah reaksi yang terjadi pada katoda dan anoda adalah

Sumber Ion
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu ion yaga berasal dari senyawa ionik dan ion yang berasal dari senyawa kovalen polar. Semua senyawa ionik yang larut dalam air adalah elektrolit sedangkan senyawa lain yang larut dalam air ada yang elektrolit ada pula yang nonelektrolit.
Senyawa Ion
Senyawa ionik tersusun atas ion-ion baik dalam bentuk padat dan kering sekalipun. Senyawa-senyawa ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena tidak ada pergerakan dari ion-ion tersebut. Namun apabila senyawa ionik dilarutkan dalam suatu pelarut polar misalnya air maka senyawa ionik adalah suatu elektrolit. Perlu diketahui bahwa semua senyawa ionik yang dilarutkan dalam air dan lelehan senyawa ionik dari padatannya merupakan suatu elektrolit. Hal ini disebaabkan ion-ion yang ada bebas bergerak ke segala arah. Untuk senyawa ionik yang dilelehkan dari padatannya memiliki daya hantar listrik yang lebih baik dibanding larutannya.
Air merupakan suatu pelarut yang baik untuk senyawa-senyawa ionik namun tidak memainkan peran yang istimewa dalam menghantarkan arus listrik. Air hanya dijadikan medium oleh ion-ion untuk bergerak.
Senyawa kovalen polar
Senyawa-senyawa kovalen baik kovalen polar maupun nonpolar dalam keadaan normal tidak dapat menghantarkan arus listrik. Tetapi berdasarkan penelitian larutan dari senyawa kovalen polar dapat menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai. Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu membentuk ion-ion yang bergerak bebas. Misalnya senyawa kovalen polar mampu membentuk ion di dalam air tetapi tidak mamp membentuk ion di dalam benzena. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Perubahan suatu senyawa menjadi ion-ion disebut proses ionisasi. Proses ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion, umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan dalam air dapat ditulis dalam dua persamaan:
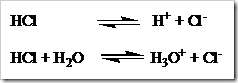
Reaksi ionisasi dari CH3COOH dan NH3 dalam air dapat dilihat pada persamaan di bawah:

Penggolongan Elektrolit
Larutan elektrolit dapat digolongkan menjadi dua jenis yaitu
1. Elektrolit kuat
2. Elektrolit lemah
Dari tiga senyawa di atas HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M. maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat pada lampu bohlam yang menyala lebih terang.
Dari hal ini dapat disimpulkan bahwa jumlah ion yang terbentuk dari HCl lebih banyak jika dibandingkan dengan dua senyawa tersebut. Artinya di dalam air sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H3O+ dan ion CH3COO‾ dan NH4+ dan OH‾, sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Untuk senyawa-senyawa ionik yang dilarutkan didalam air ternyata memiliki daya hantar listrik yang baik. Hal ini disebabkan senyawa ionik tersusun atas ion-ion dan ketika dilarutkan dalam air ion-ion tersebut akan langsung menyebar secara merata di dalam air.
Zat-zat yang seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat. Natrium klorida, asam sulfat, asam klorida, dan NaOH merupakan beberapa contoh elektrolit kuat. Senyawa yang termasuk elektrolit kuat mempunyai daya hantar listrik yang relatif baik walaupun memiliki konsentrasi yang kecil.
Sebaliknya beberapa senyawa kovalen polar yang larut dalam air merupakan penghantar listrik yang jelek. Di dalam air zat-zat yang hanya sebagian kecil molekulnya terurai menjadi ion disebut elektrolit lemah. Lartuan asam asetat dan amonia dalam air merupakan contoh elektrolit lemah. Pada elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat).
Dari percobaan daya hantar listrik, elektrolit kuat akan memberikan nyala bohlam yang terang sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau perubahan, maka dapat dikatakan larutan tersebut termasuk larutan nonelektrolit.
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah. Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit kuat, sedangkan garam-garam yang sukar larut dalam air berupa elektrolit lemah walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah
1) Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3.
2) Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2.
3) Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah
1) Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S
2) Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2
3) Garam-garam yang sukar larut, misalnya: AgCl, CaCrO4 dan PbI2
Kegiatan Laboratorium
Lakukan kegiatan berikut untuk menguji daya hantar listrik beberapa zat.
Alat dan Bahan
1) Amati dengan seksama, apa yang terjadi pada lampu dan batang elektroda
2) Diantara bahan yang diuji, manakah yang dapat menghantarkan arus listrik dan manakah yang tidak dapat menghantarkan listrik.
3) Jika ada yang menghantarkan arus listrik manakah yang termasuk elektrolit kuat dan manakah yang termasuk elektrolit lemah.
4) Diantara larutan elektrolit di atas, manakah zat terlarutnya yang memiliki ikatan ion dan ikatan kovalen.
Derajat Ionisasi
Ketika suatu zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni zat tersebut larut secara sempurna, larut sebagian dan tidak larut dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat ionisasi (α). Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terurai atau terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai

Harga α di antara 0 ≤ α ≥ 1. α = 0 artinya tidak terjadi ionisasi. Sedangkan α = 1 artinya terjadi ionisasi secara sempurna.
Contoh soal 1
Bila diketahui suatu reaksi sebagai berikut
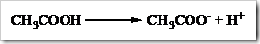
Dari reaksi di atas tentukan derajat ionisasinya, apabila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H+ sebanyak 0,5 mol.
Jawab
Dari reaksi yang ada maka CH3COOH yang terurai adalah
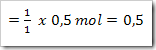
Maka derajat ionisasinya adalah

Contoh soal 2
Suatu basa dengan rumus L(OH)2 bila dilarutkan dalam air teionisasi sesuai reaksi berikut:

Jika mula-mula L(OH)2 sebanyak 2 mol dengan derajat ionisasi sebesar 0,3. Tentukanlah
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Jawab
Reaksi ionisasi : L(OH)2 ––→ L2+ + 2OH‾

a. Jumlah mol L(OH)2 yang terionisasi
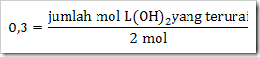

b. Jumlah mol ion L2+ yang terbentuk
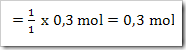
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi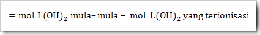
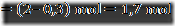
Seperti yang telah disinggung pada bab sebelumnya bahwa senyawa dapat digolongkan menjadi senyawa ionik dan senyawa kovalen. Senyawa yang terbentuk dengan akibat adanya pemakain bersama elektron dinamakan senyawa kovalen sedangkan senyawa yang terbentuk karena tarikan antara dua ion yang berbeda muatan disebut senyawa ionik.
Cara lain untuk mengelompokan senyawa yaitu berdasarkan daya hantar listrik. Jika suatu senyawa dilarutkan dalam air dapat menghantarkan arus listrik disebut larutan elektrolit, dan sebaliknya jika larutan tersebut tidak dapat menghantarkan arus listrik disebut larutan nonelektrolit. Glukosa (C6H12O6), etanol (C2H5OH), gula tebu (C12H22O11), larutan urea (CONH2)2 merupakan beberapa contoh senyawa yang dalam bentuk padatan, lelehan maupun larutan tidak dapat menghantarkan arus listrik.
Cara pengujian suatu senyawa termasuk elektrolit atau nonelektrolit dapat dilakukan dengan meghubungkan baterai dan lampu bohlam atau amperemeter yang dapat digunakan untuk mengatakan besarnya arus listrik yang melewati rangkaian. Kemudian ujung kabel dihubungkan pada dua buah elektroda.
Setelah semua terhubung pengujian dapat dilakukan dengan mencelupkan kedua elektroda ke dalam larutan yang akan diuji. Ketika dicelupkan diperhatikan agar kedua elektrode tidak bersentuhan. Ketika elektroda dicelupkan jika lampu bohlam menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa elektrolit. Begitu pula sebaliknya apabila ketika elektroda dicelupkan lampu bohlam tidak menyala maka dapat dikatakan senyawa tersebut termasuk golongan senyawa nonelektrolit.

Gambar rangkaian pengujian larutan elektrolit dan non elektrolit
Mengapa Larutan Menghantarkan Arus Listrik
Larutan elektrolit dapat menghantarkan sedangkan larutan nonelektrolit tidak menghantarkanarus listrik, telah dijelaskan oleh seorang ahli kimia swedia Svante August Arrhenius (1859-1927). Menurut Arhenius larutan elektrolit dapat menghantarkan arus listrik karena di dalam larutan tersebut terkandung atom-atom atau kumpulan atom yang bermuatan listrik (ion) yang bergerak bebas.
Misalnya reaksi yang tejadi pada elektrolisis larutan tembaga klorida (CuCl). Ketika tembaga klorida dilarutkan dalam air tembaga klorida akan terurai menjadi ion Cu2+ dan ion 2Cl‾ yang terpisah satu sama lain dan bercampur dengan air. Ketika elektroda dicelupkan ion Cu2+ akan bergerak ke elektroda yang dihubungkan dengan kutub negatif dari baterai sedangkan Cl‾ akan bergerak ke elektroda yang dihubungkan dengan kutub positif dari baterai. Elektroda yang dihubungkan dengan kutub negatif baterai disebut katoda, oleh sebab itu katoda bermuatan negatif. Sedangkan elektroda yang bermuatan positif dan dihubungkan dengan kutub positif disebut anoda.
Dari proses elektrolisis ini pada anoda akan keluar gas klor yang berwarna kuning kehijauan sedangkan pada katoda ion Cu2+ akan direduksi menjadi Cu padat yang akan berkumpul menutupi elektroda dari katoda. Setengah reaksi yang terjadi pada katoda dan anoda adalah

Sumber Ion
Ion-ion yang timbul dalam larutan elektrolit terdiri dari dua sumber yaitu ion yaga berasal dari senyawa ionik dan ion yang berasal dari senyawa kovalen polar. Semua senyawa ionik yang larut dalam air adalah elektrolit sedangkan senyawa lain yang larut dalam air ada yang elektrolit ada pula yang nonelektrolit.
Senyawa Ion
Senyawa ionik tersusun atas ion-ion baik dalam bentuk padat dan kering sekalipun. Senyawa-senyawa ionik dalam keadaan padat tidak dapat menghantarkan arus listrik karena tidak ada pergerakan dari ion-ion tersebut. Namun apabila senyawa ionik dilarutkan dalam suatu pelarut polar misalnya air maka senyawa ionik adalah suatu elektrolit. Perlu diketahui bahwa semua senyawa ionik yang dilarutkan dalam air dan lelehan senyawa ionik dari padatannya merupakan suatu elektrolit. Hal ini disebaabkan ion-ion yang ada bebas bergerak ke segala arah. Untuk senyawa ionik yang dilelehkan dari padatannya memiliki daya hantar listrik yang lebih baik dibanding larutannya.
Air merupakan suatu pelarut yang baik untuk senyawa-senyawa ionik namun tidak memainkan peran yang istimewa dalam menghantarkan arus listrik. Air hanya dijadikan medium oleh ion-ion untuk bergerak.
Senyawa kovalen polar
Senyawa-senyawa kovalen baik kovalen polar maupun nonpolar dalam keadaan normal tidak dapat menghantarkan arus listrik. Tetapi berdasarkan penelitian larutan dari senyawa kovalen polar dapat menghantarkan arus listrik jika dilarutkan dalam pelarut yang sesuai. Hal ini disebabkan senyawa kovalen polar dalam pelarut yang sesuai mampu membentuk ion-ion yang bergerak bebas. Misalnya senyawa kovalen polar mampu membentuk ion di dalam air tetapi tidak mamp membentuk ion di dalam benzena. HCl, NH3 dan CH3COOH merupakan beberapa contoh senyawa kovalen polar.
Perubahan suatu senyawa menjadi ion-ion disebut proses ionisasi. Proses ionisasi merupakan salah satu cara menunjukan pembentukan ion-ion, umumnya ditulis tanpa melibatkan molekul air atau pelarut, namun terkadang molekul air dituliskan juga. Misalnya HCl yang dilarutkan dalam air dapat ditulis dalam dua persamaan:
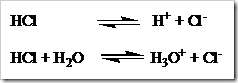
Reaksi ionisasi dari CH3COOH dan NH3 dalam air dapat dilihat pada persamaan di bawah:

Penggolongan Elektrolit
Larutan elektrolit dapat digolongkan menjadi dua jenis yaitu
1. Elektrolit kuat
2. Elektrolit lemah
Dari tiga senyawa di atas HCl, CH3COOH dan NH3, apabila diuji daya hantar listrik menggunakan konsentrasi larutan yang sama misalnya 1 M. maka dapat diketahui ternyata HCl memiliki daya hantar listrik yang lebih baik dibanding dua senyawa lainnya. Hal ini dapat dilihat pada lampu bohlam yang menyala lebih terang.
Dari hal ini dapat disimpulkan bahwa jumlah ion yang terbentuk dari HCl lebih banyak jika dibandingkan dengan dua senyawa tersebut. Artinya di dalam air sebagian besar HCl terurai menjadi ion H+ dan ion Cl‾ sedangkan CH3COOH dan NH3 hanya sebagian kecil yang terurai ion H3O+ dan ion CH3COO‾ dan NH4+ dan OH‾, sebagian besarnya masih tetap dalam bentuk molekul kovalen.
Untuk senyawa-senyawa ionik yang dilarutkan didalam air ternyata memiliki daya hantar listrik yang baik. Hal ini disebabkan senyawa ionik tersusun atas ion-ion dan ketika dilarutkan dalam air ion-ion tersebut akan langsung menyebar secara merata di dalam air.
Zat-zat yang seluruhnya atau hampir seluruhnya di dalam air terurai menjadi ion-ion sehingga memiliki daya hantar listrik yang baik disebut elektrolit kuat. Natrium klorida, asam sulfat, asam klorida, dan NaOH merupakan beberapa contoh elektrolit kuat. Senyawa yang termasuk elektrolit kuat mempunyai daya hantar listrik yang relatif baik walaupun memiliki konsentrasi yang kecil.
Sebaliknya beberapa senyawa kovalen polar yang larut dalam air merupakan penghantar listrik yang jelek. Di dalam air zat-zat yang hanya sebagian kecil molekulnya terurai menjadi ion disebut elektrolit lemah. Lartuan asam asetat dan amonia dalam air merupakan contoh elektrolit lemah. Pada elektrolit lemah mempunyai daya hantar yang relatif jelek walaupun memiliki konsentrasi tinggi (pekat).
Dari percobaan daya hantar listrik, elektrolit kuat akan memberikan nyala bohlam yang terang sedangkan elektrolit lemah nyala bohlamnya redup atau hanya menimbulkan gelembung-gelumbung udara pada elektroda. Jika tidak ada reaksi atau perubahan, maka dapat dikatakan larutan tersebut termasuk larutan nonelektrolit.
Larutan elektrolit dapat berupa asam, basa dan garam. Untuk asam dan basa dapat berupa elektrolit kuat dan elektrolit lemah. Sedangkan garam yang mudah larut dalam air semuanya termasuk elektrolit kuat, sedangkan garam-garam yang sukar larut dalam air berupa elektrolit lemah walaupun tersusun atas ion-ion.
Beberapa senyawa yang tergolong elektrolit kuat adalah
1) Asam-asam kuat umumnya asam-asam anorganik, misalnya: HCl, HClO3, H2SO4 dan HNO3.
2) Basa-basa kuat yaitu basa-basa golongan alkali dan alkali tanah, misalnya: NaOH, KOH, Ca(OH)2 dan Ba(OH)2.
3) Garam-garam yang mudah larut, misalnya: NaCl, KI dan Al2(SO4)3
Beberapa senyawa yang tergolong elektrolit lemah
1) Asam-asam lemah, sebagian asam anorganik dan sebagian besar asam organik misalnya: CH3COOH, HCN, H2CO3 dan H2S
2) Basa-basa lemah, misalnya amonia dan kebanyakan basa organik seperti NH4OH dan Ni(OH)2
3) Garam-garam yang sukar larut, misalnya: AgCl, CaCrO4 dan PbI2
Kegiatan Laboratorium
Lakukan kegiatan berikut untuk menguji daya hantar listrik beberapa zat.
Alat dan Bahan
- Gelas kimia 100 ml
- Baterai
- Air suling 50 mL
- Larutan HCl 1M 50 mL
- Larutan asam cuka (CH3COOH) 1M 50 mL
- Larutan NaOH 1M 50 mL
- Larutan ammonia (NH3) 1 M 50 mL
- Larutan gula 50 mL
- Larutan NaCl 1M 50 mL
- Etanol 70% 50 mL
- Air leding dan air sumur 50 mL
1) Amati dengan seksama, apa yang terjadi pada lampu dan batang elektroda
2) Diantara bahan yang diuji, manakah yang dapat menghantarkan arus listrik dan manakah yang tidak dapat menghantarkan listrik.
3) Jika ada yang menghantarkan arus listrik manakah yang termasuk elektrolit kuat dan manakah yang termasuk elektrolit lemah.
4) Diantara larutan elektrolit di atas, manakah zat terlarutnya yang memiliki ikatan ion dan ikatan kovalen.
Derajat Ionisasi
Ketika suatu zat dilarutkan dalam air, maka terdapat 3 kemungkinan yang terjadi yakni zat tersebut larut secara sempurna, larut sebagian dan tidak larut dalam air. Banyaknya spesi yang terionisasi dalam air dapat diketahui menggunakan derajat ionisasi (α). Derajat ionisasi diartikan sebagai perbandingan jumlah mol atau molekul zat yang terurai atau terionisasi dengan banyaknya mol atau molekul zat mula-mula. Derajat ionisasi dapat ditulis sebagai

Harga α di antara 0 ≤ α ≥ 1. α = 0 artinya tidak terjadi ionisasi. Sedangkan α = 1 artinya terjadi ionisasi secara sempurna.
Contoh soal 1
Bila diketahui suatu reaksi sebagai berikut
Dari reaksi di atas tentukan derajat ionisasinya, apabila mula-mula 2 mol asam asetat dilarutkan dalam air dan menghasilkan ion H+ sebanyak 0,5 mol.
Jawab
Dari reaksi yang ada maka CH3COOH yang terurai adalah
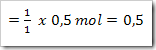
Maka derajat ionisasinya adalah
Contoh soal 2
Suatu basa dengan rumus L(OH)2 bila dilarutkan dalam air teionisasi sesuai reaksi berikut:
Jika mula-mula L(OH)2 sebanyak 2 mol dengan derajat ionisasi sebesar 0,3. Tentukanlah
a. Jumlah mol L(OH)2 yang terionisasi
b. Jumlah mol ion L2+ yang terbentuk
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi
Jawab
Reaksi ionisasi : L(OH)2 ––→ L2+ + 2OH‾
a. Jumlah mol L(OH)2 yang terionisasi
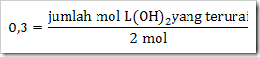
b. Jumlah mol ion L2+ yang terbentuk
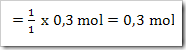
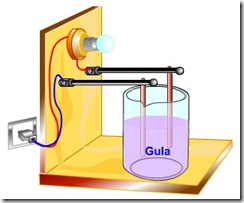
c. Jumlah mol L(OH)2 yang tersisa setelah terionisasi





![clip_image002[4] clip_image002[4]](http://wanibesak.files.wordpress.com/2010/12/clip_image0024_thumb.gif?w=184&h=79)












No comments:
Post a Comment