Dahsyatnya Energi Nuklir
Posted by pada 20 September 2011
Istilah “nuklir” merupakan
kata yang sangat menakutkan bagi beberapa orang. Hal ini tidak
mengherankan karena istilah tersebut dikenalkan kepada dunia melalui
hancurnya dua kota di Jepang, Hiroshima dan Nagasaki. Hancurnya dua kota
tersebut mengakhiri pergolakan perang dunia II dimana Jepang menyerah
tanpa syarat kepada sekutu.
Bom yang dijatuhkan di Jepang, merupakan prinsip dari reaksi fisi yakni reaksi pembelahan isotop unsur-unsur berat menjadi menjadi dua inti yang bermasa sedang. Reaksi fisi dapat berlangsung secara spontan dan berlangsung secara induksi (menembak inti menggunakan suatu partikel) biasanya menggunakan neutron. Walaupun demikian tidak semua isotop unsur-unsur berat mengalami reaksi fisi. Reaksi fisi membebaskan energi yang besar baik dalam bentuk radiasi maupun energi kinetik hasil-hasil fisi.
Reaksi fisi yang terjadi pada bom nuklir tidak dapat dikendalikan, sehingga sekali meledak energi yang dihasilkan akan menghancurkan semua yang ada hingga mencapai keadaan yang stabil. Sedangkan reaksi fisi dalam reaktor nuklir dapat dikendalikan dengan cara menyerap kelebihan neutron sehingga reaksi fisi berantai dapat dihentikan.
Energi yang dihasilkan dari reaksi inti atau reaksi nuklir atau pembelahan inti membentuk unsur-unsur lain yang lebih stabil disebut energi nuklir. Energi yang dihasilkan pada suatu reaksi inti dihitung peratom, artinya satu atom saja sudah dapat menghasilkan energi.
Misalkan menghitung jumlah energi yang dihasilkan dari pembakaran 1 gram uranium-235.
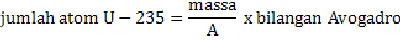
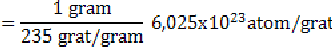
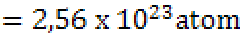
Berdasarkan eksperimen yang diperoleh, setiap pembakaran 1 atom uranium-235 diperoleh energi sebesar 200 MeV. Jadi energi yang dihasilkan dari pembakaran 1 gram U-235 adalah sebagai berikut.
E = 2,56 x 23 x 200 atom x 200 MeV/atom
= 5,12 x 23 MeV
Karena 1 MeV = 3,83 x 10-14 kalori (cal), maka
E = 5,12 x1023 x 3,83 x 10-14 cal
= 1,96 x 1010 cal
Jika energi tersebut dibandingkan dengan pembakaran 50 serbuk granat TNT (trinitrotoluena) perhitungannya sebagai berikut.
Energi yang dihasilkan 50 gram TNT = 50000 cal = 5 x 104 cal
Maka pembakaran 1 gram uranium sama dengan pembakaran TNT sebanyak
= 50 (2 x 1010)/ 5 x 104 gram
= 20.000.000 gram TNT
= 20 ton TNT
Jadi energi yang dihasilkan 1 gram uranium-235 sama dengan energi yang dilepaskan ledakan 20 ton TNT.
Oleh sebab itu, energi yang sangat besar dari pembakaran reaksi inti dapat dimanfaatkan demi kesejahteraan umat manusia.
Sayangnya sampai saat ini Indonesia belum menggunakan energi yang sangat besar ini demi kesejahteraan rakyat, walaupun telah memiliki beberapa reaktor nuklir. Hal ini mungkin disebabkan kita takut akan efek negatif yang ditimbulkan energi nuklir.
Perlu diketahui bahwa selama energi nuklir ditangani dengan benar, hal-hal negatif yang ditakutkan selama ini tidak akan pernah terjadi. Banyak negara yang perekonomiannya jauh lebih maju dibanding Indonesia karena telah menggunakan energi nuklir. Karena hal inilah pemilik blog ini ingin menyatakan
Bom yang dijatuhkan di Jepang, merupakan prinsip dari reaksi fisi yakni reaksi pembelahan isotop unsur-unsur berat menjadi menjadi dua inti yang bermasa sedang. Reaksi fisi dapat berlangsung secara spontan dan berlangsung secara induksi (menembak inti menggunakan suatu partikel) biasanya menggunakan neutron. Walaupun demikian tidak semua isotop unsur-unsur berat mengalami reaksi fisi. Reaksi fisi membebaskan energi yang besar baik dalam bentuk radiasi maupun energi kinetik hasil-hasil fisi.
Reaksi fisi yang terjadi pada bom nuklir tidak dapat dikendalikan, sehingga sekali meledak energi yang dihasilkan akan menghancurkan semua yang ada hingga mencapai keadaan yang stabil. Sedangkan reaksi fisi dalam reaktor nuklir dapat dikendalikan dengan cara menyerap kelebihan neutron sehingga reaksi fisi berantai dapat dihentikan.
Energi yang dihasilkan dari reaksi inti atau reaksi nuklir atau pembelahan inti membentuk unsur-unsur lain yang lebih stabil disebut energi nuklir. Energi yang dihasilkan pada suatu reaksi inti dihitung peratom, artinya satu atom saja sudah dapat menghasilkan energi.
Misalkan menghitung jumlah energi yang dihasilkan dari pembakaran 1 gram uranium-235.
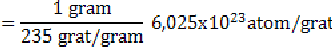
Berdasarkan eksperimen yang diperoleh, setiap pembakaran 1 atom uranium-235 diperoleh energi sebesar 200 MeV. Jadi energi yang dihasilkan dari pembakaran 1 gram U-235 adalah sebagai berikut.
E = 2,56 x 23 x 200 atom x 200 MeV/atom
= 5,12 x 23 MeV
Karena 1 MeV = 3,83 x 10-14 kalori (cal), maka
E = 5,12 x1023 x 3,83 x 10-14 cal
= 1,96 x 1010 cal
Jika energi tersebut dibandingkan dengan pembakaran 50 serbuk granat TNT (trinitrotoluena) perhitungannya sebagai berikut.
Energi yang dihasilkan 50 gram TNT = 50000 cal = 5 x 104 cal
Maka pembakaran 1 gram uranium sama dengan pembakaran TNT sebanyak
= 50 (2 x 1010)/ 5 x 104 gram
= 20.000.000 gram TNT
= 20 ton TNT
Jadi energi yang dihasilkan 1 gram uranium-235 sama dengan energi yang dilepaskan ledakan 20 ton TNT.
Oleh sebab itu, energi yang sangat besar dari pembakaran reaksi inti dapat dimanfaatkan demi kesejahteraan umat manusia.
Sayangnya sampai saat ini Indonesia belum menggunakan energi yang sangat besar ini demi kesejahteraan rakyat, walaupun telah memiliki beberapa reaktor nuklir. Hal ini mungkin disebabkan kita takut akan efek negatif yang ditimbulkan energi nuklir.
Perlu diketahui bahwa selama energi nuklir ditangani dengan benar, hal-hal negatif yang ditakutkan selama ini tidak akan pernah terjadi. Banyak negara yang perekonomiannya jauh lebih maju dibanding Indonesia karena telah menggunakan energi nuklir. Karena hal inilah pemilik blog ini ingin menyatakan
“INDONESIAKU
BERHENTILAH MELIHAT DAN MENDENGAR SESUATU HANYA DARI SISI NEGATIF SAJA,
TETAPI TEROBOSI DAN LEWATI SISI NEGATIF TERSEBUT UNTUK MENEMUKAN SISI
POSITIF YANG SELAMA INI BELUM TERSENTUH WALAUPUN KITA TELAH MENYADARI
DIA SEDANG MENATIKAN KITA”
Efek Fotolistrik
Posted by pada 20 Juli 2011
- Salah satu fakta yang mendukung teori Max Planck yaitu efek fotolistrik (Teori max Planck baca : Pengertian Dasar Spektrofotometer Vis, UV, UV-Vis). Einstein pada tahun 1905 menggunakan teori Planck untuk menjelaskan efek fotolistrik. Efek fotolistrik
yaitu terpental atau terlepasnya elektron dari permukaan suatu logam
oleh radiasi elektromatik atau foton. Elektron yang terlepas dari
permukaan logam disebut fotoelektron. Secara eksperimen efek fotolistrik dapat dilakukan menggunakan alat seperti yang tertera pada Gambar.
-
Untuk mementalkan
elektron dari permukaan logam hanya diperlukan cahaya dengan frekuensi
tertentu yang disebut frekuensi atau energi ambang logam. Setiap logam
memiliki energi ambang yang berbeda-beda dan merupakan karekteristik
logam tersebut.
-
Kuat arus bertambah besar seiring meningkatnya frekuensi cahaya walaupun memiliki intensitas yang sama.
Misalnya suatu logam
memiliki energi atau frekuensi ambang pada cahaya hijau, maka ketika
cahaya hijau mengenai permukaan logam, elektron akan terpental atau akan
ada arus listrik. Namun jika digunakan digunakan cahaya merah atau
kuning yang frekuensinya lebih kecil daripada cahaya hijau, maka tidak
ada elektron yang terpental atau tidak ada arus listrik walaupun
intensitas cahaya yang digunakan lebih besar daripada cahaya hijau.

Peralatan pada Gambar terdiri dari sebuah tabung hampa dan pada masing-masing ujung tabung diletakan lempengan tipis logam. Pada kedua lempengan logam dihubungkan dengan dengan multimeter atau avometer untuk mengukur kuat arus yang ditimbulkan. Awalnya tidak ada arus yang ditimbulkan.
Namun ketika cahaya dengan frekuensi tertentu diberikan pada salah satu lempengan logam maka akan timbul arus listrik yang dapat diamati pada multimeter. Arus listrik yang timbul disebabkan, ketika logam dikenai cahaya dengan frekuensi tertentu, elektron pada permukaan atom logam dapat terpental atau terlepas kemudian bergerak menuju lempengan logam yang lain.
Elektron pada permukaan logam dapat terpental karena cahaya atau foton memiliki energi tertentu, yang dapat dihitung dengan persamaan E = hv. Energi minimum yang dibutuhkan untuk mementalkan elektron dari permukaan suatu logam disebut energi atau frekuensi ambang (v0).
Jika energi yang dimiliki foton berada di bawah energi ambang, maka tidak ada elektron yang terpental. Hal ini disebabkan, energi foton tidak mampu mengalahkan gaya tarik inti terhadap elektron yang akan dilepaskan.
Untuk mementalkan elektron dari permukaan logam tidak tergantung pada intensitas atau terangnya cahaya tetapi tergantung pada frekuensi cahaya. Walaupun cahaya yang mengenai permukaan logam memiliki intensitas lemah (redup), namun memiliki energi di atas energi ambang maka elektron dipermukaan logam dapat terpental dengan kecepatan tertentu.
Jika energi yang dimiliki foton berada di atas energi ambang maka elektron akan terpental dan energi yang tersisa diubah menjadi energi kinetik untuk elektron yang terpental. Berdasarkan eksperimen diperoleh sejumlah fakta yang merupakan karakteristik dari efek fotolistrik sebagai berikut.
Jika digunakan cahaya cahaya biru yang frekuensinya lebih besar daripada cahaya hijau maka elektron akan terpental atau ada arus listrik dan energi yang tersisa diubah menjadi energi kenetik elektron yang terpental. Arus listrik listrik yang ditimbulkan akan bertambah besar jika intensitas cahaya biru ditingkatkan.
Baca Juga :
1. teori atom
2. sistem periodik unsur
3. KESTABILAN SENYAWA IONIK APAKAH KARENA TERPENUHINYA ATURAN OKTET?
4. KONSENTRASI LARUTAN
TEORI ASAM BASA LUX-FLOOD, SISTEM PELARUT DAN USANOVICH
Posted by pada 12 Juli 2011
Catatan : Tiga
teori asam basa yang di bahas pada artikel ini merupkan kutipan dari
catatan dan apa yang ditangkap ketika kulia anorganik fisik, sehingga
apabila terdapat kesalahan silakan tinggalkan pesan pada kotak komentar.
Untuk Memahami selengkapnya tentang teori asam-basa silakan kunjungi wikipedia dalam bahasa Inggris di sini…!!!!
Selain teori asam basa menurut Arhenius, Bronsted-Lowry dan Lewis dikenal pula teori asam basa sistem pelarut, teori asam basa lux-flood, teori asam basa asam usanovich.
Teori asam basa Lux-Flood
Berdasarkan teori ini asam dan basa ditinjau dari donor dan apsepto ion oksida. Asam yakni spesi kimia yang dapat menonorkan ion oksida (O2-), sedangkan suatu basa spesi yang dapat menerima (aseptor ion oksida). Teori ini biasanya digunakan untuk meramalkan reaksi-reaksi yang berlangsung pada suhu tinggi dan proses metalurgi.
Contoh reaksi antara CaO (kapur) dan SiO2 (pasir) yang terjadi pada suhu tinggi. Persamaan reaksi yang terjadi sebagai berikut.
CaO(s) + SiO2(s0 → CaSiO3(s)
SO3(g) + H2O(l0 → H2SO4(aq)
SiO2(g) + H2O(l) → H2CO3(aq)
Teori asam Basa sistem Pelarut
Asam basa sistem basa sistem pelarut dikembangkan oleh Cady Esley. Berdasarkan teori ini, asam sistem pelarut yaitu spesies kimia yang bila dilarutkan dalam pelarut tertentu dapat meningkatkan konsentrasi kation karakteristik dari pelarut tersebut.
Contoh cairan NH4Cl dilarutkan dalam cairan NH3, maka NH4Cl bertindak sebagia asam sistem pelarut karena dalam NH3, cairan NH4Cl teriosisasi menjadi NH4+ + Cl-. NH4+ inilah yang disebut kation karakteristik pelarut (KKP).
Sedangkan basa sistem pelarut yaitu suatu spesi kimia yang bila dilarutkan dalam pelarut tertentu dapat meningkatkan anion karakteristik plarut tersebut.
Contoh melarutkan kristal NaCl dalam cairan POCl2, maka NaCl disebut anion karakteristik pelarut (AKP). Karena dalam campuran NaCl terurai menjadi Na+ dan Cl-. Cl- inilah yang disebut AKP.
Lalu bagaimana jika padatan KCl dilarutkan dalam cairan NH3?. Jika hal ini dilakukan maka bukan termasuk teori asam basa sistem pelarut karena KCl tidak menigkatkan kation maupun anion karakteristik pelarut. Dalam hal ini pelarut tidak mengandung ion K+ dan Cl- hasil ionisasi KCl.
Teori Asam Basa Asam Usanovich
Usanovich merupakan seorang ahli kimia Rusia. Teori Asam Basa Asam Usanovich tidak diakui oleh dunia atau bisa dibilang bukan teorinya. Hal ini disebabkan teori yang diungkapkan tersebut merupakan gabungan dari semua teori asam basa yang pernah diungkapkan ahli-ahli kimia yang lain.
Ilmu kimia Rusia sebenarnya sangat maju, namun buku kimia rusia dulu (tidak tahu sekarang) hampir semuanya ditulis dalam bahasa rusia sehingga perkembagan ilmu kimia rusia tidak banyak yang diketahui orang-orang di dunia luar. Perlu diketahui bahwa di dunia ini lulusan S1 kimia Rusia sangat berpengaruh dan benar-benar disegani.
Menurut Usanovich, asam yaitu suatu spesies kimia yang dapat bereaksi dengan basa, dapat mendonorkan kation atau dapat menerima anion serta elektron. Sedangkan basa yaitu suatu spesies kimia yang dapat bereaksi dengan asam, dapat memberikan anion atau elektron atau dapat bergabung dengan kation.
Baca Juga :
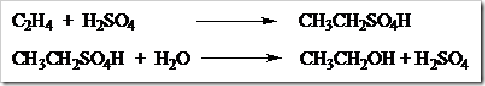
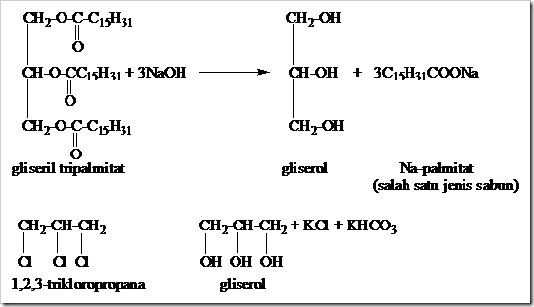
1. Fosfor Dan Bahaya Bom Fosfor
2. EMAS PUTIH, TAMBANG, JENIS, PROSES PENGOLAHAN BIJIH, SIFAT DAN PEMAKAIAN EMAS
3. Ricin Salah Satu Racun yang diTakuti DiDunia
4. inilah jenis-jenis uang yang pernah ada dan yang ada sekarang di Indonesia Tercinta
5. pembuatan sabun transparan biji mangga
PEWARNA MAKANAN
Posted by pada 1 Juni 2011
Tujuan pemberian pewarna
Tujuan
pemberian zat pewarna makanan agar bahan makanan tampak lebih menarik
dan lebih segar, sehingga menimbulkan selera orang untuk mencicipinya.Penggolongan zat pewrna
Berdasarkan sumbernya zat pewarna digolongkan menjadi pewrna alami dan pewarna sintetik.
Untuk
pewarna makanan digolongkan berdasarkan kelarutannya dalam air.
Berdasarkan sifat kelarutannya, zat pewarna makanan dikelompokkan
menjadi dye dan lake.
Dye
merupakan zat pewarna makanan yang umum larut dalam air. Dye biasanya
dijual di pasaran dalam bentuk serbuk, butiran, pasta atau cairan.
Pewarna jenis ini biasanya digunakan untuk mewarnai minuman berkarbonat,
minuman ringan, roti, kue-kue produk susu, pembungkus sosis, dan
lain-lain.
Gambar Contoh bentuk pewarna makanan dye sintetik
Lake
merupakan gabungan antara zat warna dye dan basa yang dilapisi oleh
suatu zat tertentu. Karena sifatnya yang tidak larut dalam air maka zat
warna kelompok ini cocok untuk mewarnai produkproduk yang tidak boleh
terkena air atau produk yang mengandung lemak dan minyak.
Zat Pewarna Alami
Zat
warna alami adalah zat warna (pigmen) yang diperoleh dari tumbuhan,
hewan, atau dari sumber-sumber mineral. Beberapa zat pewarna yang
diperoleh dari tumbuhan dapat dilihat pada tabel.
| Warna | Sumber |
| Hijau
Kuning Coklat Merah Kuning kemerahan |
Daun pandan
Kunyit Buah coklat Daun jati Wortel |
Berikut penjelasan untuk beberapa tumbuhan yang dapat dijadikan sebagai pewarna makanan.
1. Buah Bit (pemberi warna pink atau merah keunguan)
Buah
berwarna merah tua ini mengandung vitamin A (karotenoid), vitamin B1,
B2, vitamin C dan asam folat. Manfaatnya antara lain membantu mengobati
penyakit hati dan empedu, penghamcur sel kanker dan tumor, mencegah
anemia, menurunkan kolesterol dan membantu produksi sel darah merah.
2. Wortel (pemberi warna kuning/jingga)
Wortel
bermanfaat dalam menurunkan kadar kolesterol dalam darah, serta
membantu pertahanan tubuh dari resiko kanker, terutama kanker paru-paru,
kanker larynk (tenggorokan), esophagus (kerongkongan), prostat, kandung kemih, dan leher rahim.
3. Kunyit (pemberi warna kuning)
Kunyit mengandung curcumin, suatu
zat berwarna kuning.Jenis tanaman obat ini berguna sebagai obat anti
gatal dan anti kejang, mengurangi pembengkakan, dan menyembuhkan hidung
tersumbat.
4. Sawi (pemberi warna hijau)
Sayuran
ini kaya akan protein,lemak, karbohidrat, Ca, P, Fe, vitamin A, vitamin
B dan vitamin C. Manfaatnya untuk mengurangi rasa gatal ditenggorokan
pada penderita batuk, penyembuh penyakit kepala, bahan pembersih kepala,
bahan pembersih darah, memperbaiki fungsi ginjal, serta memperbaiki dan
memperlancar percernaan.
5. Daun Selada (pemberi warna hijau)
Daun
selada air juga bermanfaat bagi kesehatan. Selain kaya serat, sayuran
berwarna hijau muda ini juga mengurangi resiko terjadinya kanker,
katarak, menurunkan resiko gangguan jantung dan terjadinya stroke,
mengurangi ganguan anemia, meringankan insomnia(sulit tidur), serta
membantu kerja pencernaan dan kesehatan organ hati.
6. Daun Suji dan Daun Pandan (pemberi warna hijau).
Daun
suji lebih sering dipakai sebagai pewarna pada kue jajan pasar dan
minuman.Daun� pandan juga bisa memberikan warna pada masakan dengan cara
menumbuk dan memeras airnya, namun efek warnanya tidak sekuat daum
suji.
Jenis zat pemberi warna dalam pewarna alami
Di
dalam pewarna alami terdapat zat-zat tertentu sehingga dapat memberikan
warna yang tertentu pula. Zat-zat pemberi warna pada pewarna alami
antara lain: karotenoid, antosianin, kurkum, biksin, karamel, titanium
oksida, cochineal, karmin dan asam karminat yang akan di bahas secara
ringkas.
1. Karotenoid
Karotenoid
dapat diperoleh dari buah bit, wortel dan papaya. Menghasilkan warna
jingga sampai merah dan biasanya digunakan untuk mewarnai produk-produk
minyak dan lemak seperti minyak goreng dan margarin.
2. Antosianin
Mencakup
warna merah, oranye, ungu dan biru banyak terdapat pada mahkota bunga
dan buah-buahan. Misalnya bunga mawar, pacar air, kembang sepatu, bunga
tasbih/kana, krisan, pelargonium, aster cina, dan buah apel,chery,
anggur, strawberi, juga terdapat pada buah manggis dan umbi ubi jalar.
Bunga telang, menghasilkan warna biru keunguan. Bunga belimbing sayur
menghasilkan warna merah. Penggunaan zat pewarna alami, misalnya pigmen
antosianin masih terbatas pada beberapa produk makanan, seperti produk
minuman (sari buah, juice dan susu).
3. Kurkumin
Menghasilkan warna kuning yang diisolasi dari tumbuhan kunyit.
4. Klorofil
Mencakup
warna hijau yang di peoleh dari tumbuhan yang berwarna hijau. Misalnya
daun suji dan daun pandan, daun katuk yang digunakan sebagai penghasil
warna hijau untuk berbagai jenis kue jajanan pasar. Selain menghasilkan
warna hijau yang menarik, ketiganya memiliki wangi yang khas.
5. Biksin
Biksin
memberikan warna kuning seperti mentega dan sering digunakan untuk
mewarnai mentega, margarin, minyak jagung dan salad dressing. Biksin
diperoleh dari biji pohon Bixa orellana yang terdapat di daerah tropis
6. Karamel
Karamel
berwarna coklat gelap dan merupakan hasil dari hidrolisis (pemecahan)
karbohidrat, gula pasir, laktosa dan sirup malt. Karamel terdiri dari 3
jenis, yaitu
a) karamel tahan asam. Sering digunakan untuk minuman berkarbonat.
b) karamel cair untuk roti dan biskuit
c) karamel kering.
Pewarna Sintetik
Karena
zat pewarna yang diperoleh dari alam pilihan warnanya sangat sedikit,
maka dicari alternatif lain untuk memproduksi zat-zat pewarna tersebut
dilaboratorium maupun dalam skala insdustri yang dikenal sebagai pewarna
sintetik. Zat warna sintetik ditemukan William Henry Perkins tahun
1856, namun baru mulai digunakan sejak tahun 1956 dan saat ini ada
kurang lebih 90% zat warna buatan digunakan untuk industri makanan
maupun dalam laboratorium.
Penggunaan
pewarna sintetik mempunyai kadar maksimum yang dianjurkan, jika
digunakan melebihi kadar maksimum yang dianjurkan dapat menggangu
kesehatan. Namun dalam penggunaanya masyarakat lebih memilih pewarna
sintetik. Berikut beberapa alasan masyarakat lebih memiliki pewarna
sintetik.
a) lebih banyak pilihan warna dan harganya yang murah
b) lebih tahan lama dan dapat menghasilkan warna yang kuat dalam jumlah sedikit.
c) Warna yang dihasilkan dari pewarna sintetik akan tetap cerah meskipun sudah mengalami proses pengolahan dan pemanasan.
Beberapa keterbatasan pewarna alami dibanding pewarna sintetik adalah sebagai berikut.
1. Sering memberi rasa atau flavor khas yang tidak diinginkan.
2.
Konsentrasi pigmen warna rendah, sehingga diperlukan dalam jumlah yang
banyak untuk menghasilkan warna yang kuat atau warna yang terang atau
menarik.
3. Stabilitas pigmen rendah.
4. Keseragaman warna kurang baik.
5. Spektrum warna tidak seluas seperti pada pewarna sintetis.
6.
Pewarna alami mudah mengalami degradasi atau pemudaran pada saat diolah
dan disimpan. Misalnya kerupuk yang menggunakan pewarna alami, maka
warna tersebut akan segera pudar ketika mengalami proses penggorengan.
Beberapa
pewarna dapat menghasilkan warna yang sama namun penggunaannya berbeda.
Zat-zat pewarna seperti ini yang sering disalahgunakan oleh masyarakat
baik disengaja maupun tanpa disengaja. Perlu diketahui bahwa zat pewarna
sintetik yang bukan untuk makanan dan minuman (pewarna tekstil) dapat
membahayakan kesehatan apabila masuk ke dalam tubuh karena bersifat
karsinogen (penyebab penyakit kanker).
Beberapa
pewarna termasuk ke dalam golongan pewarna alami tetapi pewarna ini
diperoleh melalui reaksi kimia atau cara kimia bukan dengan cara
ekstraksi maupun isolasi. Jenis pewarna ini diproduksi dengan struktur
kimia menyerupai struktur pewarna alami. Berikut beberapa pewarna yang
termasuk dalam jenis ini:
1. canthaxanthin (merah)
2. apokaroten (merah-oranye)
3. beta karoten (oranye-kuning)
Dari
ketiga pewarna di atas hanya beta-karoten yang penggunaannya tidak di
batasi, sedangkan dua lainnya memiliki batas-batas konsentrasi maksimum.
BEBERAPA JENIS PEWARNA SINTETIK PADA BAHAN MAKANANA
Beta Karoten
 Gambar rumus struktur beta karoten
Gambar rumus struktur beta karoten
Secara
alami beta karoten terdapat dalam wortel dan merupakan zat pemberi
warna pada wortel. Beta karoten adalah salah satu zat anti oksidan yang
terdapat pada buah-buahan, antara lain terdapat pada Wortel, Kentang dan
buah peach. Zat anti oksidan sangat berguna untuk melawan zat radikal
bebas yang berasal dari zat-zat racun. Radikal bebas adalah awal dari
penyakit, termasuk disini adalah penyakit jantung yang sangat ditakuti.
Dengan adanya zat anti oksidan yang antara lain adalah beta karoten yang
terdapat pada kentang ,wortel ,peach dll ,diketahui telah dapat
mengurangi sebanyak kurang lebih 40 %, dengan hanya mengkonsumsi 50 mg
Beta karoten setiap hari dalam menu makanannya.
Biasanya,
sayur-sayuran yang berwarna hijau tua seperti bayam, brokoli daun ubi
jalar danjuga wortel banyak mengandung betakaroten. Sedangkan
buah-buahan seperti mangga,� alpukat, semangka dan melon juga cukup
banyak mengandung senyawa ini.
Betakaroten
sendiri sesungguhnya merupakan provitamin A yakni sumber� penting bagi
vitamin A di dalam saluran pencernaan khususnya pada usus halus,
betakaroten akan mengalami penyerapan yang kemudian di simpan di dalam
sel hati. Di dalam sel hati, betakaroten akan di ubah menjadi vitamin A
dan siap digunakan kalau dibutuhkan untuk berbagai reaksi metabolism.
Selain
itu betakaroten juga diperkirakan dapat meningkatkan system imunitas
tubuh terhadap serangan infeksi. Bagaimana mekanismenya dan seberapa
besar perannya, masih dalam penelitian lebih lanjut. Kemampuan
antioksidan dari betakaroten juga dapat memeberikan perlindungan
terhadap kebutaan, khususnya yng disebabkan oleh katarak. Katarak
merupakan proses pengeruhan lensa mata, sehingga bayangan objek menjadi
kabur sampai tidak terlihat. Katarak umumnya timbul bersama penyakit
ketuaan lainnya.
Begitu
banyak manfaat betakaroten untuk menunjang kesehatan tubuh. Meskipun
demikian, tidak seharusnya juga betakaroten dikonsumsi secara
berlebihan. Karena apapun yang dikonsumsi secara berlebihan sedikit
banyak tentu ada saja pengaruhnya.prinsip keseimbangan haruslah
dijadikan pegangan dalam menyusun menu harian.Tartrazin
Tartrazin
(dikenal juga sebagai E102 atau FD&C Yellow 5) adalah pewarna
kuning lemon sintetis yang umum digunakan sebagai pewarna makanan.
Tartrazin merupakan turunan dari coal tar, yang merupakan campuran dari
senyawa fenol, hidrokarbon polisiklik dan heterosklik. Karena
kelarutannya dalam air, tartrazin umum digunakan sebagai bahan pewarna
minuman. Absorbansi maksimal senyawa ini dalam air jatuh pada panjang
gelombang 427±2 nm.
Gambar struktur tarttrasin
Tartrazin
merupakan bahan pewarna yang umum digunakan di Afrika, Swedia, dan
Indonesia. Untuk menghasilkan warna lain, tartrazin dapat dicampurkan
dengan E133 Biru Brilian Brilliant Blue FCF atau E142 Hijau Green S
untuk menghasilkan sejumlah variasi warna hijau. Parlemen Eropa
mengizinkan penggunaan senyawa ini di negara Uni Eropa dengan Surat
Keputusan Konsul (Council Directive) 94/36/EC.
Walaupun
sangat langkat, tartrazin dapat menyebabkan sejumlah reaksi alergi dan
intoleransi bagi orang-orang yang intoleransi terhadap aspirin atau
penderita asma. Aspirin atau asam asetilsalisilat (asetosal) adalah
sejenis obat turunan dari salisilat yang sering digunakan sebagai
senyawa analgesik (penahan rasa sakit atau nyeri minor), antipiretik
(terhadap demam), dan anti-inflamasi (peradangan). Gejala alergi
tartrazine dapat timbul apabila senyawa ini terhirup (inhalasi) atau
ditelan (ingesti). Reaksi alergi yang timbul berupa sesak napas, pusing,
migrain, depresi, pandangan kabur, dan sulit tidur.
Berikut
adalah beberapa daftar makanan yang mungkin mengandung tartrazin. Ada
tidaknya, sedikit banyaknya kandungan tartrazine tergantung pada
kebijakan perusahaan manufaktur atau koki yang membuat makanan. Minuman
ringan, puding, keripik, sereal, kue, sup, saus, es krim, permen, selai,
jeli, mustard, acar, yogurt, mie, dan jus. Sedangkan dalam produk medis
vitamin, antasida, kapsul dan obat-obat preskripsi tertentu.
PEWARNA MAKANAN YANG DILARANG
Rhodamin B
Rhodamin B adalah salah satu pewarna sintetik yang tidak boleh dipergunaan untuk makanan dan memiliki rumus molekul C28H31N2O3Cl,
dengan berat molekul sebesar 479.000. Rhodamin B ini biasanya dipakai
dalam pewarnaan kertas, di dalam laboratorium digunakan sebagai pereaksi
untuk identifikasi Pb, Bi, Co, Au, Mg, dan Th. Beberapa sifat fisik
rhodamin B sebagai berikut:
1. kristal hijau atau serbuk-unggu kemerah-merahan
2. mudah larut dalam air yang akan menghasilkan warna merah kebiru-biruan dan berflourensi kuat.
3. larut dalam alkohol, HCl dan NaOH.
Rhodamin
B sekarang sering digunakan untuk mewarnai berbagai jenis makanan dan
minuman misalnya kue-kue basah, saus, sirup, kerupuk. Ciri-ciri makanan
yang diberi Rhodamin B adalah warna makanan merah terang mencolok.
Biasanya makanan yang diberi pewarna untuk makanan warnanya tidak begitu
merah terang mencolok. Tanda-tanda dan gejala akut bila terpapar
Rhodamin B adalah sebagai berikut.
1) Jika terhirup dapat menimbulkan iritasi pada saluran pernafasan.
2) Jika terkena kulit dapat menimbulkan iritasi pada kulit
3) Jika terkena mata dapat menimbulkan iritasi pada mata, mata kemerahan, udem pada kelopak mata.
4) Jika tertelan dapat menimbulkan gejala keracunan dan air seni berwarna merah atau merah muda.
5)
Jika tertelan, dapat menimbulkan iritasi pada saluran pencernaan .dan
menimbulkan gejala keracunan dan air seni berwarna merah atau merah
muda.
Tindakan yang bisa dilakukan bila terpapar Rhodamin B
a.
Bila terkena kulit, lepaskan pakaian perhiasan, sepatu penderita yang
terkontaminasi/terkena Rhodamin B. Cuci kulit dengan sabun dan air
mengalir sampai bersih dari Rhodamin B, selama kurang lebih 15 s/d 20
menit, bila perlu hubungi dokter.
b.
Bila terkena mata, bilas dengan air mengalir atau larutan garam
fisiologis, mata dikedip-kedipkan sampai dipastikan sisa Rhodamin B
sudah tidak ada lagi/bersih, bila perlu hubungi dokter.
c.
Bila terhirup segera pidahkan korban dari lokasi kejadian, pasang
masker berkatup atau perlatan sejenis untuk melakukan pernapasan buatan,
bila perlu hubungi dokter.
d.
Bila tertelan dan terjadi muntah, letakkan posisi kepala lebih rendah
dari pinggul untuk mencegah terjadinya muntahan masuk ke saluran
pernafasan.
e. Bila korban tidak sadar, miringkan kepala ke samping atau ke satu sisi, bila perlu hubungi dokter.
Metanil Yellow
Merupakan
salah satu zat pewama yang tidak diizinkan untuk ditambahkan ke dalam
bahan makanan. Metanil Yellow digunakan sebagai pewama untuk
produk-produk tekstil (pakaian), cat kayu, dan cat lukis. Metanil juga
biasa dijadikan indikator reaksi netralisasi asam basa.
FILE UNTUK ARTIKEL INI SILAKAN UNDUH DISINI…!!!!!!!!
ARTIKEL YANG DISARANKAN:
2. INDEKS BERBAGAI PEWARNA BESERTA GOLONGAN BERDASARKAN STUKTUR KIMIANYA SILAKAN BUKA WEBSIDE BERIKUT : http://stainsfile.info/StainsFile/dyes/dyes.htm ATAU KLIK DI SINI…..!!!!!
SISTEM KOLOID
Posted by pada 30 Mei 2011
Pendahuluan
Dalam kehidupan sehari-hari kita sering bersinggungan dengan sistem koloid sehingga sangat penting untuk dikaji. Sebagai contoh, hampir semua bahan pangan mengandung partikel dengan ukuran koloid, seperti protein, karbohidrat, dan lemak. Emulsi seperti susu juga termasuk koloid. Dalam bidang farmasi, kebanyakan produknya juga berupa koloid, misalnya krim, dan salep yang termasuk emulsi. Dalam industri cat, semen, dan industri karet untuk membuat ban semuanya melibatkan sistem koloid. Semua bentuk seperti spray untuk serangga, cat, hair spray, dan sebagainya adalah juga koloid. Dalam bidang pertanian, tanah juga dapat digolongkan sebagai koloid. Jadi sistem koloid sangat berguna bagi kehidupan manusia.
Pengertian
Koloid adalah suatu bentuk campuran yang keadaannya antara larutan dan suspensi. Larutan memiliki sifat homogen dan stabil. Suspensi memiliki sifat heterogen dan labil. Sedangkan koloid memiliki sifat heterogen dan stabil.
Perhatikan perbedaan tiga contoh campuran di bawah ini:
· Campuran antara air dengan sirup
· Campuran antara air dengan susu.
· Campuran antara air dengan pasir.
Jika kita campurkan air dengan sirup maka sirup akan terdispersi (bercampur) dengan air secara homogen (bening) Jika didiamkan, campuran itu tidak memisah dan juga tidak dapat dipisahkan dengan penyaringan biasa maupun penyaringan yang lembut (penyaringan mikro). Secara makroskopis maupun mikroskopis mcampuran ini tampak homogen, tidak dapat dibedakan mana yang air dan mana yang sirup. Campuran seperti inilah yang disebut larutan.
Jika kita campurkan susu (misalnya, susu instan) dengan air, ternyata susu “larut” tetapi “larutan” itu tidak bening melainkan keruh. Jika didiamkan, campuran itu tidak memisah dan juga tidak dapat dipisahkan dengan penyaringan (hasil penyaringan tetap keruh). Secara makroskopis campuran ini tampak homogen. Akan tetapi, jika diamati dengan mikroskop ultra ternyata masih dapat dibedakan partikel-partikel lemak susu yang tersebar di dalam air. Campuran seperti inilah yang disebut koloid.
Jika kita campurkan air dengan pasir maka pasir akan terdispersi (bercampur) dengan air secara heterogen dan langsung memisah antara air dengan pasir, yang keadaannya pasir akan mengendap di dasar air dan dapat dipisahkan dengan penyaringan biasa, bahkan dapat dipisahkan dengan cara dituang perlahan-lahan. Secara makroskopis campuran ini sudah tampak hetrogen, dapat dibedakan mana yang air dan mana yang pasir. Campuran seperti inilah yang disebut suspensi.
Secara ringkas perbandingan sifat larutan, koloid dan suspensi seperti yang pada Tabel beikut.
| Sifat | Larutan | Koloid | Suspensi |
| Ukuran | 1 nm | 1-100 nm | > 100 nm |
| Pengyaringan | Filter/membran | Filter | Tidak dengan filter atau membran |
| Jarak penglihatan tampak | Tidak nampak | Tampak dengan mikroskop elektron | Tampak dengan mikroskop cahaya |
| Gerakan | Molekul | Brown | Gya berat |
| Lintasan cahaya | Transparan | Kadang tembus cahaya/buram | Sering kali buram mungkin tembus cahaya |
| Efek tyndall | Tidak ada | Ada | |
| Jumlah fasa | satu | dua | dua |
Contoh: tepung kanji dimasukkan ke dalam air panas maka akan membentuk sistem dispersi. Di sini air sebagai medium pendispersi, dan tepung kanji sebagai zat terdispersi.
Jadi, koloid tergolong campuran heterogen (dua fase) dan setabil. Zat yang didipersikan disebut fase terdispersi, sedangkan medium yang digunakan untuk mendispersikan zat disebut medium dispersi. Fase terdispersi bersifat diskontinu (terputus-putus), sedangkan medium dispersi bersifat kontinu. Pada campuran susu dengan air, fase terdispersi adalah lemak, sedangkan medium dispersinya adalah air.
JENIS-JENIS KOLOID
Jenis-jenis sistem koloid berdasarkan jenis fasa terdispersi dan medium dispersi seperti yang tertera pada Tabel di bawah ini.
| No. | Zat terdispersi | Medium dispersi | Nama Tipe | Contoh |
| 1. | Gas | Cairan | Busa | Krim kocok, busa bir, busa sabun |
| 2. | Gas | Padat | Busa padat | Batu apung, karet busa |
| 3. | Cairan | Gas | Aerosol cair | Kabut, awan |
| 4. | Cairan | Cairan | Emulsi | Mayones, susu |
| 5. | Cairan | Padat | Emulsi padat | Keju, mentega |
| 6. | Padat | Gas | Aerosol | Asap, debu di udara |
| 7. | Padat | Cair | Sol gel |
Pati dalam air, selai Agar-agar dingin |
| 8. | Padat | Padat | Sol padat | Intan hitam, kaca rubi |
Dari tabel di atas dapat diketahui bahwa tidak ada koloid yang terbentuk dari campuran antara gas-gas. Hal ini disebabkan campuran gas-gas tercampur secara merata sehingga disebut juga sebagai larutan.
Aeresol
Aerosol ada yang berupa aerosol cair dan aerosol padat. Aerosol cair merupakan koloid yang fase terdispersinya zat cair dan medium pendispersinya gas. Contoh aerosol cair hasil industri adalah pembasmi serangga dalam bentuk spray, hair spray, dan parfum. Jika disemprotkan di udara, titik-titik zat cair akan tersebar di udara membentuk koloid aerosol. Aerosol cair yang terjadi secara alami
Contohnya kabut dan awan.
Kabut merupakan titik-titik yang tersebar di udara secara merata. Aerosol padat merupakan koloid yang fase terdispersinya zat padat dan medium pendispersinya gas. Aerosol padat contohnya asap dan debu. Berbagai asap sebenarnya berupa partikelpartikel padat sangat halus yang tersebar di udara. Asap berbahaya yang terjadi di rumah atau di ruangan adalah asap obat nyamuk dan asap rokok yang berlebihan. Debu juga merupakan partikel-partikel padat sangat halus, yang tersebar di udara. Debu dapat berada di rumah karena terbawa angin dari luar.
Busa
Busa ada yang berupa buih dan busa padat. Buih atau busa cair merupakan koloid yang fase terdispersinya gas dan medium pendispersinya zat cair. Buih yang paling banyak ditemukan yaitu busa sabun. Contoh lainnya yaitu putih telur yang dikocok. Udara sebagai fase terdispersi dan putih telur sebagai medium pendispersi.
Di bidang industri kosmetik ada bahan untuk pengeras rambut yang berupa busa cair atau foam. Sedangkan di industri makanan contoh bahan berupa busa cair yaitu krem untuk kue tart. Krem ini dikemas dalam tube seperti pasta gigi.
Busa padat, fase terdispersinya gas, medium pendispersinya zat padat. Produk busa padat yang banyak digunakan untuk kemasan barang yang mudah pecah atau rusak adalah styrofoam. Styrofoam salah satu contoh dari polimer sintetis.
Emulsi
Emulsi merupakan koloid yang fase terdispersinya dan medium pendispersinya zat cair, contohnya campuran minyak dan air. Campuran ini cenderung untuk terpisah sehingga untuk menstabilkan campuran biasanya ditambahkan emulgator.
Bahan yang merupakan emulsi misalnya cat, pasta gigi, kosmetik (cleansing milk, foundation), dan salad dressings. Padasalad dressings untuk menyatukan minyak dan air digunakan emulgator kuning telur. Sabun juga merupakan emulgator untuk menyatukan lemak/minyak pada tubuh dengan air saat membersihkan badan. Emulsi padat fase terdispersinya zat cair, medium pendispersinya zat padat. Contoh mentega, keju, dan jelli.
SIFAT-SIFAT KOLOID
Berikut beberapa topik yang akan di bahas mengenai sifat-sifat koloid.
a) Efek Tyndall
b) Gerak Brown
c) Muatan Koloid
d) Koagulasi
e) Koloid Pelindung
f) Koloid Liofil dan Koloid Liofob
a. Gerak brown
Gerka brown adalah gerak tidak beraturan atau gerak acak atau gerak zig-zag partikel koloid. Hal ini terjadi karena adanya benturan tidak teratur daari partikel koloid denga medium pendispersi. Dengan adanya gerak Brown ini maka partikel koloid terhindar dari pengendapan karena terus-menerus bergerak, sehingga koloid menjadi stabil. Gerak zig-zag partikel koloid disebut gerak Brown, sesuai dengan nama penemunya Robert Brown seorang ahli biologi berkebangsaan Inggris.

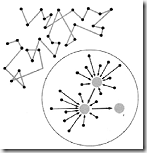
Gambar Robert Brown dan gerak brwon.
Jika kita amati koloid dibawah mikroskop ultra, maka kita akan melihat bahwa partikel-partikel tersebut akan bergerak membentuk zigzag. Pergerakan zigzag ini dinamakan gerak Brown. Partikel-partikel suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas( dinamakan gerak brown), sedangkan pada zat padat hanya beroszillasi di tempat ( tidak termasuk gerak brown ).
Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. Tumbukan tersebut berlangsung dari segala arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan yang terjadi cenderung tidak seimbang. Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak partikel sehingga terjadi gerak zigzag atau gerak Brown.
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang terjadi. Demikian pula, semakin besar ukuran partikel koloid, semakin lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam campuran heterogen zat cair dengan zat padat (suspensi).
Gerak Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown semakin lambat.
b. Efek tyndall
Efek tindal yaitu efek penghamburan cahaya oleh partikel koloid. Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall. Efek Tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat larutan sejati (gambar kiri) disinari dengan cahaya, maka larutan tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid (gambar kanan), cahaya akan dihamburkan.
Hal itu terjadi karena partikel-partikel koloid mempunyai partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
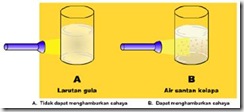
Gambar hamburan cahaya oleh air santan kelapa (koloid) dan larutan gula yang bukan koloid
Contoh efek tindal dapat dilihat pada kedua contoh berikut
Gambar penghamburan cahaya oleh sistem koloid (gambar kiri)
· Jika sinar matahari masuk melalui celah ke dalam ruangan, pada sinar tsb terlihat debu” beterbangan (daerah ini terlihat leih terang).
· Jika koen liat film di bioskop, trus ada org ngrokok. Keplaken ae wong iku pek… asap rokok yg mengepul ke atas mengakibatkan cahaya proyektor terlihat lebih terang dan gambar pada layar menjadi buram.
· Sorot lampu mobil pada malam hari yg berkabut terlihat lebih jelas, tetapip jalan kelihatan tidak jelas.
c. Adsorpsi
Adsorpsi yaitu penyerapan pada permukaan partikel koloid oleh adanya gaya adhesi zat-zat asing. Daya adsorpsi koloid sangat besar karena permukaan partikel koloid yang sangat luas bila dibandingkan permukaan zat padat dengan jumlah yang sama.
Partikel koloid sol tersebut tidak selalu mengadsorpsi ion yang sama. Hal itu tergantung pada muatan yang berlebih dari medium pendispersinya. Misalnya, jika sol AgCl terdapat pada medium pendispersi dengan kation Ag+ berlebih, maka AgCl akan bermuatan positif. Sedangkan jika AgCl terdapat pada medium pendispersi dengan anion Cl- berlebih, maka sol AgCl akan bermuatan negatif.
Koloid yang berbeda akan mengadsorpsi zat-zat yang berbeda pula. Sifat adsorpsi koloid ini umumnya digunakan untuk mengadsorpsi/membuang kotoran/warna dan bau, memisahkan campuran, memekatkan bijih tambang, dan proses pemurnian lainnya.
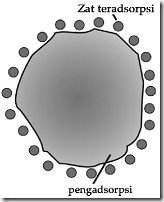
Gambar penyerapan suatu zat oleh zat pengadsorbsi

Gambar Absorbsi pada permukaan koloid
· Penjernihan air
· Penghilangan kotoran pd proses pembuatan sirup
· Proses menghilangkan bau badan
· Pengguanaan arang aktif d. Koagulasi
Koagulasi yaitu penggumpalan partikel koloid yang terjadi karena kerusakan stabilitas sistem koloid atau karena penggabungan partikel yg berbeda muatan sehinggas membentuk partikel koloid yg lebih besar. Koagulasi dapat dilakukan dengan cara mekanik dan kimiawi:
· Cara mekanik : pemanasan, pendinginan dan pengadukan.
· Cara kimiawi : penetralan silang atau menghilangkan muatan dan penambahan elektrolit.
Contoh proses-proses yang memanfaatkan sifat koagulasi dari koloid :
a) Pengolahan karet dari bahan mentahnya ( lateks ) dengan koagulan berupa asam format.
b) Proses penjernihan air dengan menambahkan tawas. Tawas aluminium sulfat (mengandung ion Al3+) dapat digunakan untuk menggumpalkan lumpur koloid atau sol tanah liat dalam air (yang bermuatan negatif).
c) Jika sol Fe(OH)3 yang bermuatan positif ditambah sol As2S3 yang bermuatan negatif, maka akan terjadi koagulasi.
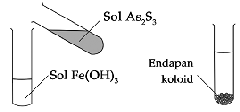
d) Proses terbentuknya delta di muara sungai. Terjadi karena koloid tanah liat dalam air sungai mengalami koagulasi ketika bercampur dengan elektrolit dalam air laut.
e) Asap atau debu pabrik dapat digumpalkan dengan alat koagulasi listrik ( pesawat Cottrel ). Metode ini dikembangkan oleh Frederick Cottrel ( 1877 – 1948 ).
f) Proses yang dilakukan oleh ion Al3+ atau Fe3+ pada penetralan partikel albuminoid yang terdapat dalam darah, mengakibatkan terjadinya koagulasi sehingga dapat menutupi luka.Pengolahan Air Bersih
Pengolahan air bersih didasarkan pada sifat-sifat koloid, yaitu koagulasi dan adsorpsi. Air sungai atau air sumur yang keruh mengandung lumpur yang merupakan partikel koloid. Selain itu terdapat pula zat-zat warna, zat pencemar, seperti limbah detergen, dan pestisida. Bahan-bahan yang diperlukan untuk pengolahan air adalah tawas biasanya aluminium sulfat, pasir, klorin atau kaporit, kapur tohor, dan karbon aktif. Tawas berguna untuk menggumpalkan lumpur agar lebih mudah disaring. Tawas juga membentuk koloid Al(OH)3 yang dapat mengadsorpsi zat-zat warna atau zat-zat pencemar, seperti detergen dan pestisida.
Apabila tingkat kekeruhan air yang diolah terlalu tinggi, maka digunakan karbon aktif di samping tawas. Pasir berfungsi sebagai penyaring. Klorin atau kaporit berfungsi sebagai pembasmi hama (desinfektan), sedangkan kapur tohor berguna untuk menaikkan pH, yaitu untuk menetralkan keasaman yang terjadi karena penggunaan tawas.
Pengolahan air bersih di kota-kota besar pada prinsipnya sama dengan pengolahan air sederhana yang dijelaskan di atas. Mula-mula air sungai dipompakan ke dalam bak prasedimentasi. Di sini lumpur dibiarkan mengendap karena pengaruh gravitasi. Lumpur dibuang dengan pompa, sedangkan air selanjutnya dialirkan ke dalam bak ventury. Pada tahap ini dicampurkan tawas dan gas klorin (preklorinasi).
Pada air baku yang kekeruhan dan pencemarannya tinggi, perlu dibubuhkan karbon aktif yang berguna untuk menghilangkan bau, warna, rasa, dan zat organik yang terkandung dalam air baku. Dari bak ventury, air baku yang telah dicampur dengan bahan-bahan kimia dialirkan ke dalam accelator. Di dalam bak accelator ini terjadi proses koagulasi, lumpur dan kotoran lain menggumpal membentuk flok-flok yang akan mengalami sedimentasi secara gravitasi. Selanjutnya, air yang sudah setengah bersih dialirkan ke dalam bak saringan pasir. Pada saringan ini, sisa-sisa flok akan tertahan. Dari bak pasir diperoleh air yang sudah hampir bersih.
Air yang sudah cukup bersih ini ditampung dalam bak lain yang disebut siphon, di mana ditambahkan kapur untuk menaikkan pH dan gas klorin (postklorinasi) untuk mematikan hama. Dari bak siphon, air yang sudah memenuhi standar air bersih selanjutnya dialirkan ke dalam reservoar, kemudian ke konsumen.
Elektroforesis
Peristiwa elektroforesis adalah peristiwa mengalirnya partikel-partikel koloid menuju elektroda, bergeraknya partikel koloid ke dalam satu elektroda menunjukkan bahwa partikel-partikel koloid bermuatan listrik. Gejala ini dapat diamati dengan menggunakan alat sel elektroforesis seperti pada gambar.
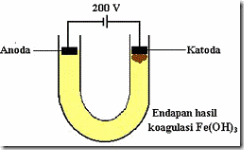
Gambar sel elektrolisis
Dengan menggunakan sel elektroforesis dapat ditentukan muatan dari partikel koloid. Elektroforesis dapat dipakai untuk memisahkan protein-protein dalam larutan. Muatan pada protein berbeda-beda, tergantung pH. Dengan membuat pH larutan tertentu (misalnya dalam larutan penyangga), pemisahan molekul-molekul protein yang berlainan jenis terjadi.
e. Koloid Pelindung
Koloid pelindung adalah koloid yang bersifat melindungi koloid lain agar tidak mengalami koagulasi sehingga koloid menjadi lebih stabil. Koloid pelindung akan membentuk lapisan di sekeliling partikel koloid yang lain. Lapisan ini akan melindungi muatan koloid tersebut sehingga partikel koloid tidak mudah mengendap atau terpisah dari medium pendispersinya.
Contohnya:
· Pada pembuatan es krim digunakan gelatin untuk mencegah pembentukan kristal besar es atau gula.
· Zat-zat pengemulsi ( sabun dan deterjen ).
· Butiran-butiran halus air dalam margarin distabilkan dengan lesitin.
· Partikel-partikel karbon dalam tinta dilindungi dengan larutan gom.
· Warna-warna dalam cat distabilkan dengan oksida logam dengan menambahkan minyak silikon.
· Pada industri susu, kasein digunakan untuk melindungi partikel-partikel minyak atau lemak dalam medium cair.
f. Koloid Liofil dan Koloid Liofob
Berdasarkan sifat adsorpsi dari partikel koloid terhadap medium pendispersinya, dikenal dua macam koloid yaitu: koloid liofil dan koloid liofob
· Koloid liofil yaitu koloid yang ”senang cairan” (bahasa Yunani : liyo = cairan; philia = senang). Partikel koloid akan mengadsorpsi molekul cairan, sehingga terbentuk selubung di sekeliling partikel koloid itu. Contoh koloid liofil adalah kanji, protein, dan agar-agar.
Ciri-cirinya Sol Liofil
1) Dapat dibuat langsung dengan mencampurkan fase terdispersi dengan medium terdispersinya
2) Mempunyai muatan yang kecil atau tidak bermuatan
3) Partikel-partikel sol liofil mengadsorpsi medium pendispersinya. Terdapat proses solvasi/ hidrasi, yaitu terbentuknya lapisan medium pendispersi yang teradsorpsi di sekeliling partikel sehingga menyebabkan partikel sol liofil tidak saling bergabung
4) Viskositas sol liofil > viskositas medium pendispersi
5) Tidak mudah menggumpal dengan penambahan elektrolit
6) Reversibel, artinya fase terdispersi sol liofil dapat dipisahkan dengan koagulasi, kemudian dapat diubah kembali menjadi sol dengan penambahan medium pendispersinya.
7) Memberikan efek Tyndall yang lemah
8) Dapat bermigrasi ke anode, katode, atau tidak bermigrasi sama sekali.
· Koloid liofob yaitu koloid yang ”benci cairan” (phobia = benci). Partikel koloid tidak mengadsorpsi molekul cairan. Contoh koloid liofob adalah sol sulfida dan sol logam.
Ciri-ciri Sol Liofob
1) Tidak dapat dibuat hanya dengan mencampur fase terdispersi dan medium pendisperinya
2) Memiliki muatan positif atau negative
3) Partikel-partikel sol liofob tidak mengadsorpsi medium pendispersinya. Muatan partikel diperoleh dari adsorpsi partikel-partikel ion yang bermuatan listrik
4) Viskositas sol hidrofob hampir sama dengan viskositas medium pendispersi
5) Mudah menggumpal dengan penambahan elektrolit karena mempunyai muatan
6) Irreversibel artinya sol liofob yang telah menggumpal tidak dapat diubah menjadi sol
7) Memberikan efek Tyndall yang jelas
8) Akan bergerak ke anode atau katode, tergantung jenis muatan partikel
KESTABILAN SISTEM KOLOID
Koloid gas dan kebanyakan koloid cairan tidak mengendap dalam waktu yang sangat lama. Hal ini menunjukan koloid stabil. Kestabilan koloid ini disebabkan karena adanya gerak Brown. Meskipun telah sampai ke dasar wadah, partikel koloid dapat naik kembali dan terus bergerak dalam mediumnya. Penyebab lainnya karena umumnya partikel koloid mengadsorpsi ion. Partikel koloid yang sama akan mengadsorpsi ion-ion yang sejenis, sehingga partikel-partikel koloid itu saling tolak-menolak karena pengaruh ion sejenis yang telah diadsorpsi.
Partikel koloid sebenarnya tidak bermuatan listrik (netral). Peristiwa elektroforesis dapat digunakan untuk mengetahui jenis muatan ion yang diadsorpsi koloid. Jika koloid mengumpul pada elektroda negatif, berarti koloid telah mengadsorpsi ion positip, dan sebaliknya.
Kestabilan koloid dapat juga disebabkan adanya adsorpsi molekul atau koloid yang lain (koloid protektif/pelindung). Misalnya gelatin sebagai penstabil es krim. Emulsi dapat terbentuk karena adanya koloid lain (emulgator/pengemulsi) sebagai pengadsorpsi. Misalnya sabun sebagai pengemulsi minyak/lemak dan air.
Pengemulsi yang lain misalnya kasein dalam susu, dan kuning telur dalam pembuatan mayones. Jika partikel-partikel koloid saling bergabung dan terkumpul menjadi partikel yang semakin besar, maka koloid akan terkoagulasi (menggumpal) dan akhirnya akan mengendap.
Secara kimia koagulasi partikel koloid dapat terjadi karena ion-ion yang telah diadsorpsi partikel koloid dilucuti atau dinetralkan. Misalnya dengan cara elektrolisis atau dicampurkan elektrolit/ion yang muatannya berlawanan. Cara lain yaitu dicapur dengan koloid lain yang telah mengadsorpsi ion yang muatannya berlawanan. Ion-ion itu akan saling tarik menarik dengan membawa serta partikel koloid yang mengadsorpsinya. Secara fisika koagulasi koloid dapat terjadi karena pemanasan atau pendinginan. Misalnya telur atau santan kelapa dapat menggumpal jika dipanaskan. Es lilin bisa menjadi keras karena didinginkan.
PEMBUATAN SISTEM KOLOID
Terdapat dua cara pembuatan koloid yaitu cara kondensasi dan cara dispersi.
1. Cara Kondensasi
Reaksi dekomposisi rangkap.
Misalnya:
1. koloid As2S3 dibuat dengan gaya mengalirkan H2S dengan perlahan-lahan melalui larutan As2O3 dingin sampai terbentuk sol As2S3 yang berwarna kuning terang.
As2O3(aq) + 3H2S(g) → As2O3 (koloid) + 3H2O(l)
Koloid As2S3 bermuatan negatif karena permukaannya menyerap ion S2
2. sol AgCl dibuat dengan mencampurkan larutan AgNO3 encer dan larutan HCl encer. Reaksinya:
AgNO3(ag) + HCl(aq) → AgCl (koloid) + HNO3(aq)
Reaksi redoks.
Misalnya: sol emas atau sol Au dapat dibuat dengan mereduksi larutan garamnya dengan melarutkan AuCl3 dalam pereduksi organik formaldehida HCOH. Reaksi yang terjadi:
2AuCl (aq) + HCOH(aq) + 3H2O(l) → 2Au(s) + HCOOH(aq) + 6HCl(aq)
Sedangkan sol belerang dapat dibuat dengan mereduksi SO2 yang terlarut dalam air dengan mengalirinya gas H2S. Reaksi kimia yang terjadi:
2H2S(g) + SO2(aq) → 3S(s) + 2H2O
Reaksi hidrolisis.
Hidrolisis adalah reaksi suatu zat dengan air. Misalanya: sol Fe(OH)3 dapat dibuat dengan hidrolisis larutan FeCl3 dengan memanaskan larutan FeCl3 atau reaksi hidrolisis garam Fe dalam air mendidih.
FeCl3(aq) + 3H2O(l) → Fe(OH)3 (koloid) + 3HCl(aq)
(Koloid Fe(OH)3 bermuatan positif karena permukaannya menyerap ion H+).
Sol Al(OH)3 dapat diperoleh dari reaksi hidrolisis garam Al dalam air mendidih.
AlCl3(aq) + 3H2O(l) → Al(OH)3 (koloid) + 3HCl(aq)
Reaksi pergantian pelarut
Cara ini dilakukan dengan mengganti medium pendispersi sehingga fasa terdispersi yang semulal arut setelah diganti pelarutanya menjadi berukuran koloid. Misalnya: untuk membuat sol belerang yang sukar larut dalam air tetapi mudah larut dalam alkohol seperti etanol dengan medium pendispersi air, belarang harus terlebih dahulu dilarutkan dalam etanol sampai jenuh. Baru kemudian larutan belerang dalam etanol tersebut ditambahkan sedikit demi sedikit ke dalam air sambil diaduk. Sehingga belerang akan menggumpal menjadi pertikel koloid dikarenakan penurunan kelarutan belerang dalam air.
Sebaliknya, kalsium asetat yang sukar larut dalam etanol, mula-mula dilarutkan terlebih dahulu dalam air, kemudianbaru dalam larutan tersebut ditambahkan etanol maka terjadi kondensasi dan terbentuklah koloid kalsium asetat.
2. Cara Dispersi
Cara Mekanik
Cara mekanik adalah penghalusan partikel-partikel kasar zat padat dengan proses penggilingan untuk dapat membentuk partikel-partikel berukuran koloid. Alat yang digunakan untuk cara ini biasa disebut penggilingan koloid, yang biasa digunakan dalam:
Ø Industri makanan untuk membuat jus buah, selai, krim, es krim,dsb.
Ø Industri kimia rumah tangga untuk membuat pasta gigi, semir sepatu, deterjen, dsb.
Ø Industri kimia untuk membuat pelumas padat, cat dan zat pewarna.
Ø Industri-industri lainnya seperti industri plastik, farmasi, tekstil, dan kertas.
Cara Peptisasi
Cara peptisasi adalah pembuatan koloid/sistem koloid dari butir-butir kasar atau dari suatu endapan/proses pendispersi endapan dengan bantuan suatu zat pemeptisasi (pemecah). Zat pemecah tersebut dapat berupa elektrolit khususnya yang mengandung ion sejenis ataupun pelarut tertentu. Contoh:
Ø Agar-agar dipeptisasi oleh air, karet oleh bensin
Ø Endapan NiS dipeptisasi oleh H2S, endapan Al(OH)3 oleh AlCl3
Ø Sol Fe(OH)3 diperoleh dengan mengaduk endapan Fe(OH)3 yang baru terbentuk dengan sedikit FeCl3. Sol Fe(OH)3 kemudian dikelilingi Fe+3 sehingga bermuatan positif
Ø Beberapa zat mudah terdispersi dalam pelarut tertentu dan membnetuk sistem koloid. Contohnya: gelatin dalam air.
Cara Busur Bredig
Cara busur Bredig ini biasanya digunakan untuk membuat sol-sol logam, sperti Ag, Au, dan Pt. Dalam cara ini, logam yang akan diubah menjadi partikel-partikel kolid akan digunakan sebagai elektrode. Kemudian kedua logam dicelupkan ke dalam medium pendispersinya (air suling dingin) sampai kedua ujungnya saling berdekatan. Kemudian, kedua elektrode akan diberi loncatan listrik, seperti gambar.
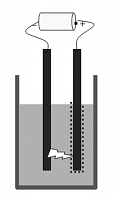
Gambar Cara busur listrik Bredig
Panas yang timbul akan
menyebabkan logam menguap, uapnya kemudian akan terkondensasi dalam
medium pendispersi dingin, sehingga hasil kondensasi tersebut berupa
pertikel-pertikel kolid. Karena logam diubah jadi partikel kolid dengan
proses uap logam, maka metode ini dikategorikan sebagai metode dispersi.PEMURNIAN KOLOID
1) Dialisis
Dialisis ialah pemisahan koloid dari ion-ion pengganggu dengan cara ini disebut proses dialisis. Yaitu dengan mengalirkan cairan yang tercampur dengan koloid melalui membran semipermeabel yang berfungsi sebagai penyaring. Membran semipermeabel ini dapat dilewati cairan tetapi tidak dapat dilewati koloid, sehingga koloid dan cairan akan berpisah.
Salah satu pemanfaatan proses dialysis adalah alat pencuci darah (Haemodialisis). Pada proses ini darah kotor dari pasien dilewatkan dalam pipa-pipa yang terbuat dari membran semipermeable. Pipa semipermeable ini dialiri cairan yang berfungsi sebagai pencuci (biasanya plasma darah), ion-ion dalam darah kotor akan terbawa aliran plasma darah.
2) Penyaring Ultra
Partikel-partikel kolid tidak dapat disaring biasa seperti kertas saring, karena pori-pori kertas saring terlalu besar dibandingkan ukuran partikel-partikel tersebut. Tetapi, bila kertas saring tersebut diresapi dengan selulosa seperti selofan, maka ukuran pori-pori kertas akan sering berkurang. Kertas saring yang dimodifikasi tersebut disebut penyaring ultra.
Proses pemurnian dengan menggunakan penyaring ultra ini termasuk lambat, jadi tekanan harus dinaikkan untuk mempercepat proses ini. Terakhir, partikel-pertikel koloid akan teringgal di kertas saring. Partikel-partikel kolid akan dapat dipisahkan berdasarkan ukurannya, dengan menggunakan penyaring ultra bertahap.
FILE SISTEM KOLOID SILAKAN UNDUH DI SINI…!!!!!!!
pH dan pOH (Derajat Keasaman dan kebasaan)
Posted by pada 21 April 2011
pH dan pOH larutan asam dan basa serta cara penentuan pH dan pOH larutan asam dan basa silakan unduh di sini…!!!!
perbedaan elektron valensi dan elektron terakhir
Posted by pada 1 Maret 2011
Pada konfigurasi elektron, jumlah elektron yang terdapat pada kulit terluar suatu atom disebut elektron valensi. Sebagian besar ikatan kimia terbentuk dengan memanfaatkan elektron valensi sehingga elektron valensi dapat dikatakan sebagai penentu sifat kimia suatu unsur. unsur-unsur yang memiliki elektron valensi yang sama akan menunjukan kemiripan sifat.
Elektron terakhir adalah elektron yang terletak pada subkulit yang mempunyai energi terbesar, yaitu elektron yang terletak pada subkulit terakhir menurut aturan Hund.

Jadi elektron valensi dari Cl adalah 7 sedangkan elektron terakhir dari Cl terletak pada subkulit 3p5 yang memiliki tanda panah biru. mempunyai n = 3, = 1, m = 0, s = – ½
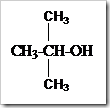
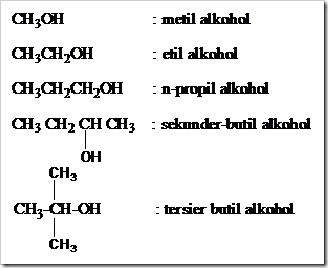
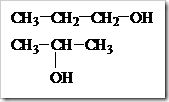
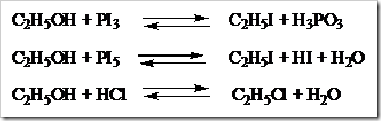
KONSENTRASI LARUTAN
Posted by pada 5 November 2010
Larutan disebut juga campuran yang homogen. Disebut campuran karena susunannya dapat berubah-ubah dan disebut homogen susunannya begitu seragam sehingga batas antara zat-zat yang melarut dan pelarut tidak dapat dibedakan bahkan dengan mikroskop optis sekalipun. Campuran-campuran homogen dari gas, emas dan perunggu dapat dikatakan pula sebagai larutan. Tetapi istilah larutan biasanya digunakan untuk fasa cair.
Zat-zat yang memiliki fasa padat dan gas lazimnya disebut sebagai zat terlarut (solute) sedangkan yang berfasa cair dikatakan sebagai pelarut. Suatu zat dikatakan sebagai pelarut apabila memiliki jumlah yang lebih banyak dibandingkan jumlah zat terlarut. Dalam kondisi tertentu misalnya campuran antara alkohol dan air dengan perbandingan 50:50. Dari campuran tersebut sedikit meragukan untuk menentukan mana yang bertindak sebagai pelarut dan mana yang bertimdak sebagai zat terlarutnya. Dari campuran yang demikian air dan alkohol dapat dikatakan sebagai pelarut dan dapat pula dikatakan sebagai zat terlarut. Lain halnya dalam pembuatan sirup. Dalam pembuatan sirup jumlah gula lebih banyak dari jumlah air tetapi air tetap dikatakan sebagai pelarut karena dapat mempertahankan keadaan fisiknya sedangkan gula atau sukrosa disebut sebagai zat terlarut.
Untuk menyatakan jumlah atau banyak zat terlarut dalam suatu larutan digunakan istilah konsentrasi. Terdapat beberapa metode yang digunakan untuk menyatakan konsentrasi zat terlarut di dalam larutan.
1. Persen massa
 |
Contoh
a. Berapa % gula dalam larutan yang dibuat dengan melarutkan 10 g gula dalam 70 g air.
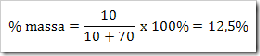
b. Berapa gram gula yang terdapat dalam 500 gram larutan 12% massa gula.

2. Persen volume
 |
Misalnya menentukan % volume alkohol dari suatu campuran. 40 mL alkohol dicampur 50 mL aseton maka:
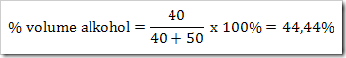
3. ppm dan ppb
Untuk larutan yang sangat sangat encer untuk menyatakan konsentrasi digunakan satuan parts per million atau bagian perjuta (ppm), dan parts per billion atau bagian per milliar (ppb).
 |
 |
 |
4. Molalitas
Kemolalan menyatakan jumlah mol zat terlarut dalam 1 Kg pelarut.
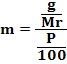 |
Contoh
1) Berapa molal larutan NaCl jika diketahui persen massa NaCl = 10%
Jawab
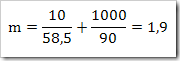
2) Berapa molalitas larutan yang dibuat dengan melarutkan 3 g urea (CO(NH)2)2) di dalam 500 g air? (Mr urea = 60)
Jawab
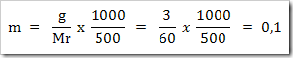
5. Molaritas (M)
Molaritas menyatakan jumlah mol zat terlarut dalam 1 liter larutan atau jumlah milimol zat terlarut dalam 1 mL larutan.
 |
Larutan 0,50M artinya 0,50 mol zat dalam satu liter larutan atau 0,50 milimol zat dalam 1 mL larutan.
 |
| 1L = 1 dm3 = 1000 mL = 1000 cm3 1 mol = 1000 mmol |
Contoh
Jika di dalam suatu botol pereaksi terdapat terdapat 250 mL larutan NaOH (Mr = 40) yang konsentrasinya 0,4M. maka
a. Berapa jumlah mol NaOH yang terkandung di dalam larutan tersebut
b. Berapa gram NaOH yang terlarut di dalam larutan tersebut
Jawab
a. Volume larutan = 250 mL = 0,25 L
Mol NaOH yang terlarut = 0,25 L x 0,4 mol/L = 0,10 mol
b. Gram NaOH yang terlarut dalam larutan = mol NaOH x Mr NaOH
= 0,1 mol x 40 g/mol = 4 g
Hubungan molaritas larutan dengan % massa
 |
 |
Didalam laboratorium tersedia larutan asam format (CHO2H) 4,6%. (Ar H = 1, C = 12 dan O = 16) dengan massa jenis 1,01 g/mL. Tentukan konsentrasi larutan tersebut…
Jawab
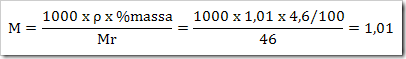
Atau
v Massa larutan = 1000 mL x 1,01 g/mL = 1010 g
v Massa zat terlarut = % massa x massa larutan = 4,6/100 x 1010 g = 46,46 g
v Mol CHO2H yang larut dalam 1 liter larutan = 46,46 g/46 g/mol = 1,01 mol
6. Fraksi mol (X)
Fraksi mol menyatakan jumlah mol zat terlarut atau jumlah mol pelarut dalam jumlah mol total larutan.
 |
 |
Contoh
1) Dalam suatu larutan 16% massa naftalena dalam benzena, tentukan fraksi mol masing-masing zat, jika diketahui Mr naftalena = 128 dan Mr benzena = 78?
Misalkan larutan total = 100 g
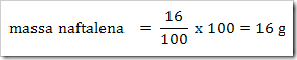
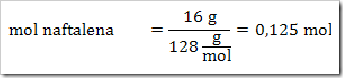
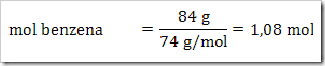
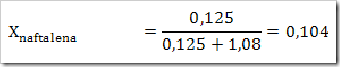
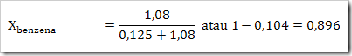
Hubungan Fraksi Mol, Kemolalan dan Kemolaran
Konstrasi larutan dapat dikonfersikan dari satuan ke satuan yang lain.misalnya suatu larutan 40% NaNO3 dengan massa jenis 1,36 g/mL. Hitunglah fraksi mol, kemolalan dan kemolaran dari NaNO3? (Mr = 85)
Jawab
Massa larutan = 1000 mL x massa jenis
= 1000 mL x 1,36 g/mL
= 1360 gram
NaNO3 yang terlarut dalam 1 liter larutan
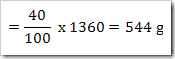
Massa molar NaNO3 = 85 g/mol
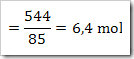
Jumlah air dalam larutan
= massa larutan – massa NaNO3
= (1360-544) gram = 816 g
= 816 / 18 = 45,33 mol
a. Fraksi mol NaNO3
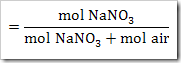

Fraksi mol H2O
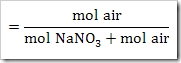

b. Kemolalan
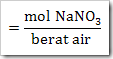
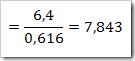
c. Kemolaran

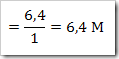
Konfigurasi Elektron
Posted by pada 1 November 2010
Technorati Tags: konfigurasi elektron,aturan aufbau,asas larangan pauli dan aturan hund,orbital bentuk orbital menulis konfigurasi elektron,konfigurasi elektron untuk ion,subkulir s p d dan f,diagram tingkat energi
Konfigurasi elektron merupakan suatu cara penulisan yang menunjukkan distribusi elektron dalam orbital-orbital atom. Penulisan konfigurasi elektron mengikuti beberapa aturan yaitu aturan Aufbau, asas Larangan Pauli dan aturan Hund. Setiap orbital pada setiap subkulit maksimal ditempati oleh dua elektron, yaitu:
Ø Subkulit s terbuat dari 1 orbital s dan ditempati oleh 2 elektron
Ø Sub kulit p terbuat dari 3 orbital p dan ditempati oleh 6 elektron
Ø Subkulit d terbuat dari 5 orbital d dan ditempati oleh 10 elektron
Ø Subkulit f terbuat dari 7 orbital f dan ditempati oleh 14 elektron
Subkulit hanya sampai f karena sampai saat ini konfigurasi elektron untuk unsur dengan nomor atom tertinggi hanya sampai subkulit f.
Aturan Aufbau
Istilah Aufbau berasal dari bahasa Jerman yang artinya membangun atau meningkat. Aturan ini menyatakan bahwa pengisian elektron ke dalam orbital selalu dimulai dari orbital yang mempunyai tingkat energi rendah ke orbital yang mempunyai tingkat energi lebih tinggi. Aturan ini dilakukan agar atom berada pada tingkat energi minimum sehingga dapat mencapai kondisi yang stabil. Diagram tingkat energi menurut aturan Aufbau:

Berdasarkan diagram tingkat energi Aufbau di atas maka urutan pengisian elektron adalah sebagai berikut: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p.
Asas Larangan Pauli
Asas larangan pauli dikemukakan oleh Wolfgang Pauli, yakni di dalam satu atom, tidak boleh ada 2 elektron yang mempunyai ke-4 bilangan kuantum yang sama. Maksud 2 elektron adalah elektron yang menempati satu orbital. Dalam 1 atom bilangan kuantum utama, bilangan kuantum azimut dan bilangan kuantum magnetik adalah sama, yang berbeda adalah bilangan kuantum spin. Misalnya orbital 1s yang ditempati oleh 2 elektron.
Elektron pertama : n = 1; l= 0; m = 0; s = + ½
Elektron kedua : n = 1; l = 0; m = 0; s = – ½
Berdasarkan asas larangan Pauli, maka setiap elektron dalam 1 atom mempunyai 1 set bilangan kuantum ( n, l, m, s ) yang spesifik. Ke-4 bilangan kuantum tersebut menentukan daerah dalam ruang tempat suatu elektron paling mungkin berada.
n = menunjukkan kulit atomnya.
l = menunjukkan subkulitnya.
m = menunjukkan orbitalnya
s = menunjukkan spinnya.
Aturan HundJika terdapat orbital-orbital dengan tingkat energi yang sama, maka tiap orbital diisi dengan satu elektron terlebih dahulu (½ penuh) dengan spin yang sama. Jika masih terdapat sejumlah elektron yang tersisa maka elektron tersebut ditambahkan pada setiap orbital dengan spin yang berlawanan dengan spin awal. Misalnya pengisian elektron pada orbital-orbital dari oksigen.
Konfigurasi elektron 8O = 1s2 2s2 2p4
Diagram orbitalnya:
Menulis Konfigurasi Elektron
Konfigurasi elektron dapat ditulis berdasarkan urutan dari Aufbau atau dapat disingkat menggunakan konfigurasi elektron gas mulia. Singkatan ini dilakukan agar penulisan konfigurasi elektron tidak terlalu panjang lagipula dalam pembentukan ikatan kimia elektron valensi lebih berperan, sedangkan elektron-elektron yang lebih dekat ke inti tidak begitu berpengaruh dalam pembentukan ikatan kimia.
Misalnya:
10Ne = 1s2 2s2 2p6
11Na = 1s2 2s2 2p6 3s1 atau (Ne) 3s1
Konfigurasi elektron ionkation bermuatan y+ terbentuk jika atom netralnya melepaskan y elektron. Elektron yang dilepas merupakan elektron dari kulit terluar.
21Sc = (Ar) 3d1 4s2
Sc3+ = (Ne) 2s2 2p6
26Fe = (Ar) 3d6 4s2
Fe2+ = (Ar) 3d6
Fe3+ = (Ar) 3d5
Anion bermuatan y- terbentuk dari atom netralnya dengan menyerap y elektron. Elektron yang diserap itu mengisi orbital dengan tingkat energi terendah yang belum penuh.
17Cl = (Ne) 3s2 3p5
17Cl- = (Ne) 3s2 3p6
Bentuk Orbital
1) Orbital s
Bentuknya berupa bola simetris dan hanya memiliki 1 macam orbital. Semakin besar nilai n , maka ukurannya juga semakin besar.

2) Orbital p
Orbital ini berjumlah 3 buah yang terletak di subkulit p. Ketiganya mempunyai tingkat energi yang sama, namun arah ruang/orientasinya berbeda (meliputi = px, py dan pz). Setiap orbital berbentuk seperti balon terpilin yang digambarkan menggunakan koordinat Cartesius dengan sumbu x, y dan z.
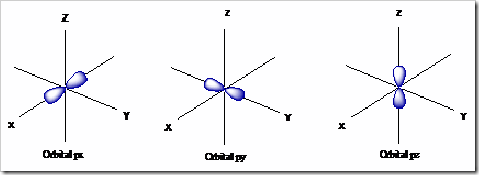
3) Orbital d
Orbital ini terletak di subkulit d dan terdiri dari 5 macam ( meliputi = dxy, dxz, dyz, dx2 – y2, dz2 ). Bentuk orbital ini dapat digambarkan sebagai 4 buah balon terpilin pada koordinat Cartesius.
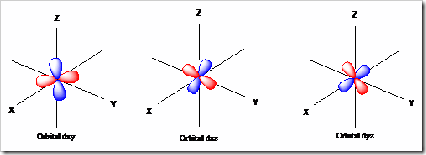
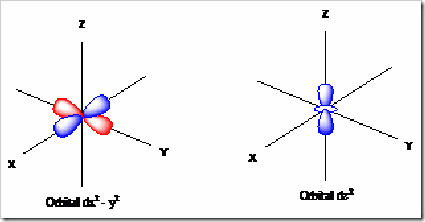
Keterangan :
Orbital dxy = cuping-cupingnya terletak di antara sumbu x dan y
Orbital dxz = cuping-cupingnya terletak di antara sumbu x dan z
Orbital dyz = cuping-cupingnya terletak di antara sumbu y dan z
Orbital dx2 – y2 = cuping-cupingnya terletak pada sumbu x dan y
Orbital dz2 = terdiri dari 1 balon terpilin yang terletak pada sumbu z dan 1 daerah
berbentuk donat yang terletak pada bidang xy


















No comments:
Post a Comment