SENYAWA HIDROKARBON
Disebut Hidrokarbon : mengandung unsur C dan H
Terdiri dari : 1. Alkana (CnH2n+2)
2. Alkena (CnH2n)
3. Alkuna (CnH2n-2)
ALKANA
q
Hidrokarbon jenuh (alkana rantai lurus dan
siklo/cincin alkana)
q
Disebut golongan parafin : affinitas kecil
(=sedikit gaya gabung)
q
Sukar bereaksi
q
C1 – C4 : pada t dan p normal adalah gas
q
C4 – C17 : pada t dan p normal adalah cair
q
> C18 : pada t dan p
normal adalah padat
q
Titik didih makin tinggi : terhadap penambahan
unsur C
q
Jumlah atom C sama : yang bercabang mempunyai TD
rendah
q
Kelarutan : mudah larut dalam pelarut non polar
q
BJ naik dengan penambahan jumlah unsur C
q
Sumber utama gas alam dan petrolium
Struktur ALKANA : CnH2n+2 CH3-CH2-CH2-CH2-CH2-CH3
(heksana)
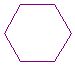 |
sikloheksana
PEMBUATAN ALKANA :
Ø
Hidrogenasi senyawa Alkena
Ø
Reduksi Alkil Halida
Ø
Reduksi metal dan asam
PENGGUNAAN ALKANA :
ä Metana
: zat bakar, sintesis, dan carbon black (tinta,cat,semir,ban)
ä Propana,
Butana, Isobutana : zat bakar LPG (Liquified Petrolium Gases)
ä Pentana,
Heksana, Heptana : sebagai pelarut pada sintesis
Fraksi tertentu dari Destilasi langsung Minyak
Bumi/mentah
|
TD
(oC)
|
Jumlah C |
Nama
|
Penggunaan
|
|
<
30
|
1
- 4
|
Fraksi gas
|
Bahab bakar gas
|
|
30
- 180
|
5
-10
|
Bensin
|
Bahan bakar mobil
|
|
180
- 230
|
11
- 12
|
Minyak tanah
|
Bahan bakar memasak
|
|
230
- 305
|
13
- 17
|
Minyak gas ringan
|
Bahan bakar diesel
|
|
305
- 405
|
18
- 25
|
Minyak gas berat
|
Bahan bakar pemanas
|
Sisa destilasi :
1.
Minyak mudah menguap, minyak pelumas, lilin dan
vaselin
2.
Bahan yang tidak mudah menguap, aspal dan kokas
dari m. bumi
ALKENA
q
Hidrokarbon tak jenuh ikatan rangkap dua
q
Alkena = olefin (pembentuk minyak)
q
Sifat fisiologis lebih aktif (sbg obat tidur) :
2-metil-2-butena
q
Sifat sama dengan Alkana, tapi lebih reaktif
STRUKTUR ALKENA : CnH2n CH3-CH2-CH=CH2
(1-butena)
ETENA = ETILENA = CH2=CH2
q
Sifat-sifat : gas tak berwarna, dapat dibakar, bau
yang khas, eksplosif dalam udara (pada konsentrasi 3 – 34 %)
q
Terdapat dalam gas batu bara biasa pada proses
“cracking”
q
Pembuatan : pengawahidratan etanaol
PENGGUNAAN ETENA :
ä Dapat
digunakan sebagai obat bius (dicampur dengan O2)
ä Untuk
memasakkan buah-buahan
ä Sintesis
zat lain (gas alam, minyak bumi, etanol)
PEMBUATAN ALKENA :
Ø
Dehidrohalogenasi alkil halida
Ø
Dehidrasi alkohol
Ø
Dehalogenasi dihalida
Ø
Reduksi alkuna
ALKUNA
q
Hidrokarbon tak jenuh mempunyai ikatan rangkap tiga
q
Sifat-sifatnya menyerupai alkena, tetapi lebih reaktif
Struktur ALKUNA : CnH2n-2 CH=CH (etuna/asetilen)
ETUNA = ASETILEN => CH=CH
q
Pembuatan : CaC2 + H2O ------à C2H2
+ Ca(OH)2
q
Sifat-sifat :
Ø Suatu
senyawaan endoterm, maka mudah meledak
Ø Suatu
gas, tak berwarna, baunya khas
q
Penggunaan etuna :
Ø
Pada pengelasan : dibakar dengan O2
memberi suhu yang tinggi (+- 3000oC), dipakai untuk mengelas besi
dan baja
Ø
Untuk penerangan
Ø
Untuk sintesis senyawa lain
PEMBUATAN ALKUNA
Ø
Dehidrohalogenasi alkil halida
Ø
Reaksi metal asetilida dengan alkil halida primer
SENYAWA
AROMATIK
q
Senyawa alifatis : turunan metana
q
Senyawa aromatis : turunan benzen (simbol Ar =
aril)
q
Permulaan abad ke-19 ditemukan senyawa-senyawa
organik yang mempunyai bau (aroma) yang karakteristik yang berasal dari tumbuh-tumbuhan
(damar benzoin, cumarin, asam sinamat dll)
BENZEN =C6H6
q
Senyawa aromatis yang paling sederhana
q
Berasal dari batu bara dan minyak bumi
q
Sifat fisika : cairan, td. 80oC, tak berwarna, tak
larut dalam air, larut dalam kebanyakan pelarut organik, mudah terbakar dengan
nyala yang berjelaga dan berwarna (karena kadar C tinggi)
Pengunaan Benzen :
Ø
Dahulu sebagai bahan bakar motor
Ø
Pelarut untuk banyak zat
Ø
Sintesis : stirena, fenol, nilon, anilin, isopropil
benzen, detergen, insektisida, anhidrida asam maleat, dsb
ALKIL
HALIDA
q
Senyawa alkil halida merupakan senyawa hidrokarbon
baik jenuh maupun tak jenuh yang satu unsur H-nya atau lebih digantikan oleh
unsur halogen (X = Br, Cl. I)
q
Alkil halida = haloalkana = RX struktur primer, sekunder, tersier
q
Aril halida = ArX = senyawa halogen organik
aromatik
Sifat fisika Alkil Halida :
¨
Mempunyai TD lebih tinggi dari pada TD Alkana
dengan jumlah unsur C yang sama.
¨
Tidak larut dalam air, tapi larut dalam pelarut
organik tertentu.
¨
Senyawa-senyawa bromo, iodo dan polikloro lebih
berat dari pada air.
Struktur Alkil Halida :
R-X (X=Br, Cl, I)
CH3-CH2-CH2-CH2-Cl (CH3)2CH-Br (CH3)3C-Br
Primer sekunder tersier
 |
Benzil
khlorida Vinil
khlorida
PEMBUATAN ALKIL HALIDA :
Ø
Dari alkohol
Ø
Halogenasi
Ø
Adisi hidrogen halida dari alkena
Ø
Adisi halogen dari alkena dan alkuna
PENGGUNAAN ALKIL HALIDA :
ä Kloroform
(CHCl3) : pelarut untuk lemak, obat bius (dibubuhi etanol, disimpan
dalam botol coklat, diisi sampai penuh).
ä Tetraklorometana
= karbontetraklorida (CCl4) : pelarut untuk lemak, alat pemadam
kebakaran (Pyrene, TD rendah 77oC, uapnya berat.
ä Freon
(Freon 12 = CCl2F2, Freon 22 = CHCl2F) :
pendingin lemari es, alat “air conditioner”, sebagai propellant (penyebar)
kosmetik, insektisida, dsb.
ALKOHOL
q
Alkohol : tersusun dari unsur C, H, dan O
q
Struktur alkohol : R-OH primer, sekunder dan
tersier
Sifat fisika alkohol :
·
TD alkohol > TD alkena dengan jumlah unsur C
yang sama (etanol = 78oC,
etena = -88,6oC)
·
Umumnya membentuk ikatan hidrogen
R R
·
Berat jenis alkohol > BJ alkena
·
Alkohol rantai pendek (metanol, etanol) larut dalam
air (=polar)
Struktur Alkohol : R - OH
R-CH2-OH (R)2CH-OH (R)3C-OH
Primer sekunder tersier
PEMBUATAN ALKOHOL :
Ø
Oksi mercurasi – demercurasi
Ø
Hidroborasi – oksidasi
Ø
Sintesis Grignard
Ø
Hidrolisis alkil halida
PENGGUNAAN ALKOHOL :
ä Metanol
: pelarut, antifreeze radiator mobil, sintesis
formaldehid,metilamina,metilklorida,metilsalisilat, dll
ä Etanol
: minuman beralkohol, larutan 70 % sebagai antiseptik, sebagai pengawet, dan
sintesis eter, koloroform, dll
FENOL
q
Fenol : mengandung gugus benzen dan hidroksi
q

 Mempunyai
sifat asam
Mempunyai
sifat asam
 Mempunyai
sifat asam
Mempunyai
sifat asam
q
 Mudah
dioksidasi struktur OH
Mudah
dioksidasi struktur OH
q
Mempunyai sifat antiseptik
q
Penggunaan sbg antiseptikum dan sintesis
ETER
q
Eter : isomer atau turunan dari alkohol (unsur H
pada OH diganti oleh alkil atau aril)
q
Eter : mengandung unsur C, H, dan O
Sifat fisika eter :
·
Senyawa eter rantai C pendek berupa cair pada suhu
kamar dan TD nya naik dengan penambahan unsur C.
·
Eter rantai C pendek medah larut dalam air, eter
dengan rantai panjang sulit larut dalam air dan larut dalam pelarut organik.
·
Mudah terbakar
·
Unsur C yang sama TD eter > TD alkana dan <
TD alkohol (metil, n-pentil eter 100oC, n-heptana 98oC,
heksil alkohol 157oC).
Struktur eter : R – O – R CH3-CH2-O-CH2-CH3 (dietil eter)
CH3-CH2-O-C6H5 (fenil etil eter)
PEMBUATAN ETER :
Ø
Sintesis Williamson
Ø
Alkoksi mercurasi – demercurasi
PENGGUNAAN ETER :
ä
Dietil eter : sbg obat bius umum, pelarut dari
minyak, dsb.
ä
Eter-eter tak jenuh : pada opersi singkat : ilmu
kedokteran gigi dan ilmu kebidanan.
AMINA
q
Senyawa organik bersifat basa lemah, dibanding air
lebih basa.
q
Jumlah unsur C kecil sangat mudah larut dalam air.
Sifat fisika Amina :
·
Suku-suku rendah berbentuk gas.
·
Tak berwarna, berbau amoniak, berbau ikan.
·
Mudah larut dalam air
·
Amina yang lebih tinggi berbentuk cair/padat.
·
Kelarutan dalam air berkurang dengan naiknya BM.
Struktur amina : R-NH2, (R)2NH, (R)3N =primer,
sekunder, tersier
CH3-CH2-CH2-CH2-NH2 (CH3)2NH (CH3)3N
Primer sekunder tersier
Struktur Amina berdasarkan rantai gugus alkil/aril
:
·
Amina aromatis
·
Amina alifatis
·
Amina siklis
·
Amina campuran
PEMBUATAN AMINA :
Ø
Reduksi senyawa nitro
Ø
Reaksi alkil halida dengan amonia dan amina
PENGGUNAAN AMINA :
ä
Sebagai katalisator
ä
Dimetil amina : pelarut, absorben gas alam,
pencepat vulkanisasi, membuat sabun, dll.
ä
Trimetil amina : suatu penarik serangga.
ALDEHID
q
Aldehid adalah suatu senyawa yang mengandung gugus
karbonil (C=O) yang terikat pada sebuah atau dua buah unsur hidrogen.
q
Aldehid berasal dari “ alkohol dehidrogenatum “ (cara sintesisnya).
q
Sifat-sifat kimia aldehid dan keton umumnya serupa,
hanya berbeda dalam derajatnya. Unsur C kecil larut dalam air (berkurang + C).
q
Merupakan senyawa polar, TD aldehid > senyawa
non polar
q
Sifat fisika formaldehid : suatu gas yang baunya
sangat merangsang
q
Akrolein = propanal = CH2=CH-CHO :
cairan, baunya tajam, sangat reaktif.
FORMALDEHID = METANAL = H-CHO
¨
Sifat-sifat : satu-satunya aldehid yang berbentuk
gas pada suhu kamar, tak berwarna, baunya tajam, larutanya dalam H2O
dari 40 % disebut formalin.
¨
Penggunaan : sebagai desinfektans, mengeraskan
protein (mengawetkan contoh-contoh biologik), membuat damar buatan.
Struktur Aldehid : R – CHO
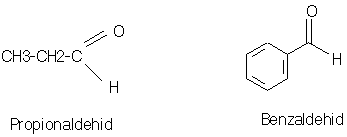
PEMBUATAN ALDEHID :
Ø
Oksidasi dari alkohol primer
Ø
Oksidasi dari metilbenzen
Ø
Reduksi dari asam klorida
KETON
q
Keton adalah suatu senyawa organik yang mempunyai
sebuah gugus karbonil (C=O) terikat pada dua gugus alkil, dua gugus aril atau
sebuah alkil dan sebuah aril.
q
Sifat-sifat sama dengan aldehid.
PROPANON = DIMETIL KETON = ASETON = (CH3)2-C=O
¨
Sifat : cairan tak berwarna, mudah menguap, pelarut
yang baik.
¨
Penggunaan : sebagai pelarut
ASETOFENON = METIL FENIL KETON
¨
Sifat : berhablur, tak berwarna
¨
Penggunaan : sebagai hipnotik, sebagai fenasil
klorida (kloroasetofenon) dipakai sebagai gas air mata
Struktur : (R)2-C=O
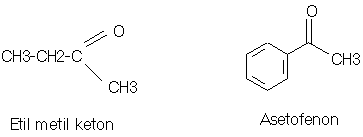
PEMBUATAN KETON
Ø
Oksidasi dari alkohol sekunder
Ø
Asilasi Friedel-Craft
Ø
Reaksi asam klorida dengan organologam
ASAM
KARBOKSILAT
q
Mengandung gugus COOH yang terikat pada gugus alkil
(R-COOH) maupun gugus aril (Ar-COOH)
q
Kelarutan sama dengan alkohol
q
Asam dengan jumlah C 1 – 4 : larut dalam air
q
Asam dengan jumlah C = 5 : sukar larut dalam air
q
Asam dengan jumlah C > 6 : tidak larut dalam air
q
Larut dalam pelarut organik seperti eter, alkohol,
dan benzen
q
TD asam karboksilat > TD alkohol dengan jumlah C
sama.
Struktur
Asam Karboksilat : R – COOH dan Ar – COOH
 |
Valelat
CH3-COOH (asam asetat) Asam benzoat
ASAM FORMAT = HCOOH
¨
Sifat fisika : cairan, tak berwarna, merusak kulit,
berbau tajam, larut dalam H2O dengan sempurna.
¨
Penggunaan : untuk koagulasi lateks, penyamakkan
kulit, industri tekstil, dan fungisida.
ASAM ASETAT = CH3-COOH
¨
Sifat : cair, TL 17oC, TD 118oC,
larut dalam H2O dengan sempurna
¨
Penggunaan : sintesis anhidrat asam asetat, ester,
garam, zat warna, zat wangi, bahan farmasi, plastik, serat buatan, selulosa dan
sebagai penambah makanan.
PEMBUATAN ASAM KARBOKSILAT
Ø
Oksidasi alkohol primer
Ø
Oksidasi alkil benzen
Ø
Carbonasi Reagen Grignard
Ø
Hidrolisin nitril
AMIDA
q
Amida adalah turunan asam karboksilat, dimana gugus
–OH digan-ti dengan –NH2 atau amoniak, dimana 1 H diganti dengan
asil.
q
Sifat fisika : zat padat kecuali formamida yang
berbentuk cair, tak berwarna, suku-suku yang rendah larut dalam air, bereaksi
kira-kira netral.
Struktur Amida : R – CONH2
PEMBUATAN AMIDA :
Ø
Reaksi asam karboksilat dengan amoniak
Ø
Garam amoniumamida dipanaskan
Ø
Reaksi anhidrid asam dengan amponiak
PENGGUNAAN AMIDA :
ä
Formamida berbentuk cair, sebagai pelarut.
ä
Untuk identifikasi asam yang berbentuk cair.
ä
Untuk sintesis nilon, ds.
ESTER
q
Ester adalah turunan asam karboksilat, dimana gugus
H pada –OH diganti dengan gugus R.
q
Sifat fisika : berbentuk cair atau padat, tak
berwarna, sedikit larut dalm H2O, kebanyakan mempunyai bau yang khas
dan banyak terdapat di alam.
Struktut ester : R – COOR
PEMBUATAN ESTER :
Ø
Reaksi alkohol dan asam karboksilat
Ø
Reaksi asam klorida atau anhidrida
PENGGUNAAN ESTER :
ä
Sebagai pelarut, butil asetat (pelarut dalam
industri cat).
ä
Sebagai zat wangi dan sari wangi.








No comments:
Post a Comment