NITROGEN
Nitrogen adalah
unsur nonlogam dalam tabel periodik terletak pada golongan VA atau
golongan 15 dan memiliki lambang N dengan nomor atom 7. Pada suhu kamar
berupa gas tidak berwarna, tidak berbau, tanpa rasa dan berupa unsur
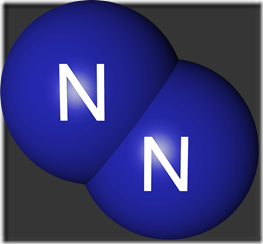
diatomik (N2). Nitrogen yang telah dicairkan juga tidak berwarna dan tidak berbau.
Gambar Rumus Molekul nitrogen dan nitrogen cait
Nitrogen sangat
sulit bereaksi dengan unsur atau senyawa lainnya sehingga disebut juga
dengan nama zat lemas. Nitrogen merupakan gas yang paling banyak di
atmosfer sekitar 78%. Selain di atmosfer, nitrogen juga terdapat di
planet mars (3%).
Ikatan kimia
antara dua atom dalam molekul nitrogen adalah ikatan terkuat antara dua
atom dari unsur yang sama. Hal ini membuat gas N2 sangat
stabil dan inert. Dalam jaringan tubuh makluk hidup, sebagian mengandung
nitrogen, misalnya dalam protein dan asam nukleat menjadi salah satu
komponen pembentuk DNA dan RNA.
Terdapat 2 isotop nitrogen yang stabil yaitu: 14N dan 15N. Isotop yang paling banyak adalah 14N (99.634%), yang dihasilkan dalam bintang-bintang dan yang selebihnya adalah 15N.
Dalam industri
nitrogen diperoleh dari pencairan udara dengan memberi tekanan yang
cukup tinggi, kemudian dilanjutkan dengan destilasi fraksional atau
destilasi fraksinasi.
Ketika nitrogen dipanaskan, dapat bereaksi secara langsung dengan magnesium, lithium dan kalsium.
6 Li + N2 → 2 Li3N
3Mg + N2 → Mg3N2
Ketika dicampur dengan oksigen dan dikenakan bunga api listrik, membentuk oksida nitrat (NO) kemudian menjadi dioksida (NO2). Bila dipanaskan di bawah tekanan dengan hidrogen dan adanya katalis yang cocok akan terbentuk amonia (proses Haber).
Senyawa
nitrogen yang banyak dimanfaatkan dalam dunia industri maupun dalam
laboratorium yaitu asam nitrat dan amonia (paling banyak dalam
industri). Amonia, NH3 merupakan hidrida nitrogen yang
beracun dan merupakan bahan dasar paling penting untuk kimia nitrogen
dan merupakan salah satu bahan kimia yang paling banyak diproduksi di
dunia. Amonia digunakan sebagai bahan dasar pupuk nitrogen seperti urea
dan bahan peledak.
PREPARASI NITROGEN DALAM LABORATORIUM
Di
laboratorium, nitrogen dipersiapkan dengan memanaskan campuran amonium
klorida dan natrium nitrit dan sedikit air. Jika amonium nitrit
dipanaskan akan terurai menghasilkan gas nitrogen. Namun, reaksi ini
sangat cepat dan mungkin eksplosif.
Untuk keamanan,
campukan amonium klorida dan natrium nitrit dengan perbandingan massa
4:5, kemudian dipanaskan dengan sedikit air. Keberadaan air mencegah
amonium klorida mensublimasi ketika dipanaskan. Awalnya, dua zat
mengalami penguraian ganda untuk membentuk natrium klorida dan amonium
nitrit.
Amonium nitrit yang terbentuk kemudian terurai menjadi gas nitrogen dan air.
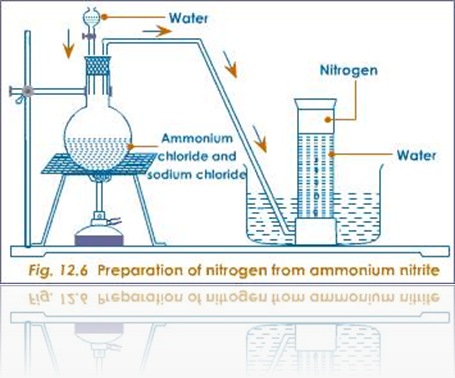
Gas nitrogen
yang terbentuk kemudia dialirkan melalui air seperti pada gambar. Dengan
cara ini maka uap air akan tertinggal sedangkan gas nitrogen terus ke
atas karena kelarutannya yang rendah dalam air.
ASAM NITRAT
Asam nitrat adalah asam kuat yang bersifat korosif dan beracun dan terurai menjadi ion H+ dan ion NO3- dalam air, persamaan reaksinya.
Asam nitrat biasa memiliki konsentrasi 68%. Larutan HNO3
dengan konsentrasi diatas 86% disebut sebagai asam nitrat berasap. Asam
nitrat murni merupakan suatu cairan tidak berwarna yang dapat berubah
menjadi merah kekuningan karena adanya oksida nitrogen terlarut dan
berwarna merah pada suhu tinggi. HNO3 menjadi padatan putih berwarna pada suhu dibawah -41°C dan mendidih pada 83°C.
Asam nitrat
merupakan oksidator yang kuat sehingga penanganannya harus berhati-hati.
Bila mengenai anggota tubuh segera dicuci dengan air yang mengalir.
Gambar Asam nitrat murni yang berwarna kekuningan karena adanya oksida nitrogen terlarut dan asam nitrat 70% yang tidak berwarna
Air Raja
Campuran antara asam klorida pekat dan asam nitrat pekat dengan perbandingan 3:1 (misalnya 3 mL HCl dengan 1 mL HNO3 atau 3L HCl dengan 1 L HNO3) disebut aqua regia atau air raja
karena dapat melarutkan logam mulia seperti emas dan platina. Aqua
regia sangat tidak stabil, oleh sebab itu aqua regia baru dibuat ketika
akan digunakan.
Sifa-sifat asam nitrat
Asam nitrat
merupakan oksidator yang kuat yang mudah melepaskan oksigen sehingga
penyimpanannya harus ditempat tersendiri dan hindari bahan-bahan organik
yang umumnya mudah terbakar. Dalam reaksi kimia bila konsentrasi
tinggi, HNO3 tereduksi menjadi NO2 sedangkan pada konsentrasi rendah tereduksi menjadi NO.
Pemanasan HNO3 akan terurai menghasilkan NO2.
Reaksi asam nitrat dengan nonlogam dan logam
Menjadi agen
oksidasi yang kuat, asam nitrat bereaksi hebat dengan banyak non-logam,
logam, senyawa dan reaksi mungkin berlangsung eksplosif. Kecuali emas
dan platina, HNO3 hampir bereaksi dengan semua unsur logam.
Produk yang
terbentuk tergantung pada sifat logam (kereaktifan logam), konsentrasi
asam dan suhu. Reaksinya dengan logam yang kurang reaktif hasil
reduksinya berupa gas NO sedangkan bila digunakan HNO3 pekat hasil reduksinya gas NO2. Beberapa contoh reaksi asam nitrat sebagai berikut.
Reaksi karbon dengan asam nitrat
C + 4HNO3 → CO2 + 4NO2 + 2H2O
3C + 4HNO3 → 3 CO2 + 4NO + 2H2O
Reaksi belerang dan iod dengan asam nitrat
S(s) + 2HNO3(aq) → H2SO4(aq) + 2NO(g) (HNO3 pekat dingin)
3I2(s) + 10HNO3(aq) → HIO3(aq) + 2H2O(l) + 10NO(g) (HNO3 pekat panas)
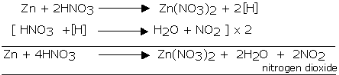
Reaksi seng dengan asam nitrat
Reaksi magnesium dengan asam nitrat
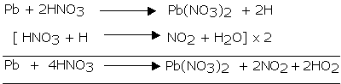
Reaksi timbal dengan asam nitrat
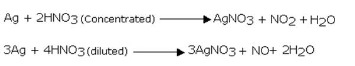
Reaksi perak dengan asam nitrat
Trinitro Toluena (TNT)
Campuran asam
nitrat pekat dan asam sulfat pekat bila direaksikan dengan toluena akan
diperoleh suatu senyawa yang disebut trinitro Toluena (TNT). Trinitro
toluena merupakan suatu senyawa yang sangat ekplosif.
Sumber :
Tutorvista.com
Wikipedia.org
webelements.com






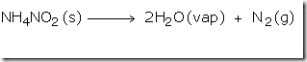






No comments:
Post a Comment