Alkohol merupakan suatu senyawa organik organik yang tersusun dari atom C, H dan O dengan rumus umum C
nH
2n+1OH.
Ciri khas alkohol yaitu terdapatnya gugus –OH pada rantai karbon.
Rantai karbon dapat berupa gugus alkil jenuh maupun tidak jenuh, gugus
alkil tersubtitusi dan dapat pula terikat pada rantai siklik. Selain
alkohol dengan satu gugus –OH dikenal pula alkohol yang memiliki gugus
–OH lebih dari satu. Alkohol yang memiliki satu gugus –OH disebut
alkohol monohodroksi, alkohol dengan dua gugus –OH disebut alkohol
dihidroksi dan seterusnya.
Berdasarkan atom karbon yang mengikat gugs –OH alkohol dikelompokan menjadi:
a. Alkohol primer, yaitu alkohol yang gugus –OH terikat pada C primer

b. Alkohol sekunder, yairu alkohol yang gugus –OH terikat pada C sekunder

c. Alkohol tersier, yaitu alkohol yang gugus –OH terikat pada C tersier
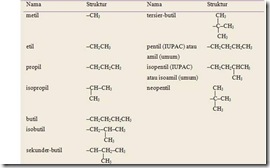
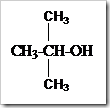 Tata Nama Alkohol
Tata Nama Alkohol
Tata nama IUPAC
1) Tata nama alkohol tidak begitu berbeda dengan pemberian nama pada
alkana. Perbedaannya yaitu akhiran –a pada alkana terkait diganti dengan
akhiran –ol.
2) Pemberian nomor pada atom karbon dimulai dari atom karbon yang paling dekat dengan gugus –OH.
Contoh
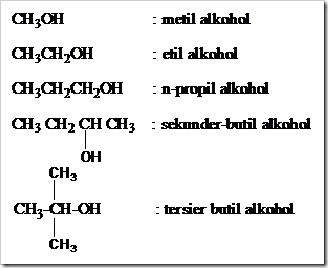
 Tata Nama Trivial
Tata Nama Trivial
Tata nama trivial atau nama umum hanya berlaku
untuk alkohol-alkohol suku rendah atau alkohol-alkohol dengan rumus
molekul sederhana. Tata nama trivial untuk alkohol yaitu dengan menyebut
nama gugus alkil yang mengikat gugus –OH kemudian diikuti dengan kata
alkohol.
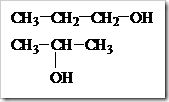
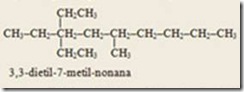
 Isomer dan Sifat Alkohol
Isomer dan Sifat Alkohol
Senyawa-senyawa alkohol dengan jumlah atom karbon yang sama dapat mengalami isomer. Pada alkohol terjadi
isomer posisi, yaitu
alkohol dengan jumlah atom karbon sama tetapi letak gugus –OH dalam
struktur berbeda. Misalnya alkohol dengan rumus molekul C
3H
8O dapat ditulis dengan dua rumus struktur
Kelarutan alkohol dalam air dipengaruhi oleh
jumlah atom karbon yang terdapat pada alkohol. Alkohol dengan 1-3 atom
karbon meruapakan cairan tak berwarna dan dapat larut dalam air dengan
segala perbandingan, 4-5 atom karbon sedikit larut dalam air sedangkan
alkohol dengan jumlah atom karbon > 6 tidak larut dalam air.
Berdasarkan struktur yang dimiliki, alkohol
merupakan gabungan antara alkana atau gugus R dan air. Gugus R bersifat
nonpolar atau lipofilik, gugus –OH bersifat polar atau hidrofobik,
ketika alkohol dengan jumlah atom karbon sedikit ketika dilarutkan dalam
air maka gugus –OH dapat membentuk ikatan hidrogen dengan molekul air.
Namun ketika jumlah atom karbon makin banyak maka sifat nonpolar dari
gugus R atau alkana lebih dominan sehingga kelarutan dalam air berkurang
bahkan tidak larut ketika jumlah atom karbon makin banyak.
Makin tinggi berat molekul maka makin tinggi
pula titik didih dan viskositasnya. Titik didih alkohol lebih tinggi
dari alkana yang berat molekulnya hampir sama karena terbentuk ikatan
hidrogen dengan sesama molekul alkohol. Pada alkana tidak terbentuk
ikatan hidrogen antar sesama molekul.
Titik didih alkohol titik didh alkohol primer
> alkohol sekunder > tersier. Pada alkohol-alkohol bercabang
memiliki titik didih lebih rendah dari alkohol dengan dengan rantai
lurus. Dengan ketentuan memiliki berat molekul yang hampir sama atau
dengan jumlah atom karbon sama. Hal ini disebabkaa alkohol-alkohol
bercabang bentuk molekulnya menyerupai bola.
Fungsi Alkohol
Berikut beberapa fungsi alkohol secara umum
a) Sebagai bahan dasar sintesis senyawa organik
b) Sebagai pelarut
c) Sebagai bahan dasar pembuatan deterjen sintetik misalnya lauril alkohol.
d) Sebagai bahan pembersih kaca
e) Untuk hewan-hewan koleksi yang berukuran kecil alkohol dapat dijadikan sebagai pengawet.
f) Campuran metanol dan etanol sering dicampurkan dengan bensin sebagai bahan bakar.
Reaksi-Reaksi pada Alkohol
Gugus –OH merupakan gugus fungsi
dari alkohol oleh sebab itu sebagian besar reaksi terjadi pada gugus
tersebut. Berikut merupakan beberapa reaksi yang terjadi pada alkohol:
reaksi oksidasi, penggantian gugus –OH, penggantian atom H pada gugus
–OH oleh gugus asam, logam aktif dan gugus alkil.
Oksidasi
Alkohol dengan oksidator kuat seperti NA
2Cr
2O
7 + H
2SO
4
dapat mengalami reaksi oksidasi. Hasil yang diperoleh dari reaksi
oksidasi berbeda-beda tergantung pada jenis alkoholnya. Akohol primer
jika teroksidasi menghasilkan aldehida apabila jumlah oksidator masih
berlebih akan terjadi oksidasi berlanjut memebntuk asam karboksilat,
alkohol sekunder menghasilkan keton sedangkan alkohol tersier
menghasilkan campuran asam karboksilat dan keton. Reaksi antara alkohol
primer, sekunder dan tersier dengan NA
2Cr
2O
7 + H
2SO
4 dapat dilihat pada contoh.
 Penggantian Gugus –OH
Penggantian Gugus –OH
Gugus –OH pada alkohol dapat digantikan oleh
atom-atom halogen apabila direaksikan dengan fosfor halida dan asam
halida. Fosfor halida dapat berupa PX
3 dan PX
5 sedangkan asam halogen berupa HX.
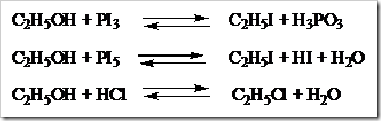
laju reaksi alkohol dengan asam halogen adalah alkohol tersier > alkohol sekunder > alkohol primer.
Penggantian Atom H pada Gugus –OH oleh Gugus Asam, Logam Aktif dan Gugus Alkil

Reaksi diatas merupakan reaksi antara alkohol
primer dan asam karboksilat. Bila dipanaskan dengan penambahan sedikit
asam sulfat pekat maka akan terbentuk sebuah
ester dan H
2O. H
2O
yang diperoleh dari reaksi diatas dibentuk dari H dari alkohol dan OH
dari asam asetat. Apabila digunakan alkohol tersier H diperoleh dari
asam asetat dan OH dari alkohol.
Apabila alkohol direaksikan dengan asam-asam
anorganik produk yang diperoleh berupa ester anorganik. Produk yang
diperoleh dari reaksi antara etanol dengan asam sulfat berupa etil
hidrogen sulfat dan air, sedangkan produk yang diperoleh dari reaksi
antara etanol dengan asam nitrit berupa etil nitrit dan air.

Atom H pada gugus –OH dapat digantikan oleh
logam aktif seperti Na. Reaksi antara alkohol dan Na menghasilkan garam
natrium alkoksida dan pembebasan gas hidrogen. Garam yang diperoleh dari
reaksi ini apabila dihidrolisis akan diperoleh kembali alkohol asalnya.
Laju pergantian atom H oleh logam aktif yaitu alkohol primer >
alkohol sekunder > alkohol tersier.
Setelah pergantian atom H oleh logam aktif
apabila direaksikan lagi dengan alkil halida akan terjadi pergantian
logam aktif oleh gugus alkil. Logam aktif yang didesak keluar akan
bereaksi dengan halogen dari alkil halida membentuk garam.
 Beberapa Alkohol dalam Kehidupan Sehari-Hari
Metanol
Beberapa Alkohol dalam Kehidupan Sehari-Hari
Metanol
Metanol atau metil alkohol merupakan suku pertama dari alkohol dengan rumus molekul CH
3OH.
Metanol bersifat toksit karena dapat menyebabkan kematian dan kebutaan
apabila terkena mata. Metanol berupa zat cair tidak berwarna dengan
titik didih 64.7 °C, massa jeni 0.7918 g/cm³,, mudah larut dalam air,
mudah menguap dengan bau seperti alkohol biasa dan mudah terbakar.
Spritus merupakan campuran antara metanol dan etanol. Warna pada etanol merupakan zat tambahan agar tidak diminum.
Matanol yang diproduksi sebagian besar digunakan
sebagai bahan dasar pembuatan pembuatan formaldehit. Metanol sering
dicampurkan dengan bensin, karena campuran ini diduga dapat meningkatkan
mutu bensin. Namun demikian metanol yang ditambahkan memiliki kelemahan
karena dapat menyebabkan
korosi terhadap beberapa logam, termasuk
aluminium. Berikut reaksi yang terjadi pada pembakaran metanol:

Metanol awalnya diperoleh dari penyulingan kering dari
kayu. Kini metanol diperoleh dengan mereaksikan karbonmonoksida dengan
hidrogen, dengan katalis ZnO + Cu. Campuran antara gas CO dan H
2 dipanaskan dengan suhu sekitar 450 ºC dengan tekanan 200 atm.
 Etanol
Etanol
Etanol merupakan salah satu jenis
alkohol yang dikonsumsi dan memiliki titik didih dan titik leleh
berturut-turut 78 ºC dan 114 ºC. Etanol memiliki rumus molekul C
2H
5OH dan sering disingkat menjadi EtOH
. Anggur,
wiskey dan bir merupakan minuman keras yang mengandung etanol dengan
konsentrasi tertentu. Etanol merupakan cairan yang jernih tidak
berwarna, terasa membakar pada mulut maupun tenggorokan bila ditelan.
Beberapa jenis minuman yang mengandung alkohol adalah sebagai berikut :
- Golongan A : kadar etanol 1% – 5% (bir)
- Golongan B : kadar etanol 5% – 20% (wine)
- Golongan C : kadar etanol 20% – 45% (whiskey, vodka, manson house, johny walker, kamput)
Minuman-minuman seperti anggur dan bir
telah dikenal dikenal sejak zaman prasejarah. Pada zaman itu
munuman-minuman tersebut diperoleh dari proses peragian atau fermentasi
terhadap bahan-bahan yang mengandung pati atau gula. Bahan sebagai
sumber pati dapat berupa kentang, ubi kayu dan beras. Umumnya
bahan-bahan yang mengandung pati dapat diolah menjadi alkohol dengan
proses peragian atau fermentasi. Awalnya bahan yang mengandung pati
direndam dengan air sehingga terbentuk enzim amilase. Enzim amilase yang
terbentuk secara bertahap menguraikan pati menjadi glukosa. Dengan
bantuan enzim zimase yang terdapat di dalam ragi, glukosa yang terbentuk
diuraikan menjadi etanol dan karbondioksida.

Proses fermentasi dilangsungkan pada suhu 25
ºC. Pada suhu rendah proses peragian berjalan lambat sedangkan pada suhu
tinggi ragi yang ditambahkan akan terbunuh. Konsentrasi etanol yang
diperoleh dari proses fermentasi maksimal 10-15%. Hal ini disebabkan
pada konsentrasi lebih tinggi sel-sel ragi terbunuh sehingga proses
penguraian glukosa terhenti.
Untuk meningkatkan kadar alkohol yang diperoleh
dari proses fermentasi dilakukan dengan destilasi fraksional. Titik
didih etanol 78 ºC dan titik didih air 100 ºC. Dari proses destilasi
fraksional walaupun konsentrasi etanol sangat tinggi namun tidak
diperoleh
etanol absolut. Etanol absolut yaitu etanol dengan konsentrasi 100%. Hal ini disebabkan etanol dan air membentuk suatu campuran
azeotropik sehingga hanya diperolehn etanol dengan kemurnian 96%
.
Campuran azeotropik yaitu campuran yang memiliki titik didih sama.
Untuk memperoleh etanol absolut perlu dilakukan dengan cara kimia, yaitu
dengan menambahkan CaO atau Mg(OCH
3)
2 sebagai penarik air.
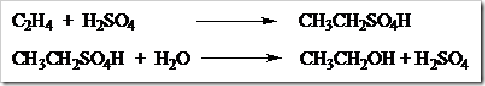
Selain dengan cara fermentasi etanol dapat pula diproduksi hidrasi etilena menggunakan katalis
asam fosfat pada suhu 300 ºC.

Selain cara di atas dapat pula digunakan proses hidrasi secara tidak langsung etilena dengan H
2SO
4 pekat. Produk hidrasi yang diperoleh hidrolisis sehingga diperoleh etanol.
 Alkohol Dihidroksi
Alkohol Dihidroksi
Alkohol dihidroksi merupakan alkohol
yang di dalam molekulnya terdapat 2 buah gugs –OH. Alkohol-alkohol yang
memiliki dua buah gugus –OH disebut
glikol. Salah satu contoh alkohol dihidroksi yaitu etilena glikol. Berikut rumus struktur etilena glikol:

Etilena glikol merupakan cairan tidak berwarna yang memiliki rasa manis. Alkohol bersifat dan larut dengan baik di dalam air.
Alkohol Trihidroksi
Alkohol trihidroksi merupakan alkohol yang didalam
molekulnya terdapat 3 buah gugus –OH. Gliserol atau 1,2,3-propananatriol
merupakan salah satu contoh terpenting dari alkohol trihidroksi.
Istilah gliserol berasal dari bahasa Yunani
glykys yang berarti
manis. Gliserol pada temperatur kamar berupa cairan kental tidak
berwarna yang memiliki rasa manis dengan titik didih dan titik leleh
berturut-berturut 290 ºC dan 18 ºC, dapat bercampur dengan air dan
alkohol pada segala perbandingan.
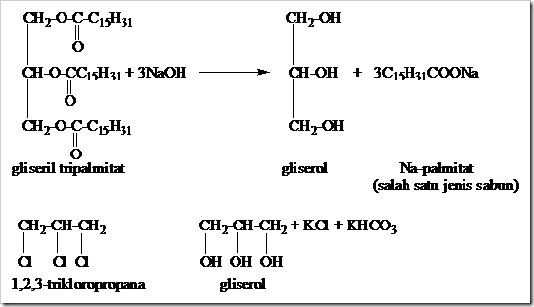
Gliserol di dalam laboratorium digunakan sebagai
pelarut karena memiliki sifat penyerap air (higroskopis). Di dalam
bidang industri gliserol digunakan sebagai bahan pembuat parfum,
pelumas, dan digunakan sebagai bahan pembuat kosmetik karena gliserol
mampu melembutkan kulit.
Gliserol umumnya dibuat dengan cara hidrolis lemak menggunakan NaOH dan hidrolisis 1,2,3-trikloropropana menggunakan K
2CO
3 dan H
2O.




























No comments:
Post a Comment