LAJU REAKSI
TUJUAN PEMBELAJARAN
Setelah mengikuti pembelajaran siswa dapat :
1. mendeskripsikan pengertian laju reaksi,
memahami teori tumbukan untuk menjelaskan faktor-faktor penentu laju dan orde reaksi
serta terapannya dalam kehidupan sehari-hari,
2. menjelaskan faktor-faktor yang mempengaruhi laju reaksi berdasarkan percobaan,
3. menentukan orde reaksi dari data-data percobaan,
4. menjelaskan teori tumbukan pada reaksi kimia,
5. menjelaskan hubungan energi aktivasi dengan laju reaksi,
6. memberikan contoh penerapan laju reaksi pada industri dan kehidupan sehari-hari.
Laju merupakan ukuran perubahan sesuatu yang terjadi dalam satuan waktu.
Laju reaksi merupakan ukuran perubahan konsentrasi dalam satuan waktu
Faktor-faktor yang mempengaruhi laju reaksi adalah konsentrasi pereaksi, suhu, luas permukaan, dan katalis. Didalam industri, faktor-faktor ini sangat diperhatikan karena dapat mempengaruhi produk yang dihasilkan
A. Konsentrasi Larutan
Satuan konsentrasi larutan yang umum digunakan adalah
molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Satuan konsentrasi larutan yang umum digunakan adalah molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Sebagian besar larutan yang ditemui di laboratorium dinyatakan konsentrasinya dalam Molar (M). Secara matematis dapat dirumuskan sebagai berikut:

Jadi Molaritas atau kemolaran merupakan jumlah zat terlarut dalam tiap larutan atau jumlah dalam tiap ml (cm3) larutan
1. Berapakah kemolaran dari larutan berikut ini?
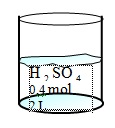
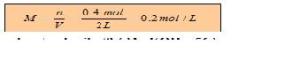
Berdasarkan contoh soal diatas, dapat dicari kemolaran H2SO4 dengan menggunakan rumus M=n/V dimana dari soal dapat diketahui jumlah mol H2SO4 yaitu 0.4 mol dan volume larutan yaitu 2 liter. Dengan menggunakan rumus kemolaran yaitu
Pengenceran larutan
Di laboratorium larutan yang berasal dari pabriknya, biasanya dalam
konsentrasi tinggi, misalnya asam klorida 12 M, dan asam asetat 17 M.
Reaksi-reaksi kimia biasanya dilakukan pada konsentrasi larutan yang rendah
misalnya 1 M atau 0,1 M. Untuk keperluan tersebut, larutan yang pekat harus
diencerkan dahulu dengan menambahkan air. Di dalam pengenceran larutan,
jumlah mol zat pada larutan pekat sama dengan larutan encer, hanya volum
larutannya yang berubah.
Jumlah mol zat terlarut dapat dihitung dengan mengalikan volum (V) dengan
molaritas larutan.
V xM = volum larutan x mol zat terlarut/volum larutan
= mol zat terlarut
Dengan demikian hasil perkalian volum dan molaritas larutan semula (V1M1)
sama dengan hasil perkalian volum dan molaritas larutan setelah pengenceran
(V2M2).

V1 = volum sebelum pengenceran
M1 = konsentrasi molar sebelum pengenceran
V2 = volum sesudah pengenceran
M2 = konsentrasi molar sesudah pengenceran
Contoh Soal
Tentukan konsentrasi larutan yang terjadi jika kedalam 10 mL Na2S2O3 0,5 M
ditambah 10 mL air!
Penyelesaian:
V1M1 = V2M2
10 mL x 05 M = 20 mL x M2
M2 = 0,25
Konsentrasi larutan setelah diencerkan = 0,25 M.
B. KONSEP LAJU REAKSI
Reaksi-reaksi kimia berlangsung dengan laju yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat dan ada reaksi yang berlangsung dengan lambat. Perhatikan gambar berikut ini !
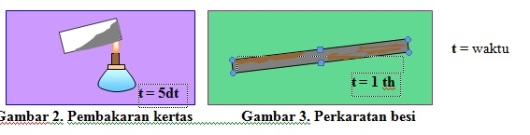
Berdasarkan gambar diatas dapat dilihat bahwa waktu yang diperlukan untuk pembakaran kertas lebih sedikit daripada waktu untuk proses perkaratan besi. Sehingga, reaksi pembakaran kertas berlangsung lebih cepat sedangkan reaksi perkaratan besi berlangsung lebih lambat.
Cepat lambatnya suatu reaksi berlangsung disebut dengan laju reaksi. Dalam kehidupan sehari-hari pengetahuan tentang laju reaksi sangat diperlukan.
Dalam suatu reaksi kimia, zat pereaksi akan bereaksi membentuk zat produk reaksi sehingga jumlah zat pereaksi akan berkurang sedangkan jumlah zat produk reaksi akan bertambah.
Perhatikan grafik berikut ini:
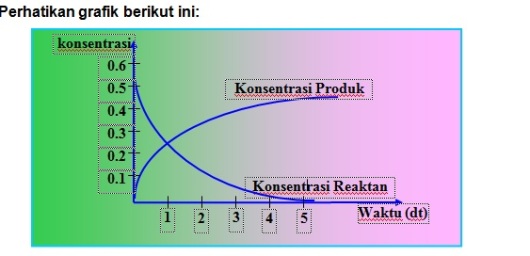
Gambar 4. Grafik Laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa semakin besar waktu maka jumlah reaktan akan …………(sedikit) sedangkan jumlah produk akan ……………(besar) Konsentrasi zat pereaksi atau produk dinyatakan dalam kemolaran (molaritas)
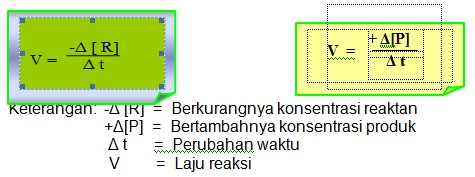
Oleh karena itu, laju reaksi reaktan dan produk reaksi dapat dirumuskan sbb:
contoh soal
1. Berdasarkan eksperimen pada reaksi:
H2O2 (aq) + 2HI (aq)→ 2H2O (l) + I2 (aq)
Diketahui bahwa konsentrasi I2 bertambah dari 0 menjadi 0.002 mol/L dalam 10 detik. Tentukan laju reaksi untuk reaksi tersebut !
Dari reaksi diatas dapat dilihat bahwa produk reaksi tersebut adalah I2. maka untuk mencari laju reaksi dari reaksi tersebut dapat digunakan persamaan berikut:
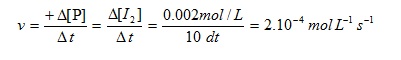
C. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Laju reaksi akan lebih cepat terjadi jika tumbukan antar partikel zat yang bereaksi lebih banyak. Beberapa faktor-faktor yang mempengaruhi banyaknya tumbukan terlihat pada bagan berikut:

Bagan 1.Faktor yang mempengaruhi Laju Reaksi
1. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
Perhatikan gambar berikut:
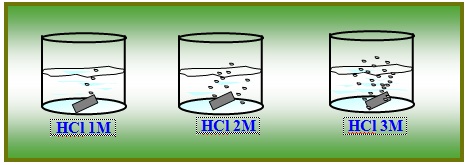
Gambar 5. reaksi pita Mg dengan HCl
Berdasarkan gambar diatas, dapat dilihat bahwa larutan HCl mempunyai berbagai konsentrasi yaitu ….. (1) M……, (2)M dan … …. (3)M
Magnesium (Mg) yang dimasukkan kedalam larutan HCl akan bereaksi dengan persamaan sebagai berikut:
Mg (s) + 2HCl (aq) →MgCl2 (aq) (4) + H2 (g)
Table.1 hasil percobaan reaksi Mg dengan HCl
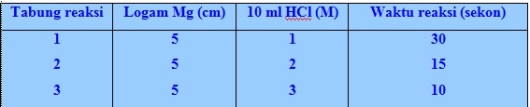
Dari data hasil percobaan yang ada pada gambar dan tabel.1 maka dapat diketahui bahwa semakin tinggi konsentrasi HCl, semakin … Mg habis bereaksi dan waktu yang diperlukan semakin kecil
Makin besar konsentrasi, laju reaksi makin cepat
2. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI
Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Reaksi dapat terjadi antara reaktan-reaktan yang fasenya sama misalnya, cair dengan cair ataupun yang fasenya berbeda cair dengan padat. Pada pencampuran reaktan yang terdiri dari dua fase atau lebih, tumbukan berlangsung pada bagian permukaan zat. Laju seperti itu, dapat diperbesar dengan memperluas permukaan sentuhan zat itu dengan cara memperkecil ukuran partikelnya.
Perhatikan percobaan berikut ini !

Gambar 6. percobaan reaksi CaCO3 dan HCl
Persamaan reaksi yang terjadi adalah sebagai berikut:
CaCO3(s) + 2HCl(aq)→ CaCl2(aq) + H2O(l) + CO2(g)
Waktu reaksi dari masing-masing percobaan adalah seperti pada table.2 berikut:
Tabel 2. laju reaksi CaCO3 dan HCl

Berdasarkan data dari table.2, dapat disimpulkan sebagai berikut:
Makin luas permukaan bidang sentuh, makin cepat laju reaksinya
3. PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
Pengaruh temperature terhadap laju reaksi dapat kita lihat dalam kehidupan sehari-hari. Misalnya makanan kentang akan lebih cepat masak jika digoreng dalam minyak panas dibandingkan jika direbus dalam air. Hal ini karena suhu minyak panas lebih tinggi dibandingkan suhu air mendidih.
Untuk lebih jelasnya tentang pengaruh temperature terhadap laju reaksi perhatikan gambar percobaan berikut ini:

Gambar 7. percobaan reaksi Na2S2O3 dan HCl
Pada gambar.8 diatas, larutan HCl 2M direaksikan dengan larutan Na2S 2O3 0.2M pada suhu yang berbeda yaitu………27°……..(37°) dan ………….(47°). Waktu reaksi dicatat sampai terbentuk endapan belerang didalam gelas kimia.
Persamaan reaksi yang terjadi adalah sebagai berikut:
Na2S2O3(aq) + HCl(aq)→ 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Dari percobaan didapatkan data sebagai berikut;
Table.3 laju reaksi Na2S2O3 dan HCl
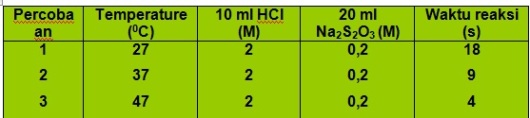
Berdasarkan gambar terlihat bahwa semakin besar temperatur semakin cepat endapan terbentuk dan dari data percobaan pada table.3 dapat dilihat bahwa semakin besar temperature, maka waktu yang diperlukan untuk mereaksikan antara HCl dan Na2S2O3 semakin kecil, berarti laju reaksi semakin cepat.
Dengan demikian dapat disimpulkan bahwa:
Makin tinggi temperatur pereaksi, makin cepat laju reaksinya.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Katalis merupakan suatu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara permanen (kekal), sehingga di akhir reaksi zat tersebut dapat diperoleh kembali.
Untuk lebih memahami mengenai pengertian katalis, perhatikan percobaan penguraian hidrogen peroksida (H2O2) berikut ini:
2H2O2(l)→ 2H2O(l) + O2(g)
Larutan H2O2 5% masing-masing 50 ml dimasukkan kedalam tiga gelas kimia.
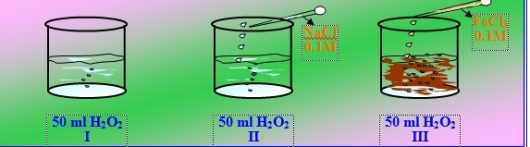
Gambar 8. Percobaan penguraian H2O2
Dari gambar diatas, dapat dilihat bahwa pada tabung I terjadi penguraian H2O2 yang ditandai dengan timbulnya sedikit gelembung. Pada tabung II H2O2 ditambah dengan NaCl 0.1M, tetapi tidak mempengaruhi proses penguraian H2O2 karena gelembung yang timbul tetap sedikit. Sedangkan pada tabung III ditambah dengan FeCl3. Pada saat ditambah dengan FeCl3 terlihat bahwa gelembung semakin banyak dan warna larutan berubah menjadi coklat.
Berdasarkan data dan hasil pengamatan diatas dapat disimpulkan sebagai berikut:
1. Pereaksi yang merupakan katalis adalah …FeCl3
2. Pereaksi yang bukan merupakan katalis adalah NaCl
3. Tanpa katalis reaksi berlangsung ………cepat
4. Dengan katalis reaksi berlangsung………lambat
Berdasarkan percobaan ini maka dapat disimpulkan katalis adalah zat yang dapat mempercepat suatu reaksi tanpa ikut bereaksi
D.TEORI TUMBUKAN
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatu tumbukan. Tumbukan ada yang menghasilkan reaksi dan ada yang tidak menghasilkan reaksi. Tumbukan yang menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel. Perhatikan reaksi antara gas Nitrogen Oksida (NO) dengan ozon (O3) berikut ini: NO (g) + O3 (g)→ NO2 (g) + O2 (g)
Berdasarkan pada gambar diatas, dari gambar (a) dapat dilihat bahwa orientasi partikel antara O dengan N tidak tepat sehingga tidak menghasilkan tumbukan efektif. Sedangkan pada gambar (b) orientasi partikel sudah tepat sehingga menghasilkan tumbukan efektif dan akan membentuk produk reaksi yaitu NO2 dan O2
Faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, luas permukaan, suhu dan katalis berhubungan dengan tumbukan antar partikel. Mengapa demikian ? Hal ini dapat dijelaskan sebagai berikut
1.PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Perhatikan gambar berikut:
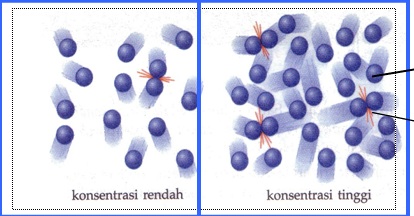
Gambar 10. pengaruh konsentrasi terhadap laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
2.PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI BERDASARKAN TEORI TUMBUKAN
Untuk massa yang sama, semakin halus bentuk suatu zat maka semakin luas permukaan zat. Berdasarkan teori tumbukan: “semakin luas permukaan partikel, semakin besar kemungkinan terjadinya tumbukan antar partikel”.
Perhatikan gambar berikut ini!

Gambar 11. pengaruh luas permukaan terhadap laju reaksi
Dari gambar 11 dapat dilihat bahwa serbuk Fe bereaksi lebih cepat dari pada batang Fe. Hal ini disebabkan karena luas permukaan serbuk Fe lebih luas daripada kepingan Fe, sehingga bidang sentuhnya lebih banyak untuk bertumbukan dengan zat lain. Akibatnya laju reaksi zat berbentuk serbuk lebih cepat daripada zat yang berbentuk kepingan.
3.PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Pengaruh temperatur terhadap laju reaksi terkait dengan energi kinetik partikel. Mengapa demikian ? Perhatikan gambar berikut ini:
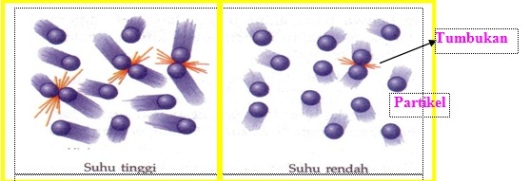
Gambar 13. tumbukan partikel pada suhu tinggi dan rendah.
Berdasarkan gambar diatas dapat dilihat bahwa pada suhu tinggi, jumlah partikel yang bertumbukan lebih banyak dibandingkan pada suhu rendah. Hal ini disebabkan karena pada suhu tinggi energi kinetik partikel akan lebih besar. Hal ini menyebabkan jumlah tumbukan semakin banyak sehingga laju reaksi akan meningkat.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
Katalis yang mempercepat laju reaksi disebut katalis………………….(+) atau katalis saja. Sedangkan katalis yang memperlambat laju reaksi disebut katalis……………….(-) atau lebih umum disebut Inhibitor.
Perhatikan bagan berkut ini:

Berdasarkan bagan diatas, katalis dapat dikelompokkan menjadi dua yaitu
1. katalis organik contohnya V2O5,Pt,Fe,Rh
2. katalis anorganik, contohnya renim,enzim dari ragi dan tripsin
Hubungan antara katalis dan energi pengaktifan

Gambar 14. grafik pengaruh katalis terhadap energi pengaktifan (Ea)
Dengan memperhatikan gambar.14 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
E. PERSAMAAN LAJU REAKSI DAN ORDE REAKSI
Laju reaksi diperoleh berdasarkan eksperimen. Persamaan laju reaksi melibatkan konsentrasi pereaksi dan produk reaksi.
Berdasarkan bPada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat
pereaksi hanya diturunkan dari data eksperimen. Bilangan pangkat yang
menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi disebut orde
reaksi. Untuk reaksi a A + b B → c C + d D, persamaan laju reaksi ditulis:
dengan:
V = k [A]m [B]n
Orde reaksi total = m + n
Ket: v = laju reaksi
k = tetapan laju reaksi
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
m = orde reaksi terhadap A
n = orde reaksi terhadap B
Untuk lebih memahami tentang cara penentuan persamaan laju reaksi dan orde reaksi maka perhatikanlah contoh berikut ini:
Contoh soal:
2NO + 2H2 N2 + 2H2O

Tentukan:
a. Orde reaksi
b. Persamaan laju reaksi
c. Tetapan laju reaksi (k)
d. Laju reaksi jika NO 0.2 molar direaksikan dengan H2 0.2 molar.
Jawab:
Persamaan laju reaksi adalah v = k [NO]m[H2]n
a. Menentukan nilai m dan n
Untuk mencari harga m, yaitu harga reaksi terhadap NO, perhatikan data konsentrasi H2 yang tetap yaitu 1 dan 3. selanjutnya dapat dicari nilai m yaitu dengan membandingkan konsentrasi dengan nilai laju reaksi, yaitu sebagai berikut:
m = 3 dengan cara yang sama tentukanlah nilai n (orde reaksi H2) perhatikan data yang menunjukkan konsentrasi NO tetap dan H2 berubah yaitu data ……..(1) dan …….(2) sehingga dapat dicari nilai n yaitu:
n = 1Jadi Orde reaksi = m + n =3+1=4
b. Persamaan laju reaksi adalah v= k [NO]m[H2]n
V=K[NO]3[H2]
c. Tetapan laju reaksi(k)
Untuk mencari harga k, masukkan salah satu data misalnya data 1 kedalam persamaan laju reaksi.
v= k [NO]m[H2]n
V=K(0,1)3(0,1)
Setelah mengikuti pembelajaran siswa dapat :
1. mendeskripsikan pengertian laju reaksi,
memahami teori tumbukan untuk menjelaskan faktor-faktor penentu laju dan orde reaksi
serta terapannya dalam kehidupan sehari-hari,
2. menjelaskan faktor-faktor yang mempengaruhi laju reaksi berdasarkan percobaan,
3. menentukan orde reaksi dari data-data percobaan,
4. menjelaskan teori tumbukan pada reaksi kimia,
5. menjelaskan hubungan energi aktivasi dengan laju reaksi,
6. memberikan contoh penerapan laju reaksi pada industri dan kehidupan sehari-hari.
Laju merupakan ukuran perubahan sesuatu yang terjadi dalam satuan waktu.
Laju reaksi merupakan ukuran perubahan konsentrasi dalam satuan waktu
Faktor-faktor yang mempengaruhi laju reaksi adalah konsentrasi pereaksi, suhu, luas permukaan, dan katalis. Didalam industri, faktor-faktor ini sangat diperhatikan karena dapat mempengaruhi produk yang dihasilkan
A. Konsentrasi Larutan
Satuan konsentrasi larutan yang umum digunakan adalah
molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Satuan konsentrasi larutan yang umum digunakan adalah molaritas (M). Larutan dengan konsentrasi 1 M artinya di dalam 1 L larutan tersebut terdapat 1 mol zat terlarut
Sebagian besar larutan yang ditemui di laboratorium dinyatakan konsentrasinya dalam Molar (M). Secara matematis dapat dirumuskan sebagai berikut:

Jadi Molaritas atau kemolaran merupakan jumlah zat terlarut dalam tiap larutan atau jumlah dalam tiap ml (cm3) larutan
1. Berapakah kemolaran dari larutan berikut ini?

Berdasarkan contoh soal diatas, dapat dicari kemolaran H2SO4 dengan menggunakan rumus M=n/V dimana dari soal dapat diketahui jumlah mol H2SO4 yaitu 0.4 mol dan volume larutan yaitu 2 liter. Dengan menggunakan rumus kemolaran yaitu

Pengenceran larutan
Di laboratorium larutan yang berasal dari pabriknya, biasanya dalam
konsentrasi tinggi, misalnya asam klorida 12 M, dan asam asetat 17 M.
Reaksi-reaksi kimia biasanya dilakukan pada konsentrasi larutan yang rendah
misalnya 1 M atau 0,1 M. Untuk keperluan tersebut, larutan yang pekat harus
diencerkan dahulu dengan menambahkan air. Di dalam pengenceran larutan,
jumlah mol zat pada larutan pekat sama dengan larutan encer, hanya volum
larutannya yang berubah.
Jumlah mol zat terlarut dapat dihitung dengan mengalikan volum (V) dengan
molaritas larutan.
V xM = volum larutan x mol zat terlarut/volum larutan
= mol zat terlarut
Dengan demikian hasil perkalian volum dan molaritas larutan semula (V1M1)
sama dengan hasil perkalian volum dan molaritas larutan setelah pengenceran
(V2M2).

V1 = volum sebelum pengenceran
M1 = konsentrasi molar sebelum pengenceran
V2 = volum sesudah pengenceran
M2 = konsentrasi molar sesudah pengenceran
Contoh Soal
Tentukan konsentrasi larutan yang terjadi jika kedalam 10 mL Na2S2O3 0,5 M
ditambah 10 mL air!
Penyelesaian:
V1M1 = V2M2
10 mL x 05 M = 20 mL x M2
M2 = 0,25
Konsentrasi larutan setelah diencerkan = 0,25 M.
B. KONSEP LAJU REAKSI
Reaksi-reaksi kimia berlangsung dengan laju yang berbeda-beda. Ada reaksi yang berlangsung sangat cepat dan ada reaksi yang berlangsung dengan lambat. Perhatikan gambar berikut ini !

Berdasarkan gambar diatas dapat dilihat bahwa waktu yang diperlukan untuk pembakaran kertas lebih sedikit daripada waktu untuk proses perkaratan besi. Sehingga, reaksi pembakaran kertas berlangsung lebih cepat sedangkan reaksi perkaratan besi berlangsung lebih lambat.
Cepat lambatnya suatu reaksi berlangsung disebut dengan laju reaksi. Dalam kehidupan sehari-hari pengetahuan tentang laju reaksi sangat diperlukan.
Dalam suatu reaksi kimia, zat pereaksi akan bereaksi membentuk zat produk reaksi sehingga jumlah zat pereaksi akan berkurang sedangkan jumlah zat produk reaksi akan bertambah.
Perhatikan grafik berikut ini:

Gambar 4. Grafik Laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa semakin besar waktu maka jumlah reaktan akan …………(sedikit) sedangkan jumlah produk akan ……………(besar) Konsentrasi zat pereaksi atau produk dinyatakan dalam kemolaran (molaritas)
Oleh karena itu, laju reaksi reaktan dan produk reaksi dapat dirumuskan sbb:

contoh soal
1. Berdasarkan eksperimen pada reaksi:
H2O2 (aq) + 2HI (aq)→ 2H2O (l) + I2 (aq)
Diketahui bahwa konsentrasi I2 bertambah dari 0 menjadi 0.002 mol/L dalam 10 detik. Tentukan laju reaksi untuk reaksi tersebut !
Dari reaksi diatas dapat dilihat bahwa produk reaksi tersebut adalah I2. maka untuk mencari laju reaksi dari reaksi tersebut dapat digunakan persamaan berikut:
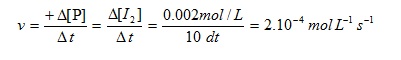
C. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU REAKSI
Laju reaksi akan lebih cepat terjadi jika tumbukan antar partikel zat yang bereaksi lebih banyak. Beberapa faktor-faktor yang mempengaruhi banyaknya tumbukan terlihat pada bagan berikut:

Bagan 1.Faktor yang mempengaruhi Laju Reaksi
1. PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
Perhatikan gambar berikut:

Gambar 5. reaksi pita Mg dengan HCl
Berdasarkan gambar diatas, dapat dilihat bahwa larutan HCl mempunyai berbagai konsentrasi yaitu ….. (1) M……, (2)M dan … …. (3)M
Magnesium (Mg) yang dimasukkan kedalam larutan HCl akan bereaksi dengan persamaan sebagai berikut:
Mg (s) + 2HCl (aq) →MgCl2 (aq) (4) + H2 (g)
Table.1 hasil percobaan reaksi Mg dengan HCl

Dari data hasil percobaan yang ada pada gambar dan tabel.1 maka dapat diketahui bahwa semakin tinggi konsentrasi HCl, semakin … Mg habis bereaksi dan waktu yang diperlukan semakin kecil
Makin besar konsentrasi, laju reaksi makin cepat
2. PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI
Suatu zat akan bereaksi apabila bercampur dan bertumbukan. Reaksi dapat terjadi antara reaktan-reaktan yang fasenya sama misalnya, cair dengan cair ataupun yang fasenya berbeda cair dengan padat. Pada pencampuran reaktan yang terdiri dari dua fase atau lebih, tumbukan berlangsung pada bagian permukaan zat. Laju seperti itu, dapat diperbesar dengan memperluas permukaan sentuhan zat itu dengan cara memperkecil ukuran partikelnya.
Perhatikan percobaan berikut ini !

Gambar 6. percobaan reaksi CaCO3 dan HCl
Persamaan reaksi yang terjadi adalah sebagai berikut:
CaCO3(s) + 2HCl(aq)→ CaCl2(aq) + H2O(l) + CO2(g)
Waktu reaksi dari masing-masing percobaan adalah seperti pada table.2 berikut:
Tabel 2. laju reaksi CaCO3 dan HCl

Berdasarkan data dari table.2, dapat disimpulkan sebagai berikut:
Makin luas permukaan bidang sentuh, makin cepat laju reaksinya
3. PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
Pengaruh temperature terhadap laju reaksi dapat kita lihat dalam kehidupan sehari-hari. Misalnya makanan kentang akan lebih cepat masak jika digoreng dalam minyak panas dibandingkan jika direbus dalam air. Hal ini karena suhu minyak panas lebih tinggi dibandingkan suhu air mendidih.
Untuk lebih jelasnya tentang pengaruh temperature terhadap laju reaksi perhatikan gambar percobaan berikut ini:

Gambar 7. percobaan reaksi Na2S2O3 dan HCl
Pada gambar.8 diatas, larutan HCl 2M direaksikan dengan larutan Na2S 2O3 0.2M pada suhu yang berbeda yaitu………27°……..(37°) dan ………….(47°). Waktu reaksi dicatat sampai terbentuk endapan belerang didalam gelas kimia.
Persamaan reaksi yang terjadi adalah sebagai berikut:
Na2S2O3(aq) + HCl(aq)→ 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Dari percobaan didapatkan data sebagai berikut;
Table.3 laju reaksi Na2S2O3 dan HCl

Berdasarkan gambar terlihat bahwa semakin besar temperatur semakin cepat endapan terbentuk dan dari data percobaan pada table.3 dapat dilihat bahwa semakin besar temperature, maka waktu yang diperlukan untuk mereaksikan antara HCl dan Na2S2O3 semakin kecil, berarti laju reaksi semakin cepat.
Dengan demikian dapat disimpulkan bahwa:
Makin tinggi temperatur pereaksi, makin cepat laju reaksinya.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Katalis merupakan suatu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara permanen (kekal), sehingga di akhir reaksi zat tersebut dapat diperoleh kembali.
Untuk lebih memahami mengenai pengertian katalis, perhatikan percobaan penguraian hidrogen peroksida (H2O2) berikut ini:
2H2O2(l)→ 2H2O(l) + O2(g)
Larutan H2O2 5% masing-masing 50 ml dimasukkan kedalam tiga gelas kimia.

Gambar 8. Percobaan penguraian H2O2
Dari gambar diatas, dapat dilihat bahwa pada tabung I terjadi penguraian H2O2 yang ditandai dengan timbulnya sedikit gelembung. Pada tabung II H2O2 ditambah dengan NaCl 0.1M, tetapi tidak mempengaruhi proses penguraian H2O2 karena gelembung yang timbul tetap sedikit. Sedangkan pada tabung III ditambah dengan FeCl3. Pada saat ditambah dengan FeCl3 terlihat bahwa gelembung semakin banyak dan warna larutan berubah menjadi coklat.
Berdasarkan data dan hasil pengamatan diatas dapat disimpulkan sebagai berikut:
1. Pereaksi yang merupakan katalis adalah …FeCl3
2. Pereaksi yang bukan merupakan katalis adalah NaCl
3. Tanpa katalis reaksi berlangsung ………cepat
4. Dengan katalis reaksi berlangsung………lambat
Berdasarkan percobaan ini maka dapat disimpulkan katalis adalah zat yang dapat mempercepat suatu reaksi tanpa ikut bereaksi
D.TEORI TUMBUKAN
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatu tumbukan. Tumbukan ada yang menghasilkan reaksi dan ada yang tidak menghasilkan reaksi. Tumbukan yang menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel. Perhatikan reaksi antara gas Nitrogen Oksida (NO) dengan ozon (O3) berikut ini: NO (g) + O3 (g)→ NO2 (g) + O2 (g)
Berdasarkan pada gambar diatas, dari gambar (a) dapat dilihat bahwa orientasi partikel antara O dengan N tidak tepat sehingga tidak menghasilkan tumbukan efektif. Sedangkan pada gambar (b) orientasi partikel sudah tepat sehingga menghasilkan tumbukan efektif dan akan membentuk produk reaksi yaitu NO2 dan O2
Faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, luas permukaan, suhu dan katalis berhubungan dengan tumbukan antar partikel. Mengapa demikian ? Hal ini dapat dijelaskan sebagai berikut
1.PENGARUH KONSENTRASI TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Perhatikan gambar berikut:

Gambar 10. pengaruh konsentrasi terhadap laju reaksi
Berdasarkan gambar diatas dapat dilihat bahwa konsentrasi pereaksi berkaitan dengan jumlah partikel zat yang terlibat dalam tumbukan. Bila pereaksi bertambah, maka jumlah partikel-partikel yang bertumbukan akan semakin banyak/meningkat. Dengan demikian jarak antara partikel.zat tersebut menjadi lebih dekat dan jumlah tumbukkan efektif juga akan meningkat. Hal ini berarti terjadi peningkatan laju suatu reaksi. Dan sebaliknya, jika konsentrasi berkurang, maka tumbukan akan sedikit dan laju reaksi juga akan berkurang.
2.PENGARUH LUAS PERMUKAAN TERHADAP LAJU REAKSI BERDASARKAN TEORI TUMBUKAN
Untuk massa yang sama, semakin halus bentuk suatu zat maka semakin luas permukaan zat. Berdasarkan teori tumbukan: “semakin luas permukaan partikel, semakin besar kemungkinan terjadinya tumbukan antar partikel”.
Perhatikan gambar berikut ini!

Gambar 11. pengaruh luas permukaan terhadap laju reaksi
Dari gambar 11 dapat dilihat bahwa serbuk Fe bereaksi lebih cepat dari pada batang Fe. Hal ini disebabkan karena luas permukaan serbuk Fe lebih luas daripada kepingan Fe, sehingga bidang sentuhnya lebih banyak untuk bertumbukan dengan zat lain. Akibatnya laju reaksi zat berbentuk serbuk lebih cepat daripada zat yang berbentuk kepingan.
3.PENGARUH TEMPERATUR TERHADAP LAJU REAKSI
BERDASARKAN TEORI TUMBUKAN
Pengaruh temperatur terhadap laju reaksi terkait dengan energi kinetik partikel. Mengapa demikian ? Perhatikan gambar berikut ini:

Gambar 13. tumbukan partikel pada suhu tinggi dan rendah.
Berdasarkan gambar diatas dapat dilihat bahwa pada suhu tinggi, jumlah partikel yang bertumbukan lebih banyak dibandingkan pada suhu rendah. Hal ini disebabkan karena pada suhu tinggi energi kinetik partikel akan lebih besar. Hal ini menyebabkan jumlah tumbukan semakin banyak sehingga laju reaksi akan meningkat.
4. PENGARUH KATALIS TERHADAP LAJU REAKSI
Pengaruh katalis dalam mempengaruhi laju reaksi terkait dengan energi pengaktifan reaksi (Ea). Katalis yang digunakan untuk mempercepat reaksi memberikan suatu mekanisme reaksi alternatif dengan nilai Ea yang lebih rendah dibandingkan dengan nilai Ea reaksi tanpa katalis. Semakin rendah nilai Ea maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk mengatasi halangan Ea yang rendah ini. Hal ini menyebabkan jumlah tumbukan efektif akan bertambah, sehingga laju reaksi juga akan meningkat.
Katalis yang mempercepat laju reaksi disebut katalis………………….(+) atau katalis saja. Sedangkan katalis yang memperlambat laju reaksi disebut katalis……………….(-) atau lebih umum disebut Inhibitor.
Perhatikan bagan berkut ini:

Berdasarkan bagan diatas, katalis dapat dikelompokkan menjadi dua yaitu
1. katalis organik contohnya V2O5,Pt,Fe,Rh
2. katalis anorganik, contohnya renim,enzim dari ragi dan tripsin
Hubungan antara katalis dan energi pengaktifan

Gambar 14. grafik pengaruh katalis terhadap energi pengaktifan (Ea)
Dengan memperhatikan gambar.14 diatas dapat dilihat bahwa tanpa katalis, energi pengaktifan (Ea) suatu reaksi lebih banyak, sedangkan dengan menggunakan katalis, Ea menjadi lebih sedikit, sehingga laju reaksi menjadi lebih cepat. Ini berarti bahwa katalis dapat meningkatkan energi pengaktifan suatu reaksi, sehingga laju reaksi menjadi semakin besar.
E. PERSAMAAN LAJU REAKSI DAN ORDE REAKSI
Laju reaksi diperoleh berdasarkan eksperimen. Persamaan laju reaksi melibatkan konsentrasi pereaksi dan produk reaksi.
Berdasarkan bPada umumnya hubungan antara laju reaksi dengan konsentrasi zat-zat
pereaksi hanya diturunkan dari data eksperimen. Bilangan pangkat yang
menyatakan hubungan konsentrasi zat pereaksi dengan laju reaksi disebut orde
reaksi. Untuk reaksi a A + b B → c C + d D, persamaan laju reaksi ditulis:
dengan:
V = k [A]m [B]n
Orde reaksi total = m + n
Ket: v = laju reaksi
k = tetapan laju reaksi
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
m = orde reaksi terhadap A
n = orde reaksi terhadap B
Untuk lebih memahami tentang cara penentuan persamaan laju reaksi dan orde reaksi maka perhatikanlah contoh berikut ini:
Contoh soal:
2NO + 2H2 N2 + 2H2O

Tentukan:
a. Orde reaksi
b. Persamaan laju reaksi
c. Tetapan laju reaksi (k)
d. Laju reaksi jika NO 0.2 molar direaksikan dengan H2 0.2 molar.
Jawab:
Persamaan laju reaksi adalah v = k [NO]m[H2]n
a. Menentukan nilai m dan n
Untuk mencari harga m, yaitu harga reaksi terhadap NO, perhatikan data konsentrasi H2 yang tetap yaitu 1 dan 3. selanjutnya dapat dicari nilai m yaitu dengan membandingkan konsentrasi dengan nilai laju reaksi, yaitu sebagai berikut:
m = 3 dengan cara yang sama tentukanlah nilai n (orde reaksi H2) perhatikan data yang menunjukkan konsentrasi NO tetap dan H2 berubah yaitu data ……..(1) dan …….(2) sehingga dapat dicari nilai n yaitu:
n = 1Jadi Orde reaksi = m + n =3+1=4
b. Persamaan laju reaksi adalah v= k [NO]m[H2]n
V=K[NO]3[H2]
c. Tetapan laju reaksi(k)
Untuk mencari harga k, masukkan salah satu data misalnya data 1 kedalam persamaan laju reaksi.
v= k [NO]m[H2]n
V=K(0,1)3(0,1)








No comments:
Post a Comment