IKATAN KIMIA
Ikatan kimia adalah sebuah
proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik
antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik
atau poliatomik menjadi stabil
- Definisi Ikatan Kimia
a) atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron (serah terima elektron)
b) penggunaan bersama pasangan elektron yang berasal dari masing-masing atom yang berikatan
c) penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan
- Tujuan pembentukan ikatan kimia adalah agar terjadi pencapaian kestabilan suatu unsur.
- Elektron yang berperan pada pembentukan ikatan kimia adalah elektron valensi dari suatu atom/unsur yang terlibat.
- Salah 1 petunjuk dalam pembentukan ikatan kimia adalah adanya 1 golongan unsur yang stabil yaitu golongan VIIIA atau golongan 18 (gas mulia).
- Maka dari itu, dalam pembentukan ikatan kimia; atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia.
- Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet) atau 2 (duplet, yaitu atom Helium).
Periode
|
Unsur
|
Nomor Atom
|
K
|
L
|
M
|
N
|
O
|
P
|
1
|
He
|
2
|
2
|
|||||
2
|
Ne
|
10
|
2
|
8
|
||||
3
|
Ar
|
18
|
2
|
8
|
8
|
|||
4
|
Kr
|
36
|
2
|
8
|
18
|
8
|
||
5
|
Xe
|
54
|
2
|
8
|
18
|
18
|
8
|
|
6
|
Rn
|
86
|
2
|
8
|
18
|
32
|
18
|
8
|
- Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet
- Lambang Lewis
- Lambang Lewis gas mulia menunjukkan 8 elektron valensi (4 pasang).
- Lambang Lewis unsur dari golongan lain menunjukkan adanya elektron tunggal (belum berpasangan).
1.ikatan ion
Anda tentu tidak asing lagi dengan garam dapur. Hampir setiap
masakan yang Anda makan pasti mengandung garam dapur. Senyawa kimia yang
memiliki rumus kimia NaCl ini berwujud padat, namun mudah rapuh. Garam
dapur juga memiliki titik didih yang sangat tinggi. Tahukah Anda,
mengapa garam dapur memiliki sifat seperti itu? Sifat dari suatu senyawa
kimia termasuk garam dapur dipengaruhi oleh jenis ikatan kimia dan
struktur senyawa tersebut.
Atom Na memiliki konfigurasi elektron 2 8 1 sehingga elektron
valensinya 1. Adapun konfigurasi elektron atom Cl adalah 2 8 7 sehingga
elektron valensinya adalah 7. Dalam keadaan netral, atom Na dan Cl
memiliki jumlah elektron dan proton yang sama banyak. Atom Na memiliki
11 proton dan 11 elektron, sedangkan atom Cl memiliki 17 proton dan 17
elektron. Pada keadaan ini, atom Na dan Cl tidak stabil. Berdasarkan
kaidah oktet, untuk mencapai kestabilannya, atom Na harus melepaskan 1
elektron, sedangkan atom Cl membutuhkan 1 elektron. Apakah yang terjadi
jika atom Na melepaskan elektron dan atom Cl menerima 1 elektron? Atom
Na akan bermuatan positif karena jumlah proton lebih banyak daripada
jumlah elektron. Adapun atom Cl akan bermuatan negatif karena jumlah
proton lebih sedikit daripada jumlah elektron. Dengan demikian, atom Na
dan Cl dapat mencapai kestabilannya dengan cara serah terima elektron.
Atom Na menyerahkan 1 elektron kepada atom Cl sehingga atom Cl menerima 1
elektron dari atom Na.
Karena berbeda muatan, ion Na+ dan ion Cl– akan saling
tarik-menarik. Interaksi yang dinamakan interaksi elektrostatik ini
berlangsung secara terus menerus. Ikatan kimia yang terbentuk dengan
cara serah terima elektron, seperti pembentukan NaCl, dinamakan ikatan
ion. Senyawa yang terbentuk melalui ikatan ion disebut senyawa
ion. Garam dapur (NaCl) merupakan senyawa ionik yang penting dalam
kehidupan sehari-hari. Petani garam memperoleh kristal NaCl secara
tradisional yaitu dengan cara menguapkan air laut dengan bantuan sinar
matahari. Jutaan atau bahkan miliaran ion Na+ dan ion Cl– dalam garam
saling tarik-menarik sehingga membentuk struktur ion raksasa. Bagian
kecil dari struktur ion raksasa NaCl dapat diamati pada gambar berikut.

Ion Na+ dan Cl– memiliki interaksi elektrostatik yang sangat kuat
sehingga untuk memutuskan ikatan tersebut diperlukan energi yang cukup
tinggi. Itulah sebabnya senyawa NaCl memiliki titik didih yang sangat
tinggi, yaitu 1.465 °C. Selain titik didih yang sangat tinggi, NaCl juga
memiliki sifat mudah rapuh. Mengapa demikian? Struktur NaCl tersusun
atas beberapa lapisan.
Bayangkanlah apa yang akan terjadi jika lapisan bagian atas kristal NaCl diberikan dorongan.
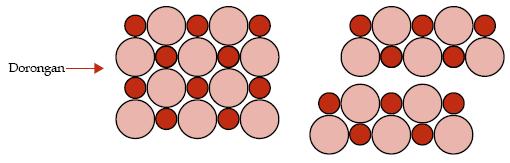
Lapisan bagian atas akan bergeser sehingga ion-ion pada lapisan
atas dan lapisan di bawahnya yang bermuatan sama akan saling berhadapan.
Anda tentu telah mengetahui bahwa ion-ion yang bermuatan sama akan
tolak-menolak. Dengan demikian, ikatan akan terlepas sehingga tidak
heran jika garam dapur mudah rapuh. Ujilah kerapuhan garam dapur yang
masih berbentuk balok.
Senyawa yang mempunyai ikatan ion antara lain :
a) Golongan alkali (IA) [kecuali atom H] dengan golongan halogen (VIIA)
Contoh : NaF, KI, CsF
b) Golongan alkali (IA) [kecuali atom H] dengan golongan oksigen (VIA)
Contoh : Na2S, Rb2S,Na2O
c) Golongan alkali tanah (IIA) dengan golongan oksigen (VIA)
Contoh : CaO, BaO, MgS
Sifat umum senyawa ionik :
1) Titik didih dan titik lelehnya tinggi
2) Keras, tetapi mudah patah
3) Penghantar panas yang baik
4) Lelehan maupun larutannya dapat menghantarkan listrik (elektrolit)
5) Larut dalam air
2.Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi antara unsur nonlogam
dengan unsur nonlogam yang lain dengan cara pemakaian bersama pasangan
elektron. Adakalanya dua atom dapat menggunakan lebih dari satu pasang
elektron. Apabila yang digunakan bersama dua pasang atau tiga pasang
maka akan terbentuk ikatan kovalen rangkap dua atau rangkap tiga. Jumlah
elektron valensi yang digunakan untuk berikatan tergantung pada
kebutuhan tiap atom untuk mencapai konfigurasi elektron seperti gas
mulia (kaidah duplet atau oktet).
Penggunaan bersama pasangan elektron digambarkan oleh Lewis
menggunakan titik elektron. Rumus Lewis merupakan tanda atom yang di
sekelilingnya terdapat titik, silang atau bulatan kecil yang
menggambarkan elektron valensi atom yang bersangkutan.

Apabila dua atom hidrogen membentuk ikatan maka masing-masing atom
menyumbangkan sebuah elektron dan membentuk sepasang elektron yang
digunakan bersama. Sepasang elektron bisa digantikan dengan sebuah garis
yang disebut tangan ikatan.

Jumlah tangan dapat menggambarkan jumlah ikatan dalam suatu senyawa
kovalen. Pada molekul H2 di atas ikatannya disebut ikatan kovalen
tunggal. Molekul O2 terjadi dari dua atom oksigen dengan ikatan kovalen
rangkap, sedangkan pada molekul N2 terdapat tiga ikatan kovalen yang
disebut ikatan kovalen rangkap tiga.

Contoh Pembentukan ikatan antara 1H dengan 7N membentuk NH3.
konfigurasi elektron
1H = 1
7N = 2 5
Atom nitrogen memerlukan tiga elektron untuk mendapatkan susunan
elektron gas mulia, sedangkan setiap atom hidrogen memerlukan sebuah
elektron untuk mempunyai konfigurasi elektron seperti gas helium. Oleh
karena itu, setiap atom nitrogen memerlukan tiga atom hidrogen.

Sifat-sifat senyawa kovalen sebagai berikut.
- Pada suhu kamar umumnya berupa gas (misal H2, O2, N2, Cl2, CO2), cair (misalnya: H2O dan HCl), ataupun berupa padatan.
- Titik didih dan titik lelehnya rendah, karena gaya tarik-menarik antarmolekulnya lemah meskipun ikatan antaratomnya kuat.
- Larut dalam pelarut nonpolar dan beberapa di antaranya dapat berinteraksi dengan pelarut polar.
-
Larutannya dalam air ada yang menghantar arus listrik (misal HCl) tetapi sebagian besar tidak dapat menghantarkan arus listrik, baik padatan, leburan, atau larutannya.
Anda dapat memprediksi ikatan kimia apabila mengetahui konfigurasi elektron dari atom unsur tersebut (elektron valensinya). Dari situ akan diketahui jumlah kekurangan elektron masing-masing unsur untuk mencapai kaidah oktet dan dupet (kestabilan struktur seperti struktur elektron gas mulia). Jarak antara dua inti atom yang berikatan disebut panjang ikatan. Sedangkan energi yang diperlukan untuk memutuskan ikatan disebut energi ikatan. Pada pasangan unsur yang sama, ikatan tunggal merupakan ikatan yang paling lemah dan paling panjang. Semakin banyak pasangan elektron
milik bersama, semakin kuat ikatan dan panjang ikatannya semakin kecil/pendek.
3). Ikatan Kovalen Koordinasi / Koordinat / Dativ / Semipolar
- Adalah ikatan yang terbentuk dengan cara penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan [Pasangan Elektron Bebas (PEB)], sedangkan atom yang lain hanya menerima pasangan elektron yang digunakan bersama.
- Pasangan elektron ikatan (PEI) yang menyatakan ikatan dativ digambarkan dengan tanda anak panah kecil yang arahnya dari atom donor menuju akseptor pasangan elektron.
Contoh 1:
- Terbentuknya senyawa
atau
Contoh 2:
- Terbentuknya molekul ozon (O3)
- Agar semua atom O dalam molekul O3 dapat memenuhi aturan oktet maka dalam salah 1 ikatan , oksigen pusat harus menyumbangkan kedua elektronnya.
Rumus struktur :
O
4). Ikatan Logam
v Adalah ikatan yang terbentuk akibat adanya gaya tarik-menarik yang terjadi antara muatan positif dari ion-ion logam dengan muatan negatif dari elektron-elektron yang bebas bergerak.
v Atom-atom logam dapat diibaratkan seperti bola pingpong yang terjejal rapat 1 sama lain.
v Atom logam mempunyai sedikit elektron valensi, sehingga sangat mudah untuk dilepaskan dan membentuk ion positif.
v Maka dari itu kulit terluar atom logam relatif longgar (terdapat banyak tempat kosong) sehingga elektron dapat berpindah dari 1 atom ke atom lain.
v Mobilitas elektron dalam logam sedemikian bebas, sehingga elektron valensi logam mengalami delokalisasi yaitu suatu keadaan dimana elektron valensi tersebut tidak tetap posisinya pada 1 atom, tetapi senantiasa berpindah-pindah dari 1 atom ke atom lain.
Gambar Ikatan Logam
v Elektron-elektron valensi tersebut berbaur membentuk awan elektron yang menyelimuti ion-ion positif logam.
v Struktur logam seperti gambar di atas, dapat menjelaskan sifat-sifat khas logam yaitu :
a). berupa zat padat pada suhu kamar, akibat adanya gaya tarik-menarik yang cukup kuat antara elektron valensi (dalam awan elektron) dengan ion positif logam.
b). dapat ditempa (tidak rapuh), dapat dibengkokkan dan dapat direntangkan menjadi kawat. Hal ini akibat kuatnya ikatan logam sehingga atom-atom logam hanya bergeser sedangkan ikatannya tidak terputus.
c). penghantar / konduktor listrik yang baik, akibat adanya elektron valensi yang dapat bergerak bebas dan berpindah-pindah. Hal ini terjadi karena sebenarnya aliran listrik merupakan aliran elektron.
Polarisasi Ikatan Kovalen
Suatu ikatan kovalen disebut polar, jika Pasangan Elektron Ikatan (PEI) tertarik lebih kuat ke salah 1 atom.
Contoh 1 :
Molekul HCl
Meskipun atom H dan Cl sama-sama menarik pasangan elektron, tetapi keelektronegatifan Cl lebih besar daripada atom H.
Akibatnya atom Cl menarik pasangan elektron ikatan (PEI) lebih kuat daripada atom H sehingga letak PEI lebih dekat ke arah Cl (akibatnya terjadi semacam kutub dalam molekul HCl).
Jadi, kepolaran suatu ikatan kovalen disebabkan oleh adanya perbedaan keelektronegatifan antara atom-atom yang berikatan.
Sebaliknya, suatu ikatan kovalen dikatakan non polar (tidak berkutub), jika PEI tertarik sama kuat ke semua atom.
Contoh 2 :
Dalam tiap molekul di atas, ke-2 atom yang berikatan menarik PEI sama kuat karena atom-atom dari unsur sejenis mempunyai harga keelektronegatifan yang sama.
Akibatnya muatan dari elektron tersebar secara merata sehingga tidak terbentuk kutub.
Contoh 3 :
Meskipun atom-atom penyusun CH4 dan CO2 tidak sejenis, akan tetapi pasangan elektron tersebar secara simetris diantara atom-atom penyusun senyawa, sehingga PEI tertarik sama kuat ke semua atom (tidak terbentuk kutub).
- Momen Dipol ( µ )
Dirumuskan :
µ = Q x r ; 1 D = 3,33 x 10-30 C.m
keterangan :
µ = momen dipol, satuannya debye (D)
Q = selisih muatan, satuannya coulomb (C)
r = jarak antara muatan positif dengan muatan negatif, satuannya meter (m)
Perbedaan antara Senyawa Ion dengan Senyawa Kovalen
No
|
Sifat
|
Senyawa Ion
|
Senyawa Kovalen
|
1
|
Titik didih | Tinggi | Rendah |
2
|
Titik leleh | Tinggi | Rendah |
3
|
Wujud | Padat pada suhu kamar | Padat,cair,gas pada suhu kamar |
4
|
Daya hantar listrik | Padat = isolator
Lelehan = konduktor Larutan = konduktor |
Padat = isolator
Lelehan = isolator Larutan = ada yang konduktor |
5
|
Kelarutan dalam air | Umumnya larut | Umumnya tidak larut |
6
|
Kelarutan dalam trikloroetana (CHCl3) | Tidak larut | Larut |
Pengecualian dan Kegagalan Aturan Oktet
1). Pengecualian Aturan Oktet
a) Senyawa yang tidak mencapai aturan oktet
Meliputi senyawa kovalen biner sederhana dari Be, B dan Al yaitu atom-atom yang elektron valensinya kurang dari empat (4).
Contoh : BeCl2, BCl3 dan AlBr3
b) Senyawa dengan jumlah elektron valensi ganjil
Contohnya : NO2 mempunyai jumlah elektron valensi (5 + 6 + 6) = 17
c) Senyawa dengan oktet berkembang
Unsur-unsur periode 3 atau lebih dapat membentuk senyawa yang melampaui aturan oktet / lebih dari 8 elektron pada kulit terluar (karena kulit terluarnya M, N dst dapat menampung 18 elektron atau lebih).
Contohnya : PCl5, SF6, ClF3, IF7 dan SbCl5
2). Kegagalan Aturan Oktet
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun post transisi.
Contoh :
ü atom Sn mempunyai 4 elektron valensi tetapi senyawanya lebih banyak dengan tingkat oksidasi +2
ü atom Bi mempunyai 5 elektron valensi tetapi senyawanya lebih banyak dengan tingkat oksidasi +1 dan +3
Penyimpangan dari Aturan Oktet dapat berupa :
1) Tidak mencapai oktet
2) Melampaui oktet ( oktet berkembang )
Penulisan Struktur Lewis
Langkah-langkahnya :
1) Semua elektron valensi harus muncul dalam struktur Lewis
2) Semua elektron dalam struktur Lewis umumnya berpasangan
3) Semua atom umumnya mencapai konfigurasi oktet (khusus untuk H, duplet)
4) Kadang-kadang terdapat ikatan rangkap 2 atau 3 (umumnya ikatan rangkap 2 atau 3 hanya dibentuk oleh atom C, N, O, P dan S)
Langkah alternatif : ( syarat utama : kerangka molekul / ion sudah diketahui )
1) Hitung jumlah elektron valensi dari semua atom dalam molekul / ion
2) Berikan masing-masing sepasang elektron untuk setiap ikatan
3) Sisa elektron digunakan untuk membuat semua atom terminal mencapai oktet
4) Tambahkan sisa elektron (jika masih ada), kepada atom pusat
5) Jika atom pusat belum oktet, tarik PEB dari atom terminal untuk membentuk ikatan rangkap dengan atom pusat
Resonansi
- Suatu molekul atau ion tidak dapat dinyatakan hanya dengan satu struktur Lewis.
- Kemungkinan-kemungkinan struktur Lewis yang ekivalen untuk suatu molekul atau ion disebut Struktur Resonansi.
- Dalam molekul SO2 terdapat 2 jenis ikatan yaitu 1 ikatan tunggal () dan 1 ikatan rangkap ().
- Berdasarkan konsep resonansi, kedua ikatan dalam molekul SO2 adalah ekivalen.
- Dalam molekul SO2 itu, ikatan rangkap tidak tetap antara atom S dengan salah 1 dari 2 atom O dalam molekul itu, tetapi silih berganti.
- Tidak satupun di antara ke-2 struktur di atas yang benar untuk SO2, yang benar adalah gabungan atau hibrid dari ke-2 struktur resonansi tersebut.






No comments:
Post a Comment